Какими общими свойствами обладают неметаллы

1. Галогены
1) С кислородом из галогенов реагирует только фтор:
F2 + O2 → O2F2 (или OF2)
Cl2 + O2 → реакция не идет.
2) С водой реагируют все галогены, но по-разному: фтор окисляет воду, другие галогены диспропорционируют в ней:
2F2 + 2H2O → 4HF + O2
Cl2 + H2O → HCl + HClO
3) Все галогены взаимодействуют с водородом:
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
4) Из солей галогены реагируют: 1) с галогенидами (если галоген в простом веществе является более сильным окислителем, чем галоген в соли) и 2) с сульфидами:
Cl2 + CaBr2 → CaCl2 + Br2
Cl2 + CaF2 → реакция не идет, так как Cl2 обладает менее выраженными окислительными свойствами, чем F2.
С сульфидами:
Br2 + Na2S → 2NaBr + S.
Если можем окислить металл:
Cl2 + 2FeCl2 → 2FeCl3
5) Все галогены реагируют с металлами:
3F2 + 2Fe → 2FeF3
3Br2 + 2Fe → 2FeBr3
Cl2 + Cu → CuCl2
Окислительный свойства йода выражены слабее, чем у других галогенов, поэтому с такими металлами, как Fe и Cu, он взаимодействует по-другому:
I2 + Fe → FeI2
I2 + 2Cu — > 2CuI
6) Галогены — сильные окислители, окисляют такие сложные вещества, как H2S, H2O2, NH3, SO2 и др:
Br2 + H2S → S + 2HBr
H2O2 + Cl2 → 2HCl + O2
3Cl2 + 8NH3 → N2 + 6NH4Cl
Cl2 + 2FeCl2 → 2FeCl3
7) Не реагируют с оксидами
8) Не реагируют с кислотами за исключением одной реакции (только I2 и только с концентрированной азотной кислотой):
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t)
9) Диспропорционируют в растворах щелочей:
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2. Сера (желтое вещество, плавает на поверхности воды, не смачиваясь ею)
1) реагирует с кислородом:
S + O2 → SO2
2) Реагирует с водородом:
S + H2 <=> H2S
3) Реагирует с металлами
S + Fe → FeS (t)
2Na + S → Na2S
4) Реагирует со всеми неметаллами, кроме N2, I2 и благородных газов:
S + N2 → реакция не идет
S + I2 → реакция не идет
5S + 2P → P2S5
2S + C → CS2
S + 3F2 → SF6
S + Br2 → SBr2
5) Реагирует с кислотами-окислителями:
S + 6HNO3(конц.)  → H2SO4 + 6NO2 + 2H2O
S + 2HNO3(разб.) → H2SO4 + 2NO
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
3. Азот (прочная тройная связь)
Реагирует только с O2, H2, F2 (со фтором реакции на ЕГЭ не встречаются) и металлами.
1) Реагирует с кислородом (электрический разряд или 2000ºС)
N2 + O2 → 2NO
2) Реагирует с водородом (обратимая, экзотермическая реакция):
N2 + 3H2 <=> 2NH3
3) Реагирует с металлами с образованием нитридов (с Li без нагревания, с остальными — только при нагревании):
N2 + 2Al → 2AlN (t)
N2 + 3Mg → Mg3N2 (t)
4) Не реагирует с H2O, кислотами, оксидами, солями.
4. Фосфор
Основные аллотропные модификации: красный (атомная кристаллическая решетка) и белый (P4, молекулярная кристаллическая решетка). Белый фосфор — ядовитое вещество, самовоспламеняется на воздухе. Красный фосфор стабилен и ядовитым не является.
1) Реагирует с кислородом:
4P + 3O2 → 2P2O3 (недостаток O2)
4P + 5O2 → 2P2O5 (избыток O2)
2) Не реагирует с водородом:
P + H2 → реакция не идет.
3) Диспропорционирует в растворах щелочей:
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
4) Реагирует с кислотами-окислителями:
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
5HNO3(конц.) + P → H3PO4 + 5NO2 + H2O
5HNO3(разб.) + 3P +2H2O → 3H3PO4 + 5NO
5) Окисляется сильными окислителями:
6P + 5KClO3 → 3P2O5 + 5KCl
6) Реагирует с металлами с образованием фосфидов:
P + Na → Na3P
2P + 3Ca → Ca3P2
7) Реагирует с серой, галогенами:
2P + 3Cl2  → 2PCl3 (недостаток Cl2)
2P + 5Cl2 → 2PCl5 (избыток Cl2)
2P + 3I2 → 2PI3 (с I2 возможно только образованием PI3, PI5 не образуется)
8) Реагирует с соединениями P+5:
3PCl5 + 2P → 5PCl3
5. Углерод
1) Реагирует с кислородом:
C + O2 → CO2
2) Реагирует с водородом:
С + 2H2 → CH4
3) Реагирует с кислотами-окислителями:
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
C + 4HNO3(конц.)  → CO2 + 4NO2 + 2H2O (t)
4) Используется при получении фосфора:
Ca3(PO4)2 + 5C + 3SiO2 → 5CO + 2P + 3CaSiO3
6. Кремний
1) Реагирует с кислородом:
Si + O2 → SiO2 (кварц, песок)
2) Не реагирует с водородом:
Si + H2 → реакция не идет.
3) Растворяется в щелочах:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
4) Не реагирует с растворами кислот. Реагирует только с HF:
Si + 4HF → SiF4 + 2H2 (t).

Металлы 1

ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ АТОМЫ классифицируют на Металлы имеют Строение атома: ->R — от 1 до 3 е на внешнем энергетическом уровне Неметаллы имеют Строение атома: —
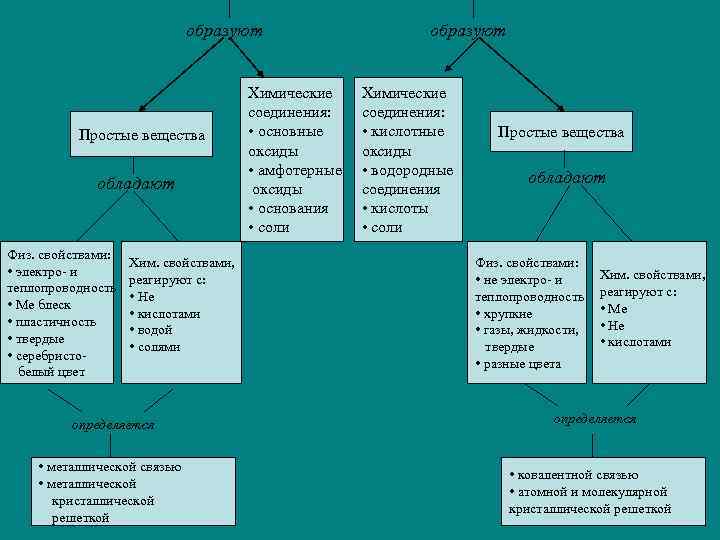
образуют Простые вещества обладают Физ. свойствами: • электро- и теплопроводность • Ме блеск • пластичность • твердые • серебристобелый цвет Хим. свойствами, реагируют с: • Не • кислотами • водой • солями определяется • металлической связью • металлической кристаллической решеткой Химические соединения: • основные оксиды • амфотерные оксиды • основания • соли образуют Химические соединения: • кислотные оксиды • водородные соединения • кислоты • соли Простые вещества обладают Физ. свойствами: • не электро- и теплопроводность • хрупкие • газы, жидкости, твердые • разные цвета Хим. свойствами, реагируют с: • Ме • Не • кислотами определяется • ковалентной связью • атомной и молекулярной кристаллической решеткой
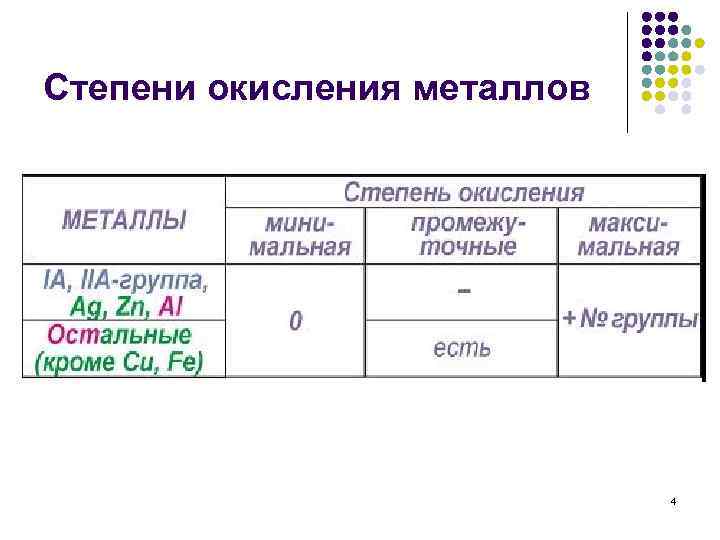
Степени окисления металлов 4
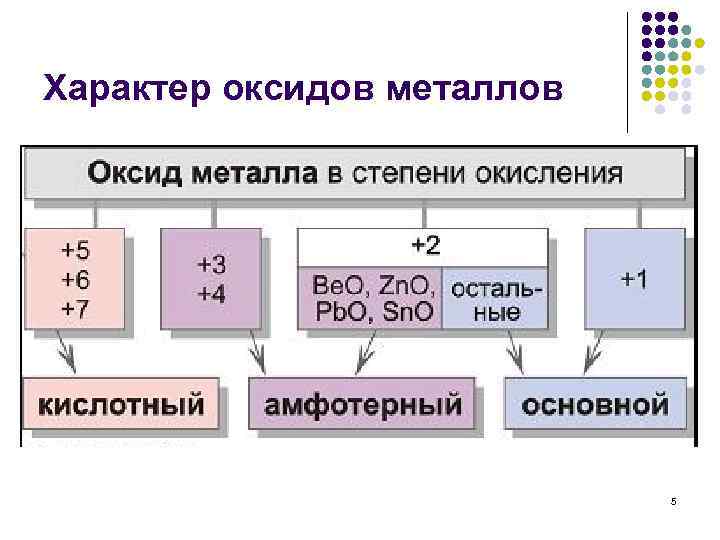
Характер оксидов металлов 5

Положение в периодической системе. Металлы – это химические элементы, атомы которых способны только отдавать электроны, имеют низкие значения электроотрицательности (от 0, 7 до 2, 0), им соответствуют простые вещества, металлы. М е т а л л ы все s-элементы некоторые р-элементы (кроме Н и Не) (III-VI групп) І-А, ІІ-А группа Аl, Sn, Bi… все d- и f-элементы Cu, Zn, Cr, Mn… Чем отличается строение атомов металлов от атомов неметаллов и как это отражается на их химических свойствах? Низшая степень окисления Ме = 0, высшая =№ группы (искл. Ι-Б и VΙΙ-Б).
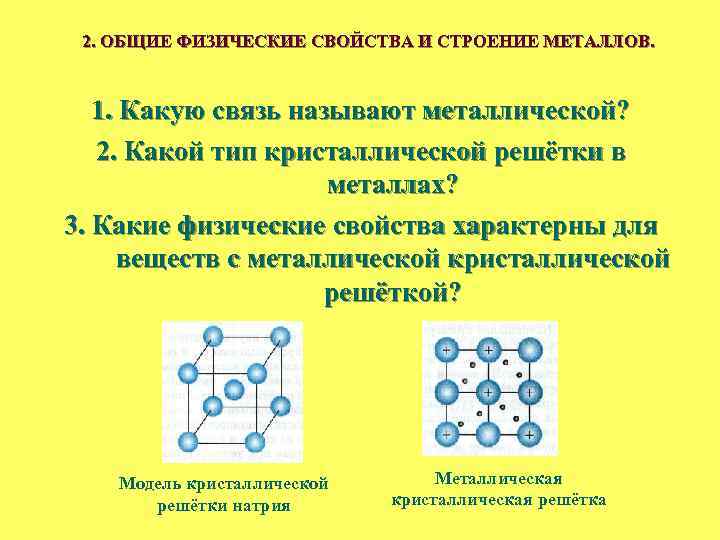
2. ОБЩИЕ ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ МЕТАЛЛОВ. 1. Какую связь называют металлической? 2. Какой тип кристаллической решётки в металлах? 3. Какие физические свойства характерны для веществ с металлической кристаллической решёткой? Модель кристаллической решётки натрия Металлическая кристаллическая решётка
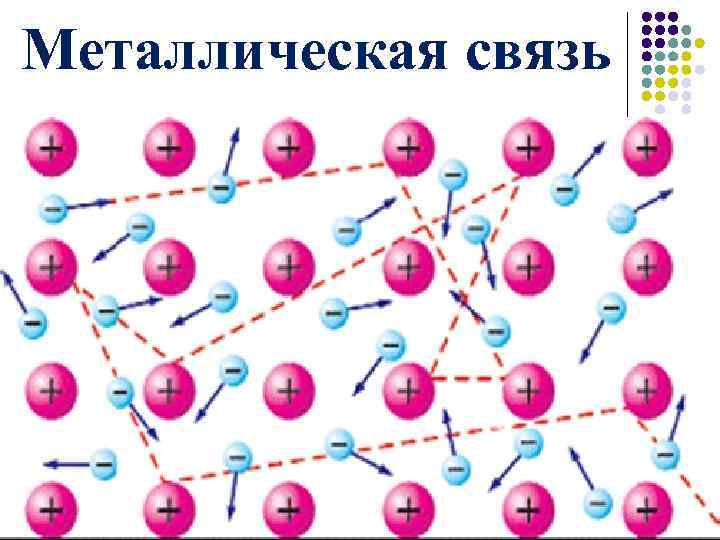
Металлическая связь
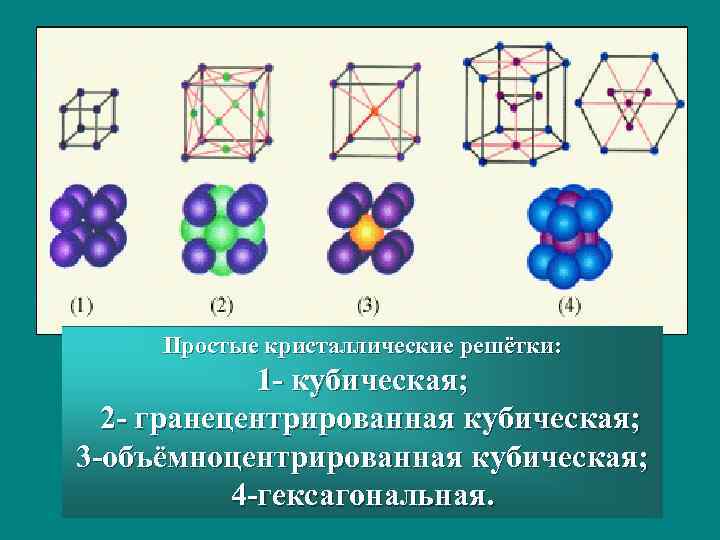
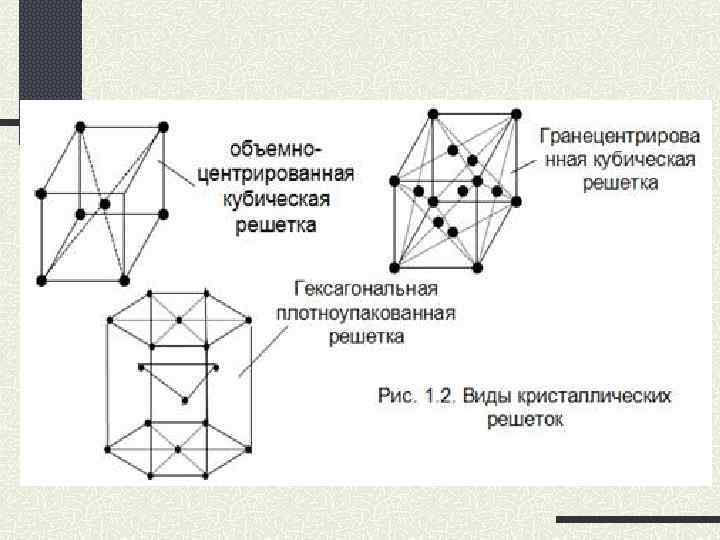
Простые кристаллические решётки: 1 — кубическая; 2 — гранецентрированная кубическая; 3 -объёмноцентрированная кубическая; 4 -гексагональная.
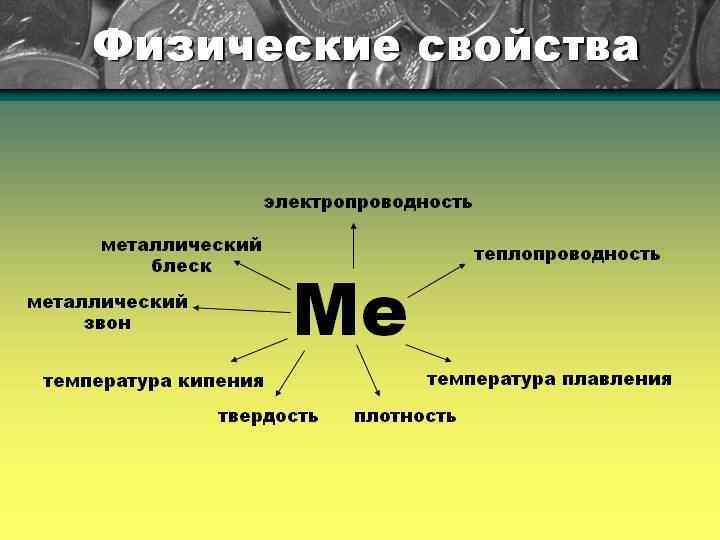

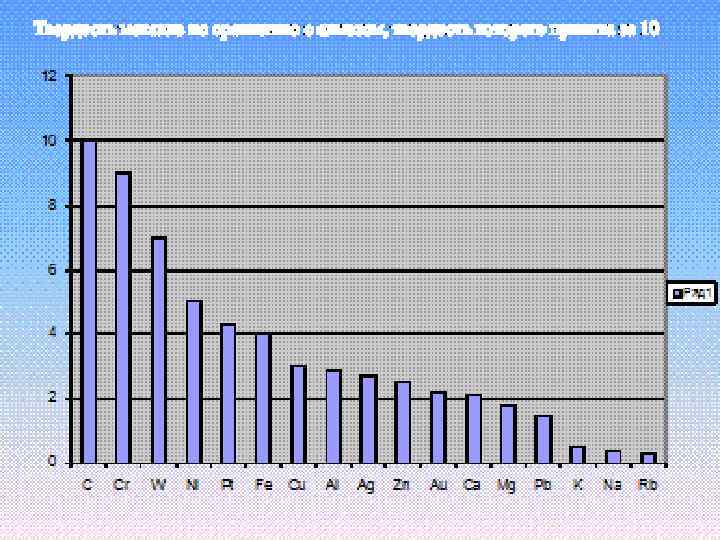
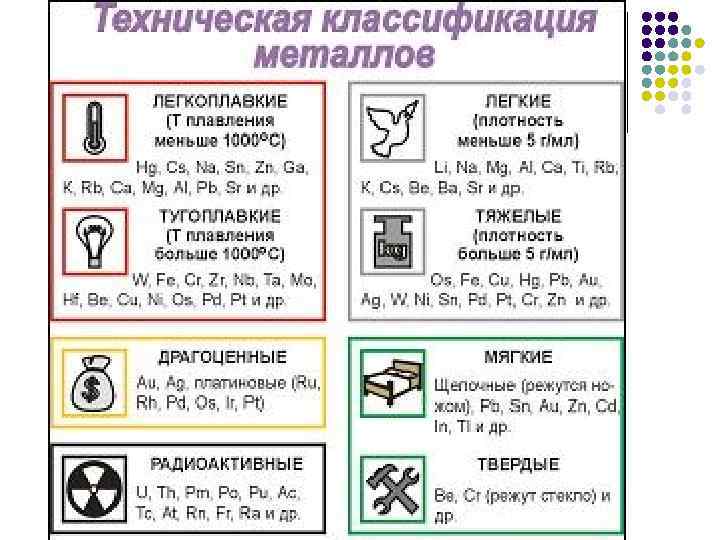
Твердые вещества, кроме ртути. (самый мягкий – калий, самый твердый – хром)

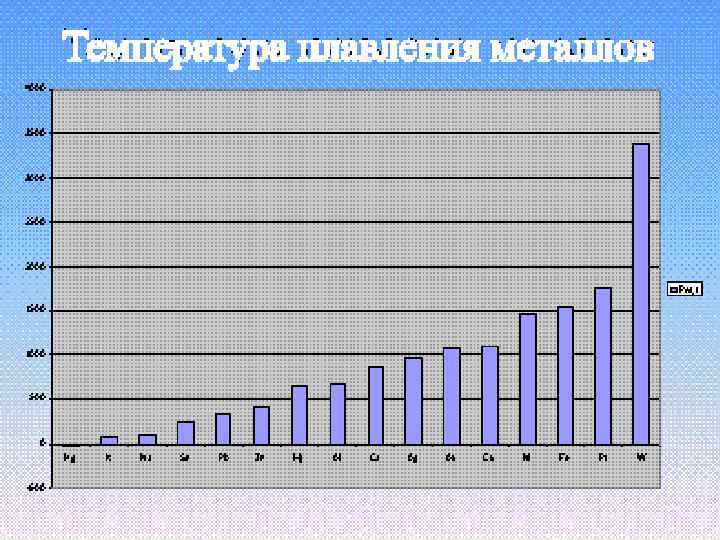
Температура плавления Легкоплавкие Hg, Ga, Cs, In, Bi тугоплавкие W, Mo, V, Cr
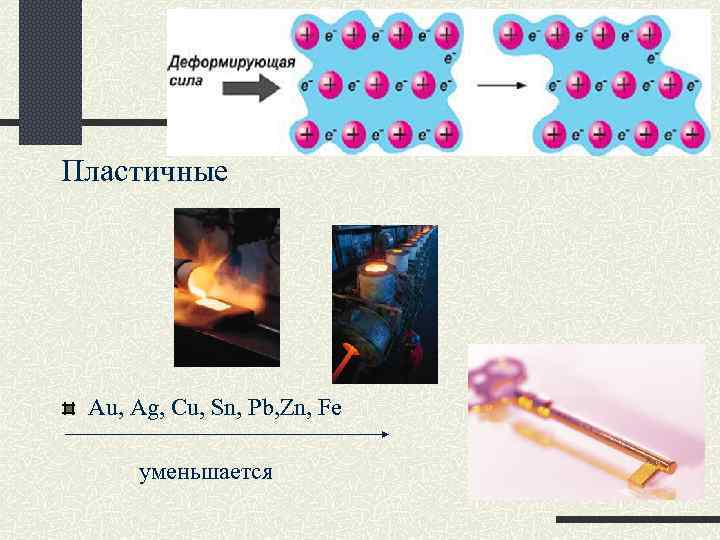
Пластичные Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается

Теплопроводность Hg, Cu, Ag, Al, Fe уменьшается Электропроводность Ag Mn уменьшается

Обладают металлическим блеском

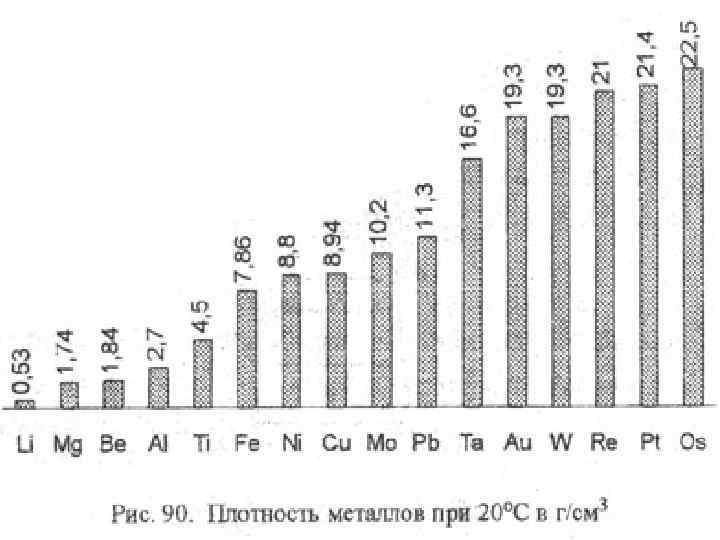
плотность легкие (Li–самый легкий, K, Na, Mg) тяжелые (осмий – самый тяжелый, Ir, Pb)

Ртуть Цезий Вольфрам 22

Тантал Церий Литий 23

Золото Платина 24 Серебро

Уран 25

Бериллий Натрий Индий 26 Хром

Образцы металлов индий кобальт хром висмут вольфрам сурьма галий германий берилий

Металлы. l Алюминий Al

ОЛОВО Оказывается, и металлы «болеют» . «Оловянной чумой» прозвали фазовый переход одной из аллотропных модификаций олова, белого олова (β-Sn), в другую — серое олово (α-Sn), при котором компактный металл рассыпается в серый порошок. Причина разрушения состоит в резком увеличении удельного объёма металла (плотность β-Sn больше, чем плотность α-Sn). Переход облегчается при контакте олова с частицами α-Sn (они действуют подобно затравке, вызывающей образование кристаллов в пересыщенном растворе) и распространяется подобно «болезни» . Наибольшую скорость распространения оловянная чума имеет при температуре – 33 °С; свинец и многие другие примеси её задерживают. В результате разрушения «чумой» паянных оловом сосудов с жидким топливом в 1912 г. погибла экспедиция Роберта Скотта к Южному полюсу. олово

ТАЛИЙ Талий — металл, белого цвета с голубоватым оттенком, похожим на свинец, но ещё более мягким. Таллий был впервые обнаружен с помощью спектроскопа, в большинстве минералов этот рассеянный элемент присутствует в столь малых количествах, что случайно напасть на его след химическим путём практически невозможно. Таллий и его соединения ядовиты. Недаром они попали в литературное произведение: в романе Агаты Кристи «Вилла ”Белый конь”» действует преступная группа, отравляющая людей соединениями таллия. Симптом отравления — выпадение волос. Другим последствием может оказаться тяжёлое нервное заболевание. талий

Металлы. l Вольфрам W

Активные металлы и металлы средней активности калий магний железо натрий цинк алюминий никель

Причины, приводящие к различию в физических свойств металлов Атомы металлов образуют разные типы кристаллических решеток

3. Ряд стандартных электродных потенциалов металлов. Распространение в природе. Положение того или иного металла в ряду напряжений характеризует его способность к окислительновосстановительным взаимодействиям в водных растворах при стандартных условиях. Чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет металл как простое вещество. Чем дальше расположен металл в ряду напряжений, тем более сильными окислителями в водном растворе являются его ионы.

платина

Химические свойства металлов Металлы в химических реакциях являются восстановителями, при этом они окисляются Mo – ne =Mn+ Al, Be, Mg, Ca, Li, Na, K, Rb, Cs Восстановительная способность возрастает

Металлы вытесняются из их соединений другими металлами Н. Н. Бекетов – создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов) Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.

Взаимодействуют с простыми веществами — С галогенами и кислородом 2 Na + Cl 2 = 2 Na Cl Mg + O 2 = 2 Mg O — C элементами пятой группы (труднее) 3 Ca + 2 P =Ca 3 P 2

Взаимодействие со сложными веществами — С кислотами Zn + H 2 SO 4 = Zn S O 4 + H 2 — C солями Zn + Pb(NO 3)2 = Zn(NO 3)2 + Pb — C водой (активные) 2 Na + 2 H 2 O =2 Na OH + H 2

Применение металлов Станко строение Металлур гическая промышленность медиц ина Сельское хозяйство Для получени я сплавов Домашнее хозяйство

Получение металлов Пирометаллургическим способомвосстановление углеродом, оксидом углерода (II), водородом при высокой температуре. Алюминотермическим способом Гидрометаллургическим способом – получение из руды более активным металлом или из растворов Электролизом – с помощью электрического тока из расплавов или растворов







Известно, что все простые вещества условно можно разделить на простые вещества-металлы и простые вещества-неметаллы.
МЕТАЛЛЫ, по определению М. В. Ломоносова — это «светлые тела, которые ковать можно». Обычно это ковкие блестящие материалы, обладающие высокой тепло- и электропроводностью. Эти физические и многие химические свойства металлов связаны со способностью их атомов ОТДАВАТЬ электроны.
НЕМЕТАЛЛЫ, напротив, способны ПРИСОЕДИНЯТЬ электроны в химических процессах. Большинство неметаллов проявляют противоположные металлам свойства: не блестят, не проводят электрический ток, не куются. Являясь противоположными по свойствам, металлы и неметаллы легко реагируют друг с другом.
Эта часть Самоучителя посвящена краткому освещению свойств металлов и неметаллов. Описывая свойства элементов, желательно придерживаться следующей логической схемы:
1. Вначале описать строение атома (указать распределение валентных электронов), сделать вывод о принадлежности данного элемента к металлам или неметаллам, определить его валентные состояния (степени окисления) — см. урок 3;
2. Затем описать свойства простого вещества, составив уравнения реакций
- с кислородом;
- с водородом;
- с металлами (для неметаллов) или с неметаллами (для металлов);
- с водой;
- с кислотами или со щелочами (там, где это возможно);
- с растворами солей;
3. Затем нужно описать свойства важнейших соединений (водородных соединений, оксидов, гидроксидов, солей). При этом вначале следует определить характер (кислотный или основной) данного соединения, а затем, вспомнив свойства соединений этого класса, составить необходимые уравнения реакций;
4. И наконец нужно описать качественные реакции на катионы (анионы), содержащие этот элемент, способы получения простого вещества и важнейших соединений этого химического элемента, указать практическое применение изучаемых веществ этого элемента.
Так, если вы определите, что оксид кислотный, то он будет реагировать с водой, основными оксидами, основаниями (см. урок 2.1) и ему будет соответствовать кислотный гидроксид (кислота). При описании свойств этой кислоты также полезно заглядывать в соответствующий раздел: урок 2.2.
Внутреннее строение и физические свойства металлов
Металлы — это простые вещества, атомы которых могут только отдавать электроны. Такая особенность металлов связана с тем, что на внешнем уровне этих атомов мало электронов (чаще всего от 1 до 3) или внешние электроны расположены далеко от ядра. Чем меньше электронов на внешнем уровне атома и чем дальше они расположены от ядра, — тем активнее металл (ярче выражены его металлические свойства).
Задание 8.1. Какой металл активнее:
Назовите химические элементы А, Б, В, Г.
Металлы и неметаллы в Периодической системе химических элементов Менделеева (ПСМ) разделяет линия, проведённая от бора к астату. Выше этой линии в главных подгруппах находятся неметаллы (см. урок 3). Остальные химические элементы — металлы.
Задание 8.2. Какие из следующих элементов относятся к металлам: кремний, свинец, сурьма, мышьяк, селен, хром, полоний?
Вопрос. Как можно объяснить тот факт, что кремний — неметалл, а свинец — металл, хотя число внешних электронов у них одинаково?
Существенной особенностью атомов металлов является их большой радиус и наличие слабо связанных с ядром валентных электронов. Для таких атомов величина энергии ионизации* невелика.
* ЭНЕРГИЯ ИОНИЗАЦИИ равна работе, затрачиваемой на удаление одного внешнего электрона из атома (на ионизацию атома), находящегося в основном энергетическом состоянии.
Часть валентных электронов металлов, отрываясь от атомов, становятся «свободными». «Свободные» электроны легко перемещаются между атомами и ионами металлов в кристалле, образуя «электронный газ» (рис. 28).
В последующий момент времени любой из «свободных» электронов может притянуться любым катионом, а любой атом металла может отдать электрон и превратиться в ион (эти процессы показаны на рис. 28 пунктирами).
Таким образом, внутреннее строение металла похоже на слоёный пирог, где положительно заряженные «слои» атомов и ионов металла чередуются с электронными «прослойками» и притягиваются к ним. Наилучшей моделью внутреннего строения металла является стопка стеклянных пластинок, смоченных водой: оторвать одну пластинку от другой очень трудно (металлы прочные), а сдвинуть одну пластинку относительно другой очень легко (металлы пластичные) (рис. 29).
Задание 8.3. Сделайте такую «модель» металла и убедитесь в этих свойствах.
Химическая связь, осуществляемая за счёт «свободных» электронов, называется металлической связью.
«Свободные» электроны обеспечивают также такие физические свойства металлов, как электро- и теплопроводность, пластичность (ковкость), а также металлический блеск.
Задание 8.4. Найдите дома металлические предметы.
Выполняя это задание, вы легко найдёте на кухне металлическую посуду: кастрюли, сковородки, вилки, ложки. Из металлов и их сплавов делают станки, самолёты, автомобили, тепловозы, инструменты. Без металлов невозможна современная цивилизация, так как электрические провода также делают из металлов — Cu и Al. Только металлы годятся для получения антенн для радио- и телеприёмников, из металлов делают и лучшие зеркала. При этом чаще используют не чистые металлы, а их смеси (твёрдые растворы) — СПЛАВЫ.
Сплавы
Металлы легко образуют сплавы — материалы, имеющие металлические свойства и состоящие из двух или большего числа химических элементов (простых веществ), из которых хотя бы один является металлом. Многие металлические сплавы имеют один металл в качестве основы с малыми добавками других компонентов. В принципе, чёткую границу между металлами и сплавами трудно провести, так как даже в самых чистых металлах имеются «следовые» примеси других химических элементов.
Все перечисленные выше предметы — станки, самолёты, автомобили, сковородки, вилки, ложки, ювелирные изделия — делают из сплавов. Металлы-примеси (легирующие компоненты) очень часто изменяют свойства основного металла в лучшую, с точки зрения человека, сторону. Например, и железо и алюминий — довольно мягкие металлы. Но, соединяясь друг с другом или с другими компонентами, они превращаются в сталь, дуралюмин и другие прочные конструкционные материалы. Рассмотрим свойства самых распространённых сплавов.
Сталь — это сплавы железа с углеродом, содержащие последнего до 2 %. В состав легированных сталей входят и другие химические элементы — хром, ванадий, никель. Сталей производится гораздо больше, чем каких-либо других металлов и сплавов, и все виды их возможных применений трудно перечислить. Малоуглеродистая сталь (менее 0,25 % углерода) в больших количествах потребляется в качестве конструкционного материала, а сталь с более высоким содержанием углерода (более 0,55 %) идет на изготовление режущих инструментов: бритвенные лезвия, сверла и др.
Железо составляет основу чугуна. Чугуном называется сплав железа с 2–4 % углерода. Важным компонентом чугуна является также кремний. Из чугуна можно отливать самые разнообразные и очень полезные изделия, например крышки для люков, трубопроводную арматуру, блоки цилиндров двигателей и др.
Бронза — сплав меди, обычно с оловом как основным легирующим компонентом, а также с алюминием, кремнием, бериллием, свинцом и другими элементами, за исключением цинка. Оловянные бронзы знали и широко использовали ещё в древности. Большинство античных изделий из бронзы содержат 75–90 % меди и 25–10 % олова, что делает их внешне похожими на золотые, однако они более тугоплавкие. Это очень прочный сплав. Из него делали оружие до тех пор, пока не научились получать железные сплавы. С применением бронзы связана целая эпоха в истории человечества: Бронзовый век.
Латунь — это сплавы меди с Zn, Al, Mg. Это цветные сплавы с невысокой температурой плавления, их легко обрабатывать: резать, сваривать и паять.
Мельхиор — является сплавом меди с никелем, иногда с добавками железа и марганца. По внешним характеристикам мельхиор похож на серебро, но обладает большей механической прочностью. Сплав широко применяют для изготовления посуды и недорогих ювелирных изделий. Большинство современных монет серебристого цвета изготавливают из мельхиора (обычно 75 % меди и 25 % никеля с незначительными добавками марганца).
Дюралюминий, или дюраль — это сплав на основе алюминия с добавлением легирующих элементов — медь, марганец, магний и железо. Он характеризуется своей стальной прочностью и устойчивостью к возможным перегрузкам. Это основной конструкционный материал в авиации и космонавтике.
Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
Вопросы
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:
Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:
Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:
Таким образом, полученное соединение имеет состав:
В результате получаем уравнение реакции:
Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
- кальций + хлор (Cl2);
- магний + азот (N2).
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:
Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:
Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:
Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
Все эти металлы в полученных соединениях двухвалентны.
Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:
Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:
Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:
где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl–. А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:
Металлы, менее активные, чем железо, с водой не реагируют!
Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:
Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:
А затем полученная щёлочь реагирует с солью:
Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:
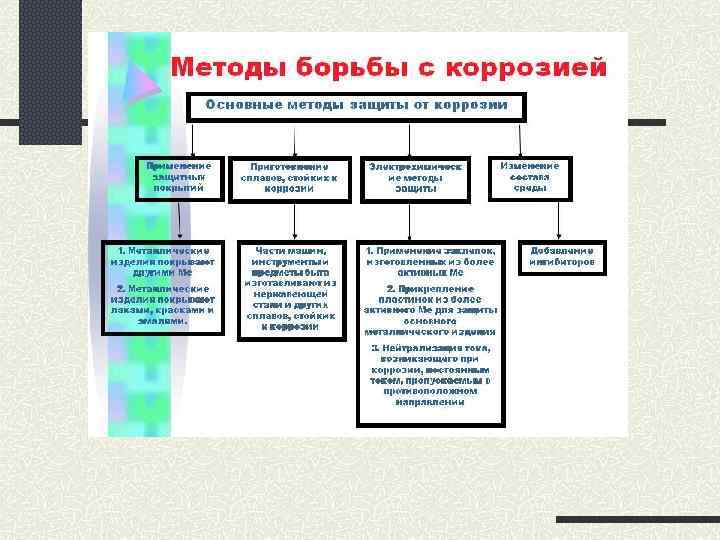
Коррозия металлов
Коррозия — самопроизвольный процесс окисления металла под действием факторов окружающей среды.
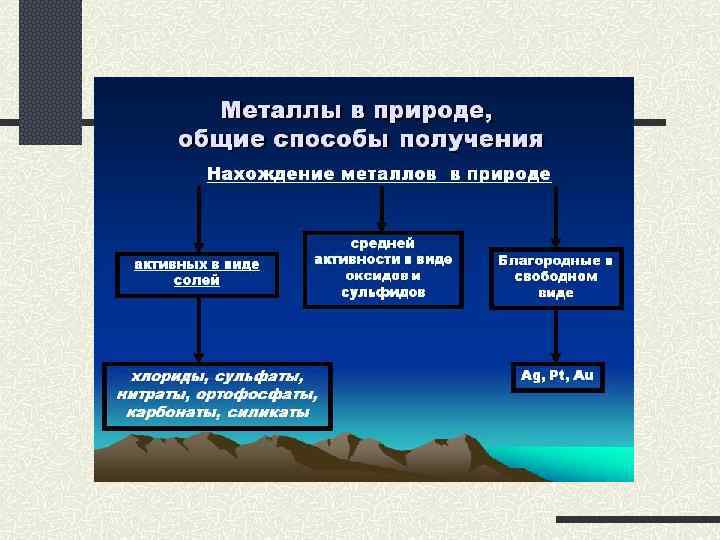
В природе практически не встречается металлов в свободном виде. Исключение составляют только «благородные», самые неактивные металлы, например золото, платина. Все остальные активно окисляются под действием кислорода, воды, кислот и др. Например, ржавчина образуется на любом незащищённом железном изделии именно в присутствии кислорода или воды. При этом окисляется железо:
а восстанавливаются компоненты атмосферной влаги:
В результате образуется гидроксид железа (II), который, окисляясь, превращается в ржавчину:
Подвергаться коррозии могут и другие металлы, правда, ржавчина на их поверхности не образуется. Так, нет на Земле металла алюминия — самого распространённого металла на планете. Но зато основу многих горных пород и почвы составляет глинозём Al2O3. Дело в том, что алюминий мгновенно окисляется на воздухе. Коррозия металлов наносит колоссальный ущерб, разрушая различные металлические конструкции.
Чтобы уменьшить потери от коррозии, следует устранить причины, которые её вызывают. В первую очередь, металлические предметы следует изолировать от влаги. Это можно сделать разными способами, например, хранить изделие в сухом месте, что далеко не всегда возможно. Кроме того, можно поверхность предмета покрасить, смазать водоотталкивающим составом, создать искусственную оксидную плёнку. В последнем случае в состав сплава вводят хром, который «любезно» распространяет собственную оксидную плёнку на поверхность всего металла. Сталь становится нержавеющей.
Изделия из нержавеющей стали дороги. Поэтому для защиты от коррозии используют тот факт, что менее активный металл не изменяется, т. е. не участвует в процессе. Поэтому если к сохраняемому изделию приварить более активный металл, то, пока он не разрушится, изделие корродировать не будет. Этот способ защиты называется протекторной защитой.
Выводы
Металлы — это простые вещества, которые всегда являются восстановителями. Восстановительная активность металла убывает в ряду напряжений от лития к золоту. По положению металла в ряду напряжений можно определить, как металл реагирует с растворами кислот, с водой, с растворами солей.
