Какими лечебными свойствами обладает перекись водорода
Польза и вред перекиси водорода — вопрос, вызывающий горячие споры. Чтобы понять, можно ли применять средство внутрь, или его лучше использовать только наружно, следует изучить все свойства и особенности.
Что такое перекись водорода
В виде формулы перекись водорода обозначается следующим образом — H2O2. Вещество представляет собой бесцветную прозрачную жидкость без запаха и вкуса и, по сути, является водой с высоким содержанием кислорода.
В аптеках можно встретить 2 основные разновидности полезного вещества.
- Обычная жидкая перекись, или пергидроль — раствор с 2,7-3,3% концентрацией, который отпускается без рецепта и подходит почти для любых целей.
- Перекись в форме таблеток, или гидроперит —вещество с 35% содержанием действующего вещества, которое необходимо растворять в воде.
Таблетка гидроперита по содержанию вещества равна столовой ложке жидкого пергидроля. В лечебных целях чаще применяют жидкое вещество, а вот для бытового использования оказываются более удобными таблетки.
Чем полезна перекись водорода
Польза и вред перекиси водорода для организма настолько известны, что встретить средство можно в любой домашней аптечке. Перекись:
- обладает антибактериальными и антисептическими свойствами;
- способствует быстрому заживлению ранок и язв;
- останавливает несильные кровотечения и облегчает боль;
- приносит пользу в лечении ангины, стоматита, отита и зубной боли;
- очищает организм от токсинов и шлаков, в этом заключается польза перекиси водорода для почек;
- устраняет неприятные запахи и ликвидирует грибок;
- оказывает омолаживающий эффект на кожу и может служить даже профилактикой рака.
Приятной особенностью полезного вещества можно назвать то, что при обработке кожных повреждений оно не причиняет такого дискомфорта, как йод — а дезинфицирует ткани так же качественно.
Влияние на ЖКТ
Можно осуществлять прием перекиси водорода внутрь для похудения и оздоровления желудка и кишечника. Как считают сторонники такого метода лечения, водород и кислород при распаде вещества в желудке впитываются непосредственно в слизистые и быстро проникают в клетки. Полезный эффект выражается в том, что нормализуется кислотно-щелочной баланс в организме, ликвидируются гнилостные процессы в кишечнике, быстро заживают внутренние эрозии и язвы.
В небольших дозировках раствор приносит пользу при хроническом гастрите и язве, поскольку снимает изжогу и регулирует кислотность.
Насыщение кровотока
Пить воду с перекисью водорода полезно для насыщения организма кислородом. Попадая в кровь, пергидроль быстро разносится по всему телу и питает клетки. Исследования подтверждают, что насыщение крови кислородом не только устраняет признаки кислородного голодания, но и поднимает иммунитет, объем лимфоцитов в крови возрастает более чем на 30%.
Чистка организма
Приносит пользу перекись водорода для очищения организма, при внутреннем приеме раствор помогает быстрее вывести токсины, мочевину и аммиачные соединения. Средство приносит хороший эффект при переизбытке шлаков, полезные свойства ярко проявляются после алкогольного отравления. Полезный раствор помогает быстро справиться с последствиями возлияний, освобождает организм от вредных веществ и устраняет усиленное сердцебиение, тремор и тошноту.
Что лечит перекись водорода
Целительные свойства перекиси водорода используют для терапии следующих недугов:
- инфекционных и простудных заболеваний — гриппа и ангины, простуды и бронхита, трахеита и пневмонии;
- заболеваний носа и ушей — насморка, отита, гайморита;
- стоматологических заболеваний — кариеса и пародонтоза;
- неврологических недугов — рассеянного склероза у пожилых людей, остеохондроза;
- сердечных недугов — раствор может помочь в лечении последствий инфарктов и инсультов, оказывает полезное действие при атеросклерозе и варикозе;
- кожных заболеваний — от дерматита до экземы.
Важно! Полезный раствор приносит пользу в терапии сахарного диабета, помогает при хронических заболеваниях легких и бронхов.
Читать далее: https://poleznii-site.ru/zdorove/perekis-vodoroda-poleznye-i-lechebnye-svoystva-primenenie-otzyvy.html
Если эта статья оказалась вам полезной, ставьте лайк и подписывайтесь на наш канал. Не забывайте делиться информацией с друзьями в социальных сетях.
Перокси́д водоро́да (пе́рекись водорóда), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
Молекула пероксида водорода имеет следующее строение:
Структура молекулы пероксида водорода
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10−29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Химические свойства[править | править код]
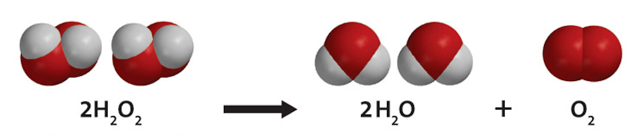
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже неустойчив и самопроизвольно диспропорционирует на H2O и O2. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
В присутствии катализаторов разложения в среде кислорода может появляться озон:
Однако очень чистый пероксид водорода вполне устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10−12), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
Окислительно-восстановительные свойства[править | править код]
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганец при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
например:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства[править | править код]
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Получение[править | править код]
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х[2]. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия[3].
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта
[4]:
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H[5].
Применение[править | править код]
3 % раствор перекиси водорода
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.[6] Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяются для небольших поверхностных ран, исследования показали, что этот метод, обеспечивая антисептический эффект и очищение, также продлевает время заживления[7][8]. Обладая хорошими очищающими свойствами, пероксид водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также продлевать время заживления из-за повреждения прилегающих к ране клеток[9]. Более того, пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи[10].
Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного.
Перекись водорода применяют для растворения пробок в слуховых каналах. Раствор вступает в реакцию с ушной серой и растворяет пробку.
Пероксид водорода применяется также для обесцвечивания волос[11].
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»).
Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств).
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме[12].
С 90-х годов ХХ века 3%-ный раствор пероксида водорода продвигался целителем И. П. Неумывакиным для приёма внутрь как универсальное средство лечения и оздоровления человека. Научного подтверждения допустимости и эффективности данный метод не имеет.
Перекись водорода используется в известном опыте, демонстрирующем многократное увеличение объёма вещества в результате химической реакции[13].
Формы выпуска[править | править код]
Выпускается в виде водных растворов, стандартная концентрация 1—6 %, 30, 38, 50, 60, 85, 90 и 98 %[источник не указан 292 дня]. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
Опасность применения[править | править код]
Кожа после попадания на неё концентрированного раствора перекиси водорода.
Несмотря на то, что пероксид водорода нетоксичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл[14].
Примечания[править | править код]
- ↑ 1 2 https://www.cdc.gov/niosh/npg/npgd0335.html
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑
Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro; Blanco-Brieva; Fierro. Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process (англ.) // Angewandte Chemie International Edition : journal. — 2006. — Vol. 45, no. 42. — P. 6962—6984. — doi:10.1002/anie.200503779. — PMID 17039551. - ↑
Burgess, A. R.; Cullis, C. F.; Newitt, E. J. 365. The gaseous oxidation of isopropyl alcohol. Part 1. The influence of temperature, pressure, and mixture composition on the formation of hydrogen peroxide and other products (англ.) // Journal of the Chemical Society (англ.)русск. : journal. — Chemical Society, 1961. — 1 January (no. 0). — P. 1884—1893. — ISSN 0368-1769. — doi:10.1039/JR9610001884. - ↑ Ахметов Н. С. Общая и неорганическая химия. — 2-е изд. — М.:Высшая школа, 1988. — с. 304.
- ↑ Космонавтика, энциклопедия. М., 1985.
- ↑ O’Connor, Anahd. Really? The Claim: Hydrogen Peroxide Is a Good Treatment for Small Wounds, New York Times (19 июня 2007). Дата обращения 13 июля 2011.
- ↑ Carroll, Aaron E., Rachel C. Vreeman. Medical myths don’t die easily, CNN (12 июля 2011). Дата обращения 13 июля 2011.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245, page 161.
- ↑ Wilgus T. A., Bergdall V. K., Dipietro L. A., Oberyszyn T. M. Hydrogen peroxide disrupts scarless fetal wound repair (неопр.) // Wound Repair Regen. — 2005. — Т. 13, № 5. — С. 513—519. — doi:10.1111/j.1067-1927.2005.00072.x. — PMID 16176460.
- ↑ Средства для осветления волос
- ↑ М. Бейли, П. Бергресс. Золотая книга аквариумиста. Полный справочник по уходу за пресноводными тропическими рыбами. — М.: Аквариум ЛТД, 2004.
- ↑ Elephant’s Toothpaste. University of Utah Chemistry Demonstrations. University of Utah. Дата обращения 21 марта 2014.
- ↑ Противопоказания к применению перекиси водорода в лечебных целях Архивная копия от 25 августа 2011 на Wayback Machine[неавторитетный источник?]
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Ссылки[править | править код]
- NIST Chemistry WebBook
 Перекись водорода – это как вода, только пишется по-другому. Это из-за того, что она имеет дополнительный атом кислорода. Этим химическим веществом заинтересовались ещё в начале 20 века. И к началу 2020 года перекись обросла множеством мифов и погубила тысячи жизней по всему миру. Хотя задумка изначально была хорошая. Создали химическое вещество, которое по-настоящему универсально: дезинфекция помещений, обеззараживание ран, отбеливание, топливо для ракет, пенообразователь т .д.
Перекись водорода – это как вода, только пишется по-другому. Это из-за того, что она имеет дополнительный атом кислорода. Этим химическим веществом заинтересовались ещё в начале 20 века. И к началу 2020 года перекись обросла множеством мифов и погубила тысячи жизней по всему миру. Хотя задумка изначально была хорошая. Создали химическое вещество, которое по-настоящему универсально: дезинфекция помещений, обеззараживание ран, отбеливание, топливо для ракет, пенообразователь т .д.
Официальная медицина в России относится к H2O2 более лояльно, чем в других странах. Например, в США запрещено как распространение информации о лечении этим веществом, так и продажа самого концентрированного раствора. Связано это с тем, что перекись слишком агрессивна по принципу своего действия — кроме дезинфекции она травмирует окружающие здоровые ткани. Тем не менее в слабой концентрации пероксид водорода используется для обработки порезов и ссадин, а также для полоскания рта в случае заболеваний дёсен и горла.
Нетрадиционная медицина не остановилась на таких скучных и прозаичных вещах. Энтузиасты стали придумывать теории, в которых химическое соединение стало панацеей от всех болезней. В основу всех теорий легли знания химии за 8-ой класс и хорошая фантазия. Профессор Неумывакин является одним из разработчиков и представителей этого опасного метода лечения. И ему мы посвятим отдельную статью.
- Вы видите реакцию, которая происходит при попадании пероксида водорода в кровь. В ходе неё из H2O2 высвобождается кислород. А кислород — это что? Правильно — основа жизни. Следовательно чем больше мы закачаем в организм кислорода, тем лучше.

- Перекись водорода является очень неустойчивым соединением, которое легко разлагается. Выделяющийся при разложении кислород окисляет сульфгидрильные и гидроксильные группы белков и липидов. Если по-простому — это означает, что все микробы под воздействием перекиси умирают.
 Но все эти суждения в корне не верны. Ведь элементарные знания о химии невозможно так грубо переложить на человека. Такой подход можно было бы назвать — химия человека в пробирке. Мы же не находимся в стеклянном сосуде и не представляем собой мешок с костями. Каждую секунду внутри нас происходят тысячи отлаженных биохимических реакций. И этот тонкий баланс легко можно нарушить, грубо вмешиваясь в естественный процесс при помощи агрессивных химических соединений.
Но все эти суждения в корне не верны. Ведь элементарные знания о химии невозможно так грубо переложить на человека. Такой подход можно было бы назвать — химия человека в пробирке. Мы же не находимся в стеклянном сосуде и не представляем собой мешок с костями. Каждую секунду внутри нас происходят тысячи отлаженных биохимических реакций. И этот тонкий баланс легко можно нарушить, грубо вмешиваясь в естественный процесс при помощи агрессивных химических соединений.
Некоторые из теорий лечения перекисью водорода
- Перекись запускает процесс “подзакисления организма” с целью выведения шлаков. Но что такое “подзакислить” и “шлаки”, внятного объяснения адепты нетрадиционной медицины не дают.
- Кислород, который выделяется после приёма перекиси внутрь, мгновенно поглощается клетками. Происходит так называемая кислородная терапия. Но на деле кислород разрушает клеточную мембрану и вызывает обширные повреждения тканей, т.к. является мощным радикалом.
- Перекись уничтожает вредные бактерии в желудочно-кишечном тракте. Но даже если она что-то и уничтожает, это химическое соединение не может отличить патогенные (вредные) бактерии от тех, которые являются частью нормальной микрофлоры организма. Поэтому регулярное употребление H2O2 может вызвать дисбактериоз.
- Лечение рака с помощью высвобождающегося кислорода. Есть мнение, что O2, который выделяется из пероксида водорода, способен целенаправленно уничтожать раковые клетки. На деле же кислород является обычной молекулой, которая не способна распознать больные клетки и уничтожить их. Приём перекиси водорода скорее повысит риск онкологических заболеваний. В лабораторных условиях было доказано, что инъекции крови, которые были предварительно обработаны H2O2, повышают риск развития рака молочной железы у здоровых животных.
Мы видим, что примитивные знания о химии и хорошая фантазия не являются достаточными основаниями для того, чтобы создать теорию для лечения сложных болезней.
Пример лечения
В США одна семейная пара использовала этот метод лечения. У Сьюзен Хан уже был рак, который диагностировали в 2010 году. Ей сделали операцию и провели курс лучевой терапии, после чего болезнь отступила. Но в октябре 2015 года у Сьюзен начались частые боли в животе. После нескольких срочных вызовов скорой помощи и госпитализации, был поставлен диагноз. Это опять был рак матки.
Её муж Акрила Хан бросил все свои силы на борьбу с болезнью своей жены. Он рассматривал любые методы и наткнулся в интернете на нетрадиционный метод лечения. Он заключался в регулярном приёме внутрь H2O2 с постепенным повышением концентрации. Хан понимал, что положительные изменения не начнутся быстро, но сильно наделялся, что в долгосрочной перспективе средство поможет. Ожидания мужа не оправдались — Сьюзен умерла мене чем через год при таком лечении.
Врач, который знает про этот случай, считает, что перекись водорода способствовала усугублению болезни. Он говорит, что агрессивное химическое воздействие и отсутствие чётких инструкций привело к тому, что концентрация перекиси была опасна для жизни.
2 типа людей
 Издревле есть 2 типа людей. Первая – это торговцы, которые хотят заработать любым способом. Вторая – это люди, которые хотят решать свои проблемы со здоровьем. В случае с пероксидом водорода первые наживаются на продаже. Во второй группе теряют здоровье, становятся инвалидами и умирают. Поэтому H2O2 были приписаны многие несуществующие качества. Как говорится: “Ничего личного — это просто бизнес”.
Издревле есть 2 типа людей. Первая – это торговцы, которые хотят заработать любым способом. Вторая – это люди, которые хотят решать свои проблемы со здоровьем. В случае с пероксидом водорода первые наживаются на продаже. Во второй группе теряют здоровье, становятся инвалидами и умирают. Поэтому H2O2 были приписаны многие несуществующие качества. Как говорится: “Ничего личного — это просто бизнес”.
Но бывает такое, что люди принимают перекись водорода случайно. Например:
- 74-летний мужчина в штате Теннеси считал, что пил обычную воду, но это была перекись водорода в холодильнике его дочери. Он был госпитализирован с тяжёлыми язвами пищевода и желудка. Ему пришлось делать обширную операцию;
- четырёхлетний ребёнок случайно выпил концентрированную перекись водорода, которую его отец использовал якобы для лечения болезни желудочно-кишечного тракта. Через несколько минут мальчик закричал и потерял сознание. В результате нанесённых повреждений он начал страдать от судорог и потерял возможность передвигаться самостоятельно.
Подробнее о механизме воздействия
 Если принять внутрь 3% раствор перекиси, то возникнет чувство тошноты и возможно, рвота. Концентрация 10% грозит повреждениями внутренних органов и даже смерти. При попадании в желудок перекись начинает взаимодействовать с ферментом католазой, из-за чего происходит интенсивное выделение кислорода. Разрушаются стенки кровеносных сосудов, и снижается давление. В результате этого может произойти инсульт, инфаркт или тромбоэмболия лёгочной артерии.
Если принять внутрь 3% раствор перекиси, то возникнет чувство тошноты и возможно, рвота. Концентрация 10% грозит повреждениями внутренних органов и даже смерти. При попадании в желудок перекись начинает взаимодействовать с ферментом католазой, из-за чего происходит интенсивное выделение кислорода. Разрушаются стенки кровеносных сосудов, и снижается давление. В результате этого может произойти инсульт, инфаркт или тромбоэмболия лёгочной артерии.
Перекись водорода может нанести сильные или средние повреждения тканей и клеток. Любому понятно, что разрушение тканей пищевода вследствие химического ожога перекисью — это плохо. Но не стоит недооценивать и средние повреждения тканей у людей, которые принимают это средство в малой концентрации.
Дело в том, что наш организм всегда старается приспособиться. И в случае с постоянным разрушающим фактором в виде перекиси, усиливаются регенерационные процессы в желудочно-кишечном тракте. То есть клетки начинают быстрее делиться. И вроде бы это хорошая новость. Но на деле такая ситуация может привести к тому, что процесс деления клеток выйдет из под контроля. Это может привести к раку пищевода и желудка.
Плацебо
Тем не менее всегда найдутся люди, уверенные в том, что лечение перекисью водорода им помогло. Якобы были вылечены боли в ноге, руке, импотенция, остеохондроз и т.д. Но в большинстве случаев это объясняется эффектом плацебо. Степень проявления это феномена зависит от внешних обстоятельств и внушаемости человека.
И мы могли бы сказать, что главное — результат. Если перекись помогла по принципу плацебо, то в этом нет ничего плохого, ведь по факту человек излечился. Мы согласились бы с этим утверждением, но этот метод лечения является абсолютно непредсказуемым и ненадёжным. А в случае с лечением перекисью водорода — опасным, даже если концентрация вещества в растворе мала.
Мы призываем вас в случае болезни консультироваться с врачом. А также использовать только проверенные и научно обоснованные методы лечения. Разгрузочно-диетическая терапия (лечебное голодание) — это официальный метод, который утверждён Министерством здравоохранения РФ. О нём не всегда достаточно осведомлены даже опытные врачи. Но это тот тип терапии, который позволяет лечить и достигать ремиссии даже в случае сложных заболеваний.
