Какими химическими свойствами обладает кислород

Анонимный вопрос · 23 декабря 2018
5,7 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Кислород (или Oxygenium)????
Химические свойства:
✅Сильный окислитель
✅Реагирует практически со всеми элементами
✅Образует оксиды
✅Окисляет простые и сложные неорганические вещества
✅Окисляет органические вещества
✅Характерна реакция горения
Физические свойства:
????Газ без цвета и запаха
????Мало растворим в воде
????Немного тяжелее воздуха
????Плотность 1,4г/л
????Температура кипения -183°C
????Температура плавления -216°C
????Атомы кислорода образуют такие вещества,как O ₂(кислород) и О ₃ (озон)
Пасиб огромное помогла на 5
Если животные вдыхают кислород (O2), а выдыхают углекислый газ (СО2), откуда берется С? Там что, склад углерода?
программист, предприниматель
Ну все живые организмы, начиная от бактерий — огромный склад углерода. Он — основа всех органических молекул и третий по распространенности элемент в организме животных и растений (после водорода и кислорода). Так что да, запас углерода в легких имеется.
Но углекислый газ производится не в легких. Его производят клетки при расщеплении кислородом органических соединений. Часть углекислого газа и углекислоты идут на поддержание многих процессов в организме, остальное — выходит с дыханием.
Как вырабатывается кислород на космической станции?
программист, предприниматель
Кислород получают из углекислого газа СО2 или путём реакции Сабатье (углекислый газ реагирует с водородом получая метан и воду) и электролиза полученной воды или напрямую через реакцию с твёрдым электролитом.
Замечу, что если применяется реакция Сабатье, то полученная в результате вода не идёт в общий водный цикл станции.
Прочитать ещё 1 ответ
Какое химическое уравнение самое важное?
Главный редактор издания «Популярный университет», химик по образованию, продвигаю массы… · popuni.ru
Хороший вопрос. Здесь стоит уточнить, для чего же оно самое важное. Для существования растительной жизни наиболее важен процесс фотосинтеза, который упрощенно можно описать в виде уравнения 6CO2+6H2O=C6H12O6 +6O2. Если же говорить о химической промышленности, то тут, пожалуй, одним из самых важных считается уравнение получения аммиака N2+3H2=2NH3, так как именно этот процесс позволил ученым получить ряд очень важных соединений, среди которых различные красители и биоорганические вещества. Но если посмотреть немного наверх и обратиться к истокам нашей жизни, получится, что главный ингредиет, благодаря которому мы такие, какие есть — это Солнце. И без термоядерных реакций, происходящих в его недрах, наше существование было бы невозможно. Один из самых основных процессов — это протон-протонная реакция, в ходе которой образуется дейтерий — изотоп водорода: 1H + 1H = D + e- (два атома водорода соединяются с образованием атома дейтерия и одного электрона). Есть еще множество видов термоядерных реакций, которые можно объединить в несколько циклов. Но это уже совсем другая история.
Прочитать ещё 1 ответ
Ест ли в воде кислород?
Да,конечно кислород в воде есть.
Есть ещё воды с повышенным содержанием кислорода.
Советую попробовать. Я обычно покупаю Стэлмас кислород, т.к. она есть во всех аптеках.
Конечно всё индивидуально, но я её беру всегда во время походов в спорт зал. По сути Стэлмас Кислород это питьевая столовая артезианская вода, с той лишь особенностью,что на выходе её дополнительно насыщают кислородом. Соответственно, если пить такую воду улучшается работа всего организма.
Прочитать ещё 3 ответа
Какие вещества называют оксидами?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Оксиды это соединения различных химических элементов с кислородом. При этом кислород находистя в опредленной степени окисления. В реакцию с кислородом могут вступать и металлы, и неметаллы. Чаще всего в результате реакций с неметаллами образуются кислотные оксиды, а с металлами — основания.
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]() С в электрической дуге, в природе – при грозовом разряде). Например:
С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t![]() );
);
4NH3 + 3O2 = 2N2↑ + 6H2O (t![]() );
);
4NH3 + 5O2 = 4NO↑ + 6H2O (t![]() , kat);
, kat);
2PH3 + 4O2 = 2H3PO4 (t![]() );
);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t![]() ).
).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t![]() );
);
2SO2 + O2 = 2SO3 (t![]() , V2O5);
, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t![]() ).
).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:

Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]() С растворяется 3
С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
Примеры решения задач
Кислород – самый распространенный химический элемент на планете. Его массовая доля в земной коре составляет 47,3%, объемная доля в атмосфере – 20,95%, а массовая доля в живых организмах – около 65%. Что представляет из себя этот газ, и какими физическими и химическими свойствами кислород обладает?

Кислород: общая информация
Кислород – неметалл, в нормальных условиях не имеющий цвета, вкуса и запаха.

Рис. 1. Формула кислорода.
Практически во всех соединениях, кроме соединений с фтором и пероксидов, он проявляет постоянную валентность II и степень окисления -2. Атом кислорода не имеет возбужденных состояний, так как на втором внешнем уровне нет свободных орбиталей. Как простое вещество кислород существует в виде двух аллотропных видоизменений – газов кислорода O2 и озона O3.
при определенных условиях кислород может находится в жидком или твердом состоянии. они в отличие от газа имеют цвет: жидкий – светло-голубого цвета, а твердый кислород имеет светло-синий оттенок.

Рис. 2. Твердый кислород.
Кислород в промышленности получают с помощью сжижения воздуха с последующим отделением азота за счет его испарения (имеется разница в температурах кипения: -183 градуса для жидкого кислорода и -196 градусов для жидкого азота).
Химические свойства взаимодействия кислорода
Кислород является активным неметаллом. Кислород способен вступать в реакцию со всеми элементами кроме неона, гелия и аргона. обычно реакции этого газа с другими веществами экзотермичны. Процесс окисления, идущий при одновременном выделении энергии в виде тепла и света, называется горением. Очень важно использование органических соединений, в частности, алканов, в качестве топлива, так как при свободно-радикальной реакции горения выделяется большое количество тепла:
CH4 +2O2 = CO2 +2H2O +880 кДж.
С неметаллами кислород обычно вступает в реакцию при нагревании, образуя при этом оксид. Так, реакция с азотом начинается лишь при температуре выше 1200 градусов или в электрическом разряде:
N2 + O2 =2NO.
Кислород также реагирует с металлами:
3Fe + 2O2= Fe3O4 (в результате реакции образуется соединение – оксид железа)
в природе существует еще более сильный окислитель, чем кислород, это – озон. Он способен окислять золото и платину. В естественных условиях озон образуется из кислорода воздуха во время грозовых разрядов, а в лаборатории – пропусканием электрического разряда через кислород: 3О2 = 2О3 – 285 кДж (эндотермическая реакция)

Рис. 3. Озон.
Самое значительное соединение кислорода – вода. Около 71% земной поверхности занимает водная оболочка. Угловые молекулы воды полярны, каждая из них образует четыре водородные связи: две – как донор протонов и две – как акцептор протонов. Образуются ассоциаты (H2O)x, где x меняется от 2 до 5. В водяном паре присутствуют димеры (H2O)2, а в конденсированных фазах молекула воды может находиться в тетраэдрическом окружении четырех других молекул. если бы молекулы воды не были ассоциированы, то ее температура кипения составляла бы не 100 градусов, а около 80 градусов.
Что мы узнали?
Кислород – сильный окислитель и активный неметалл, поэтому его изучение начинается уже в 8 классе. Он является бесцветным газом без запаха, но также при определенных условиях может находится в жидком и твердом состояниях. Он взаимодействует с металлами и неметаллами, образуя оксиды, а также реагирует с большинством простых веществ.
Тест по теме
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 340.
Лекция «Кислород –
химический элемент и простое вещество»
План
лекции:
1. Кислород – химический элемент:
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ
б)
Валентные возможности атома кислорода
в)
Распространённость химического элемента в природе
2. Кислород – простое вещество
а)
Получение кислорода
б)
Химические свойства кислорода
в)
Круговорот кислорода в природе
г)
Применение кислорода
«Dum spiro spero» (Пока дышу, надеюсь…), — гласит
латынь
Дыхание – это синоним
жизни, а источник жизни на Земле – кислород.

Подчёркивая важность кислорода для земных
процессов, Яков Берцелиус сказал: « Кислород – это вещество, вокруг которого
вращается земная химия»
Материал данной лекции обобщает
ранее полученные знания по теме «Кислород».
1.
Кислород – химический элемент
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ

Кислород — элемент главной подгруппы шестой группы,
второго периода периодической системы химических элементов
Д. И. Менделеева, с атомным порядковым номером 8. Обозначается
символом O (лат. Oxygenium). Относительная
атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
б)
Валентные возможности атома кислорода
В соединениях кислород
обычно двухвалентен (в оксидах), валентность VI
не существует. В свободном виде
встречается в виде двух простых веществ: О2 («обычный» кислород) и О3
(озон). О2 — газ без цвета и запаха, с относительной молекулярной
массой =32. О3 – газ без цвета с резким запахом, с относительной
молекулярной массой =48.
Внимание! H2O2 (перекись водорода) – O (валентность II)
СО
(угарный газ) – О (валентность III)
в)
Распространённость химического элемента кислорода в природе

Кислород — самый
распространенный на Земле элемент, на его долю (в составе различных соединений,
главным образом силикатов), приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное количество связанного кислорода —
85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по
объёму и 23% по массе. Более 1500 соединений земной коры в своем составе
содержат кислород.
Кислород входит в
состав многих органических веществ и присутствует во всех живых клетках. По
числу атомов в живых клетках он составляет около 20 %, по массовой
доле — около 65 %.
2.Кислород
– простое вещество
а) Получение кислорода
Получение в лаборатории
1) Разложение перманганата калия (марганцовка):
2KMnO4 t˚C=K2MnO4+MnO2+O2↑
2) Разложение перекиси водорода:
2H2O2 MnO2=2H2O + O2↑
3) Разложение бертолетовой соли:
2KClO3 t˚C , MnO2=2KCl + 3O2↑
Получение в промышленности
1) Электролиз воды
2H2O эл. ток=2H2 + O2↑
2) Из воздуха
ВОЗДУХ давление, -183˚C=O2 (голубая жидкость)
В
настоящее время в промышленности кислород получают из воздуха. В лабораториях
небольшие количества кислорода можно получать нагреванием перманганата калия
(марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее
воздуха, поэтому его можно получать двумя способами:
·
вытеснением воды;
·
вытеснением воздуха (кислород будет собираться на
дне сосуда).
Существуют и другие способы получения
кислорода.
Посмотрите видео-сюжет
получение кислорода при разложении марганцовки (перманганата калия). Полученный
кислород можно обнаружить на дне сосуда тлеющей лучинкой – она вспыхнет.
б)
Химические свойства кислорода
Взаимодействие веществ с кислородом называется окислением.
В результате образуются оксиды –
сложные вещества, состоящие из двух элементов, одним из которых является
двухвалентный атом кислорода.
Реакции окисления, протекающие с выделением тепла и
света, называют реакциями горения. Кислород взаимодействует с простыми
веществами – металлами и неметаллами; а так же со сложными веществами.
Изучите алгоритм составления уравнений реакций
окисления на примере алюминия и метана CH4.

в)
Круговорот кислорода в природе
В природе кислород
образуется в процессе фотосинтеза, который происходит в зелёных растениях на
свету. В целях сохранения кислорода в воздухе вокруг городов и крупных
промышленных центров создаются зоны зелёных насаждений.

г)
Применение кислорода
Применение кислорода
основано на его свойствах: кислород поддерживает горение и дыхание.
В заключении ещё раз отметим важность
кислорода для всего живого на нашей планете такими поэтическими строками:
«
Он всюду и везде:
В
камне, в воздухе, в воде,
Он
и в утренней росе
И небес голубизне…»
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος —
рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
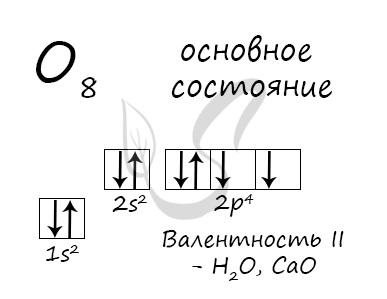
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. — MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

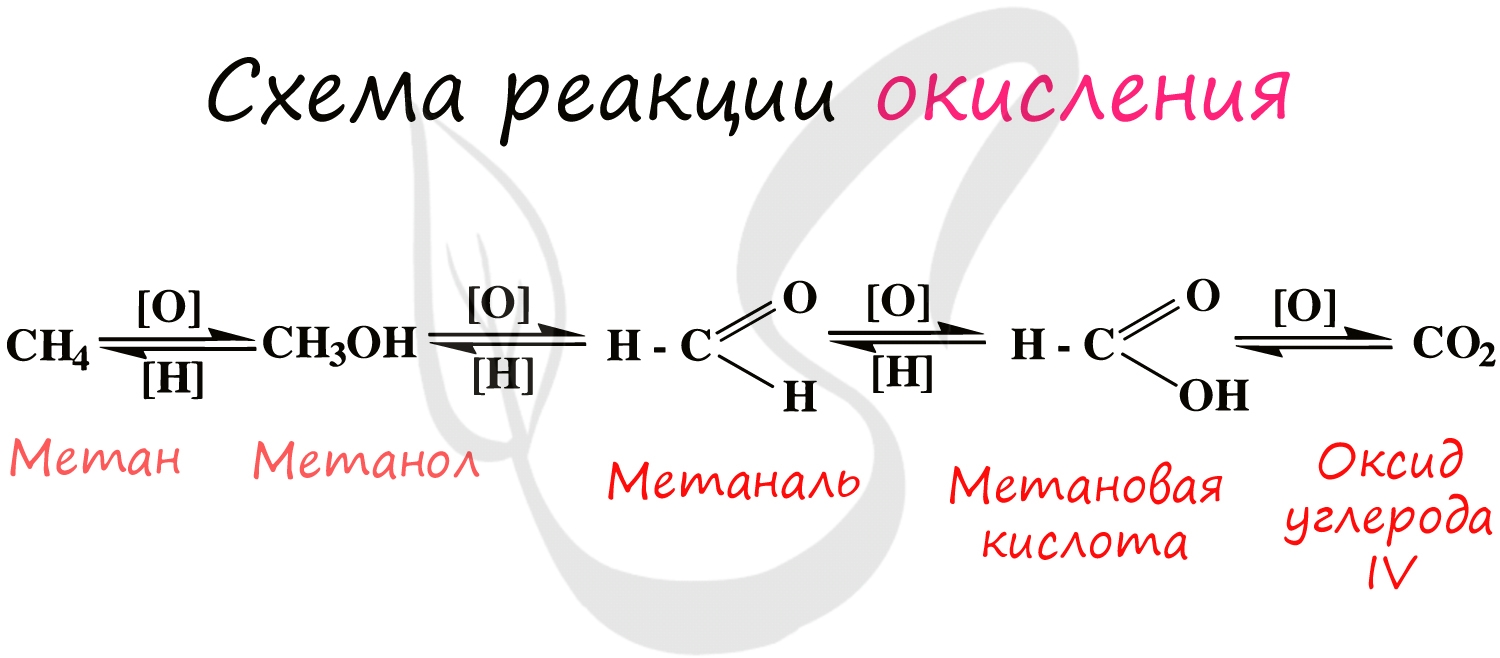
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
