Какими физическими свойствами обладают твердые вещества
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Твердое тело является одним из трех основных состояний материи, наряду с жидкостью и газом. Материя — это вещество вселенной, атомы, молекулы и ионы, которые составляют все физические вещества. В твердом теле, эти частицы плотно упакованы вместе и не могут свободно перемещаться внутри вещества. Молекулярное движение для частиц в твердом теле ограничено очень малыми колебаниями атомов вокруг их фиксированных положений; поэтому твердые тела имеют фиксированную форму, которую трудно изменить. Твердые тела также имеют определенный объем, то есть они сохраняют свой размер независимо от того, как вы пытаетесь их изменить.
Твердые вещества делятся на две основные категории: кристаллические твердые вещества и аморфные твердые вещества, основанные на том, как расположены частицы.
Кристаллические твердые вещества
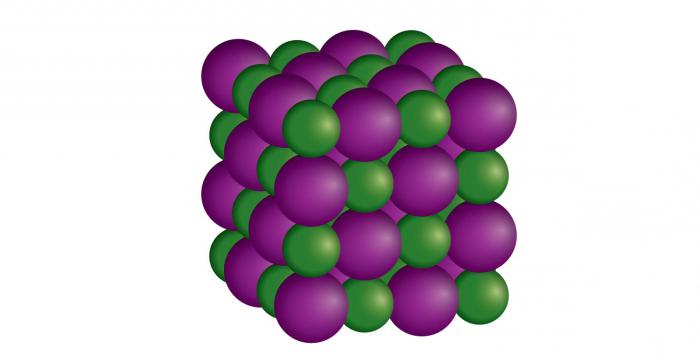
Кристаллические твердые вещества или кристаллы рассматриваются как настоящие твердые тела. Минералы представляют собой кристаллические твердые вещества. Обычная поваренная соль является одним из примеров такого твердого вещества. В кристаллических твердых телах атомы, ионы или молекулы расположены упорядоченно и симметрично во всем кристалле. Самая маленькая повторяющаяся структура твердого тела называется элементарной ячейкой, которая похожа на кирпич в стене. Элементарные ячейки объединяются в сеть, называемую кристаллической решеткой. Существует 14 типов решеток, называемых решетками Браве (названных в честь Августа Браве, французского физика 19-го века), и они классифицируются на семь кристаллических систем, основанных на расположении атомов — кубическую, гексагональную, тетрагональную, ромбоэдрическую, орторомбическую, моноклинную и триклинную.
Кроме регулярного расположения частиц, твердые тела обладают несколькими другими характерными свойствами. Они, как правило, вообще несжимаемы, а это означает то, что их нельзя сжать в более мелкую форму. Из-за повторяющейся геометрической структуры кристалла, все связи между частицами имеют равную силу. Это значит, что кристаллическое твердое тело будет иметь определенную точку плавления, поскольку применение тепла одновременно разрушит все связи.
Кристаллические твердые вещества также проявляют анизотропию. Это означает, что такие свойства, как показатель преломления (сколько света изгибается при прохождении вещества), проводимость (насколько хорошо он проводит электричество) и прочность на растяжение (сила, необходимая для его разрыва), будут варьироваться в зависимости от направления, от которого была применена сила. Кристаллические твердые вещества также проявляют свойство расщепления — при разрыве части будут иметь выровненную поверхность или прямые края.
Типы кристаллических твердых веществ
Существует четыре типа кристаллических твердых тел: ионные твердые тела, молекулярные твердые тела, сетевые ковалентные твердые тела и металлические твердые тела.
Ионные твердые тела
Ионные соединения образуют кристаллы, которые состоят из противоположно заряженных ионов — положительно заряженного катиона и отрицательно заряженного аниона. Из-за сильного притяжения между противоположными зарядами требуется много энергии для преодоления ионных связей. Это означает, что ионные соединения имеют очень высокую температуру плавления, часто между 300 и 1000 градусов по Цельсию.
Хотя сами кристаллы являются твердыми, хрупкими и непроводящими, большинство ионных соединений можно растворить в воде, образуя раствор свободных ионов, который будет проводить электричество. Они могут быть простыми двойными солями, такими как хлорид натрия NaCl или поваренная соль, где один атом металлического элемента — натрия, связан с одним атомом неметаллического элемента — хлора. Они также могут состоять из многоатомных ионов, таких как нитрат аммония NH4NO3. Многоатомные ионы представляют собой группы атомов, которые разделяют электроны — это называется ковалентная связь, они функционируют в соединении, как если бы они составляли один заряженный ион.
Молекулярные твердые вещества
Молекулярные твердые вещества состоят из ковалентно связанных молекул, притягиваемых друг к другу электростатическими силами — это называется Силы Ван—дер—Ваальса. Поскольку ковалентная связь предполагает совместное использование электронов, а не прямой перенос этих частиц, общие электроны могут проводить больше времени в электронном облаке более крупного атома, вызывая слабую или смещающуюся полярность. Это электростатическое притяжение между двумя полюсами — диполями, значительно слабее, чем ионное или ковалентное связывание, поэтому молекулярные твердые тела, как правило, мягче, чем ионные кристаллы, и имеют более низкие точки плавления — многие из них будут плавиться при температуре менее 100°C. Большинство молекулярных твердых веществ неполярны. Эти неполярные молекулярные твердые вещества не будут растворяться в воде, но будут растворяться в неполярном растворителе, таком как бензол и октан. Полярные молекулярные твердые вещества, такие как сахар, легко растворяются в воде. Молекулярные твердые тела являются непроводящими.
Примеры молекулярных твердых веществ — лед, сахар, галогены, такие как твердый хлор Cl2, соединения, состоящие из галогена и водорода, такие как хлористый водород HCl. Фуллерены также являются молекулярными твердыми веществами.
Ковалентные твердые вещества
В сплошной структуре твердого тела нет отдельных молекул. Атомы ковалентно связаны в непрерывной сети, что в свою очередь приводит к кристаллической структуре. Каждый атом ковалентно связан со всеми окружающими атомами. Ковалентные твердые тела обладают свойствами, аналогичными свойствам ионных твердых тел. Они очень твердые с чрезвычайно высокими температурами плавления, обычно выше 1000 градусов по Цельсию. В отличии от ионных соединений, они не растворяются в воде и не проводят электричество.
Примеры ковалентные твердых веществ — алмазы, аметисты и рубины.
Металлические твердые вещества
Металлы представляют собой непрозрачные, блестящие твердые вещества, которые являются пластичными. Они мягкие и могут быть сформированы или спрессованы в тонкие листы, или даже втянуты в провода. Валентные электроны не передаются и не распределяются, поскольку находятся в ионной и ковалентной связи. Электронные облака соседних атомов перекрываются, так что электроны становятся делокализованными. Электроны перемещаются с относительной свободой от одного атома к другому по всему кристаллу.
Металл можно описать как решетку положительных катионов в «море» отрицательных электронов. Эта подвижность электронов означает, что металлы обладают высокой проводимостью тепла и электричества. Металлы, как правило, имеют высокие точки плавления, хотя заметными исключениями являются ртуть, температура плавления которой составляет минус 38,8 градуса по Цельсию, и фосфор с температурой плавления 44 градуса по Цельсию.
Сплав представляет собой твердую смесь металлического элемента с другим веществом. Хотя чистые металлы могут быть чрезмерно податливыми и тяжелыми, сплавы являютсяболее используемыми. Бронза — сплав меди и олова, а сталь — сплав железа, углерода и других добавок.
Аморфные твердые вещества
В аморфных твердых телах («твердые тела без формы») частицы не имеют повторяющейся структуры решетки. Примерами аморфных твердых веществ являются стекло, резина, гели и большинство пластмасс. Аморфное твердое вещество не имеет определенной температуры плавления. Оно плавится постепенно в определенном диапазоне температур, потому что связи не разрываются все сразу. Аморфное твердое вещество расплавится в мягкое, податливое состояние (свечной воск или расплавленное стекло), прежде чем полностью превратиться в жидкость.
Аморфные твердые тела не имеют характерной симметрии, поэтому они не имеют ровных плоскостей при разрезании — края могут быть изогнуты. Они называются изотропными, поскольку такие свойства, как показатель преломления, проводимость и прочность на растяжение, равны независимо от направления, в котором применяется сила.
???? ???? ????
Твердыми называют такие вещества, которые способны образовывать тела и имеют объем. От жидкостей и газов они отличаются своей формой. Твердые вещества сохраняют форму тела благодаря тому, что их частицы не способны свободно перемещаться. Они отличаются по своей плотности, пластичности, электропроводности и цвету. Также у них есть и другие свойства. Так, например, большинство данных веществ плавятся во время нагревания, приобретая жидкое агрегатное состояние. Некоторые из них при подогреве сразу же превращаются в газ (возгоняются). Но есть еще и те, которые разлагаются на иные вещества.
Виды твердых веществ
Все твердые вещества подразделяют на две группы.
- Аморфные, в которых отдельные частицы располагаются хаотично. Другими словами: в них нет четкой (определенной) структуры. Эти твердые вещества способны плавиться в каком-то установленном промежутке температур. К самым распространенным из них можно отнести стекло и смолу.
- Кристаллические, которые, в свою очередь, подразделяются на 4 типа: атомные, молекулярные, ионные, металлические. В них частицы располагаются только по определенной схеме, а именно в узлах кристаллической решетки. Ее геометрия в разных веществах может сильно различаться.
Твердые кристаллические вещества преобладают над аморфными по своей численности.

Типы кристаллических твердых веществ
В твердом состоянии практически все вещества имеют кристаллическую структуру. Они отличаются своим строением. Кристаллические решетки в своих узлах содержат различные частицы и химические элементы. Именно в соответствии с ними они и получили свои названия. У каждого типа имеются характерные для него свойства:
- В атомной кристаллической решетке частицы твердого вещества связаны ковалентной связью. Она отличается своей прочностью. Благодаря этому такие вещества отличаются высокой температурой плавления и кипения. К этому типу относятся кварц и алмаз.
- В молекулярной кристаллической решетке связь между частицами отличается своей слабостью. Вещества такого типа характеризуются легкостью закипания и плавления. Они отличаются летучестью, благодаря которой имеют определенный запах. К таким твердым телам относятся лед, сахар. Движения молекул в твердых веществах этого типа отличаются своей активностью.
- В ионной кристаллической решетке в узлах чередуются соответствующие частицы, заряженные положительно и отрицательно. Они удерживаются электростатическим притяжением. Данный тип решетки существует в щелочах, солях, основных оксидах. Многие вещества этого вида легко растворяются в воде. Благодаря достаточно прочной связи между ионами они тугоплавки. Практически все они не имеют запаха, поскольку для них характерна нелетучесть. Вещества с ионной решеткой неспособны проводить электрический ток, поскольку в их составе нет свободных электронов. Типичный пример ионного твердого вещества – поваренная соль. Такая кристаллическая решетка придает ей хрупкость. Это связано с тем, что любой ее сдвиг может привести к возникновению сил отталкивания ионов.
- В металлической кристаллической решетке в узлах присутствуют только ионы химических веществ, заряженные положительно. Между ними есть свободные электроны, через которые отлично проходит тепловая и электрическая энергия. Именно поэтому любые металлы отличаются такой особенностью, как проводимость.

Общие понятия о твердом теле
Твердые тела и вещества – это практически одно и то же. Этими терминами называют одно из 4 агрегатных состояний. Твердые тела имеют стабильную форму и характер теплового движения атомов. Причем последние совершают малые колебания рядом с положениями равновесия. Раздел науки, занимающийся изучением состава и внутренней структуры, называют физикой твердого тела. Существуют и другие важные области знаний, занимающиеся такими веществами. Изменение формы при внешних воздействиях и движении называют механикой деформируемого тела.
Благодаря различным свойствам твердых веществ они нашли применение в разных технических приспособлениях, созданных человеком. Чаще всего в основе их употребления лежали такие свойства, как твердость, объем, масса, упругость, пластичность, хрупкость. Современная наука позволяет использовать и другие качества твердых веществ, которые можно обнаружить исключительно в лабораторных условиях.
Что такое кристаллы
Кристаллы – это твердые тела с расположенными в определенном порядке частицами. Каждому химическому веществу соответствует своя структура. Его атомы образуют трехмерно-периодическую укладку, называемую кристаллической решеткой. Твердые вещества обладают различной симметрией структуры. Кристаллическое состояние твердого тела считается устойчивым, поскольку имеет минимальное количество потенциальной энергии.
Подавляющее большинство твердых материалов (природных) состоит из огромного числа беспорядочно ориентированных отдельных зерен (кристаллитов). Такие вещества называют поликристаллическими. К ним относят технические сплавы и металлы, а также множество горных пород. Монокристаллическими называют одиночные природные или синтетические кристаллы.
Чаще всего такие твердые тела образуются из состояния жидкой фазы, представленного расплавом или раствором. Иногда их получают и из газообразного состояния. Этот процесс называют кристаллизацией. Благодаря научно-техническому прогрессу процедура выращивания (синтеза) различных веществ получила промышленный масштаб. Большинство кристаллов имеет естественную форму в виде правильных многогранников. Их размеры бывают самыми разными. Так, природный кварц (горный хрусталь) может весить до сотен килограммов, а алмазы – до нескольких грамм.

В аморфных твердых телах атомы находятся в постоянном колебании вокруг хаотически находящихся точек. В них сохраняется определенный ближний порядок, но отсутствует дальний. Это обусловлено тем, что их молекулы расположены на расстоянии, которое можно сравнить с их размером. Наиболее часто встречающимся в нашей жизни примером такого твердого вещества является стеклообразное состояние. Аморфные вещества часто рассматриваются как жидкость с бесконечно большой вязкостью. Время их кристаллизации иногда так велико, что и вовсе не проявляется.
Именно вышеперечисленные свойства данных веществ делают их уникальными. Аморфные твердые тела считаются нестабильными, поскольку со временем могут перейти в кристаллическое состояние.
Молекулы и атомы, из которых состоит твердое вещество, упакованы с большой плотностью. Они практически сохраняют свое взаимоположение относительно иных частиц и держатся вместе благодаря межмолекулярному взаимодействию. Расстояние между молекулами твердого вещества в различных направлениях именуют параметром кристаллической решетки. Структура вещества и ее симметричность определяют множество свойств, таких как электронная зона, спайность и оптика. При воздействии на твердое вещество достаточно большой силы эти качества могут быть в той или иной степени нарушены. При этом твердое тело поддается остаточной деформации.
Атомы твердых тел совершают колебательные движения, которыми обусловлено обладание ими тепловой энергией. Поскольку они ничтожно малы, их можно наблюдать только при лабораторных условиях. Молекулярное строение твердого вещества во многом влияет на его свойства.
Изучение твердых веществ
Особенности, свойства данных веществ, их качества и движение частиц изучаются различными подразделами физики твердого тела.
Для исследования используются: радиоспектроскопия, структурный анализ при помощи рентгена и другие методы. Так изучаются механические, физические и тепловые свойства твердых веществ. Твердость, сопротивление нагрузкам, предел прочности, фазовые превращения изучает материаловедение. Оно в значительной степени перекликается с физикой твердых тел. Существует и другая важная современная наука. Исследование существующих и синтезирование новых веществ проводятся химией твердого состояния.
Особенности твердых веществ
Характер движения внешних электронов атомов твердого вещества определяет многие его свойства, например, электрические. Существует 5 классов таких тел. Они установлены в зависимости от типа связи атомов:
- Ионная, основной характеристикой которой является сила электростатического притяжения. Ее особенности: отражение и поглощение света в инфракрасной области. При малой температуре ионная связь отличается малой электропроводностью. Примером такого вещества является натриевая соль соляной кислоты (NaCl).
- Ковалентная, осуществляемая за счет электронной пары, которая принадлежит обоим атомам. Такая связь подразделяется на: одинарную (простую), двойную и тройную. Эти названия говорят о наличии пар электронов (1, 2, 3). Двойные и тройные связи называют кратными. Существует еще одно деление этой группы. Так, в зависимости от распределения электронной плотности выделяют полярную и неполярную связь. Первая образуется разными атомами, а вторая – одинаковыми. Такое твердое состояние вещества, примеры которого — алмаз (С) и кремний (Si), отличается своей плотностью. Самые твердые кристаллы относятся именно к ковалентной связи.
- Металлическая, образующаяся путем объединения валентных электронов атомов. В результате чего возникает общее электронное облако, которое смещается под воздействием электрического напряжения. Металлическая связь образуется тогда, когда связываемые атомы большие. Именно они способны отдавать электроны. У многих металлов и сложных соединений данной связью образуется твердое состояние вещества. Примеры: натрий, барий, алюминий, медь, золото. Из неметаллических соединений можно отметить следующие: AlCr2, Ca2Cu, Cu5Zn8. Вещества с металлической связью (металлы) разнообразны по физическим свойствам. Они могут быть жидкими (Hg), мягкими (Na, K), очень твердыми (W, Nb).
- Молекулярная, возникающая в кристаллах, которые образуются отдельными молекулами вещества. Ее характеризуют промежутки между молекулами с нулевой электронной плотностью. Силы, связывающие атомы в таких кристаллах, значительны. При этом молекулы притягиваются друг к другу только слабым межмолекулярным притяжением. Именно поэтому связи между ними легко разрушаются при нагревании. Соединения между атомами разрушаются намного сложнее. Молекулярная связь подразделяется на ориентационную, дисперсионную и индукционную. Примером такого вещества является твердый метан.
- Водородная, которая возникает между положительно поляризованными атомами молекулы или ее части и отрицательно поляризованной наименьшей частицей иной молекулы либо другой части. К таким связям можно отнести лед.

Свойства твердых веществ
Что нам известно на сегодняшний день? Ученые давно изучают свойства твердого состояния вещества. При воздействии на него температур изменяется и оно. Переход такого тела в жидкость называют плавлением. Трансформация твердого вещества в газообразное состояние называется сублимацией. При понижении температуры происходит кристаллизация твердого тела. Некоторые вещества под действием холода переходят в аморфную фазу. Этот процесс ученые называют стеклованием.
При фазовых переходах изменяется внутренняя структура твердых тел. Наибольшую упорядоченность она приобретает при понижении температуры. При атмосферном давлении и температуре Т > 0 К любые вещества, существующие в природе, затвердевают. Только гелий, для кристаллизации которого нужно давление в 24 атм, составляет исключение из этого правила.
Твердое состояние вещества придает ему различные физические свойства. Они характеризуют специфическое поведение тел под воздействием определенных полей и сил. Эти свойства подразделяют на группы. Выделяют 3 способа воздействия, соответствующие 3 видам энергии (механической, термической, электромагнитной). Соответственно им существует 3 группы физических свойств твердых веществ:
- Механические свойства, связанные с напряжением и деформацией тел. По этим критериям твердые вещества делят на упругие, реологические, прочностные и технологические. В покое такое тело сохраняет свою форму, но оно может изменяться под действием внешней силы. При этом его деформация может быть пластической (начальный вид не возвращается), упругой (возвращается в первоначальную форму) или разрушительной (при достижении определенного порога происходит распад/разлом). Отзыв на прилагаемое усилие описывают модулями упругости. Твердое тело сопротивляется не только сжатию, растяжению, но и сдвигам, кручению и изгибам. Прочностью твердого тела называют его свойство сопротивляться разрушению.
- Термические, проявляющиеся при воздействии тепловых полей. Одно из самых важных свойств – температура плавления, при которой тело переходит в жидкое состояние. Оно отмечается у кристаллических твердых веществ. Аморфные тела обладают скрытой теплотой плавления, поскольку их переход в жидкое состояние при повышении температуры происходит постепенно. По достижении определенной теплоты аморфное тело теряет упругость и приобретает пластичность. Это состояние означает достижение им температуры стеклования. При нагревании происходит деформация твердого тела. Причем оно чаще всего расширяется. Количественно это состояние характеризуется определенным коэффициентом. Температура тела влияет на такие механические характеристики, как текучесть, пластичность, твердость и прочность.
- Электромагнитные, связанные с воздействием на твердое вещество потоков микрочастиц и электромагнитных волн большой жесткости. К ним условно относят и радиационные свойства.

Зонная структура
Твердые вещества классифицируются и по так называемой зонной структуре. Так, среди них различают:
- Проводники, отличающиеся тем, что зоны их проводимости и валентности перекрываются. При этом электроны могут перемещаться между ними, получая малейшую энергию. К проводникам относятся все металлы. При приложении к такому телу разности потенциалов образуется электрический ток (благодаря свободному передвижению электронов между точками с наименьшим и большим потенциалом).
- Диэлектрики, зоны которых не перекрываются. Интервал между ними превышает 4 эВ. Для проведения электронов из валентной в проводимую зону необходима большая энергия. Благодаря таким свойствам диэлектрики практически не проводят ток.
- Полупроводники, характеризующиеся отсутствием зон проводимости и валентности. Интервал между ними меньше 4 эВ. Для перевода электронов из валентной в проводимую зону необходима энергия меньшая, чем для диэлектриков. Чистые (нелегированные и собственные) полупроводники плохо пропускают ток.
Движения молекул в твердых веществах обуславливают их электромагнитные свойства.
Другие свойства
Твердые тела подразделяются и по своим магнитным свойствам. Есть три группы:
- Диамагнетики, свойства которых мало зависят от температуры или агрегатного состояния.
- Парамагнетики, являющиеся следствием ориентации электронов проводимости и магнитных моментов атомов. Согласно закону Кюри, их восприимчивость убывает пропорционально температуре. Так, при 300 К она составляет 10-5.
- Тела с упорядоченной магнитной структурой, обладающие дальним порядком атомов. В узлах их решетки периодически располагаются частицы с магнитными моментами. Такие твердые тела и вещества часто используются в разных сферах деятельности человека.

Самые твердые вещества в природе
Какие же они? Плотность твердых веществ во многом определяет их твердость. За последние годы ученые открыли несколько материалов, которые претендуют на звание «наиболее прочного те
