Каким продуктом взаимодействия является водорода
Химические свойства
водорода
При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами.
Водород вступает в реакции с простыми и сложными веществами:

— Взаимодействие водорода с металлами приводит к образованию сложных веществ — гидридов, в химических формулах которых атом металла всегда стоит на первом месте:

При высокой температуре Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя белые кристаллические вещества — гидриды металлов (LiН, NaН, КН, СаН2 и др.):
Н2 + 2Li = 2LiH
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
— При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ (см. табличку в слайде):

1). С кислородом
Водород образует воду:
Видео «Горение водорода»
2Н2 + О2 = 2Н2О + Q
При обычных температурах реакция протекает крайне
медленно, выше 550°С — со взрывом (смесь
2 объемов Н2 и 1 объема О2 называется гремучим газом).
Видео «Взрыв гремучего газа»
Видео «Приготовление и взрыв гремучей смеси»
2). С галогенами
Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl
При этом с фтором Водород взрывается (даже в темноте и
при — 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а
с йодом только при нагревании.
3). С азотом
Водород взаимодействует с образованием аммиака:
ЗН2 + N2 = 2NН3
лишь на катализаторе и при повышенных температуpax и
давлениях.
4). При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород),
значительно труднее с селеном и теллуром.
5). С чистым
углеродом Водород может реагировать без катализатора только при высоких
температуpax:
2Н2 + С (аморфный) = СН4 (метан)
— Водород вступает в реакцию замещения с оксидами металлов, при этом образуются в продуктах вода и восстанавливается металл. Водород — проявляет свойства восстановителя:

Водород используется для восстановления многих металлов, так как отнимает кислород у их
оксидов:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe +
4Н2О, и т. д.
Применение
водорода
Видео «Применение водорода»
В настоящее время водород получают в огромных
количествах. Очень большую часть его используют при синтезе аммиака,
гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме
того, водород применяют для синтеза соляной кислоты, метилового спирта,
синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп
накаливания и драгоценных камней. В продажу водород поступает в баллонах под
давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной
надписью «Водород».
Водород используется для
превращения жидких жиров в твердые (гидрогенизация), производства жидкого
топлива гидрогенизацией углей и мазута. В металлургии водород используют как
восстановитель оксидов или хлоридов для получения металлов и неметаллов
(германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода
многообразно: им обычно заполняют шары-зонды, в химической промышленности он
служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в
пищевой — для выработки из растительных масел твёрдых жиров и т. д. Высокая
температура (до 2600 °С), получающаяся при горении водорода в кислороде,
используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород
является одним из наиболее эффективных реактивных топлив. Ежегодное мировое
потребление водорода превышает 1 млн. т.
ТРЕНАЖЕРЫ
№1. Химические свойства водорода
№2. Водород
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Составьте уравнения реакций взаимодействия водорода со следующими веществами: F2, Ca, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций.
Задание №2
Осуществите превращения по схеме:
H2O -> H2 -> H2S -> SO2
Задание №3.
Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
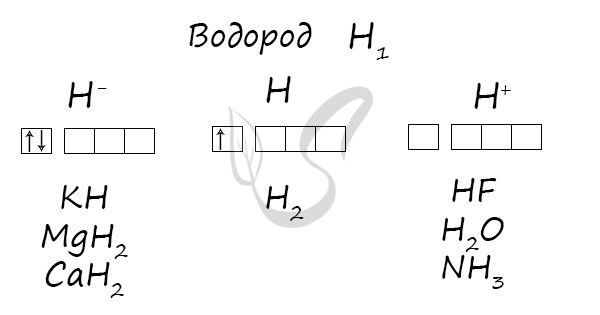
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата калия.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + H2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:

С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген | Физические свойства |
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Часть 2.
Так как водород, фактически, не встречается на Земле в свободной форме, его вынуждены извлекать из прочих связанных соединений.
Одним из главных преимуществ водородной энергетики является большое разнообразие химических способов получения водорода.
Преимуществом тут является независимость от одного метода получения водорода, что благоприятно сказывается на энергетической безопасности всей концепции водородной энергетики.
Основными методами получения водорода являются:
1. паровая конверсия метана и природного газа;
2. газификация угля;
3. электролиз воды;
4. пиролиз;
5. частичное окисление;
6. биотехнологии.
Водород можно получать взаимодействием активных металлов с кислотами-неокислителями. Например, взаимодействием Цинка и Хлороводорода:
Zn + 2HCl = ZnCl2 + H2.
Как мы видим, взаимодействие Цинка с соляной кислотой даёт выход водорода. Существуют и другие способы подобного получения водорода. Например, взаимодействие алюминия с водными растворами щелочей и т.п. Однако, подобный способ подходит лишь для лабораторных исследований и демонстраций, потому что он очень дорогой.
Концепция водородной энергетики подразумевает промышленное производство водорода; массовость и дешевизна должны быть неотъемлемой частью всей концепции.
Промышленные способы добычи водорода:
1. Электролиз воды
Промышленная установка щелочного электролиза воды
Разберём его чуть подробнее, так как много всяких изобретателей пытаются использовать именно эту технологию.
Воздействуя на дистиллированную воду электрическим током, можно разложить её на составляющие — кислород и водород:
2H2O = 2H2 + O2.
«Впервые электролитическое разложение воды на кислород и водород было осуществлено в 1800 году, а промышленное освоение этого метода началось с 1888 года, когда стали доступны генераторы постоянного тока».
Электролиз воды — довольно дорогая технология получения водорода. В совокупности, на неё приходится всего 4-5% от общего произведённого объёма водорода.
Технология электролиза воды выглядит привлекательно в связи с экологической чистотой получения и возможности создания установок с широким диапазоном производительности (от нескольких литров до сотен кубометров водорода в час).
Способ прост и удобен в эксплуатации, обладает высокой чистотой производимого водорода. Дополнительно, побочным продуктом является получение кислорода — ценного химического вещества.
Но главное, электролиз водорода — очень перспективный метод экологически чистого получения водорода из возобновляемых или атомных источников энергии.
Я напомню, что концепция производства водородной энергетики и её дальнейшего развития в водородную экономику преследует именно экологическую чистоту.
Методов разложения воды для выделения водовода множество.
Основные из них:
- электрохимический;
- термический;
- термохимический;
- биохимический;
- фотохимический;
- электролитический.
Разумеется, наиболее проработанный и изученный метод – электролитический. Он позволяет производить водород с КПД до 90%.
Существуют три промышленных способа реализации электролизной технологии производства водорода. Они отличаются типом используемого электролита и условиями проведения электролиза.
Способы реализации электролизной технологии производства водорода
Щелочной электролиз — процесс прохождения электрического тока через раствор электролита от анода к катоду, вследствие чего на них образуются газы — соответственно, водород и кислород:
1. на аноде: 2H2O + 2e– → H2 + 2OH;
2. на катоде: 2OH– → 0,5O2 + H2O + 2e;
3. суммарная реакция: H2O → H2 + 0,5O2.
Дальнейшим усовершенствованием технологии в области КПД и экономичности стала разработка электролизёров с твердо-полимерным электролитом (ТПЭ).
ТПЭ-электролизёры в 6 раз дороже водно-щелочных с аналогичными характеристиками, но при этом экологически чистые; имеют значительно меньшие массо-габаритные характеристики и энергозатраты, повышенный уровень безопасности, возможность работы в нестационарных режимах, простое обслуживание.
Основной элемент ТПЭ — беспористая полимерная мембрана перфторированного углерода, обладающая высокой химической стойкостью и высокой электропроводностью. Переносчиком заряда в таких мембранах является гидратированный протон:
1. на анод: H2O → O2 + 4H+;
2. на катод: 4H(+) + 4e(–) → 2H2.
Минимальная чистота получения водорода электролизом с ТПЭ — 99,98%.
Принципиальная схема электролизной ячейки с ТПЭ
Третий метод — высокотемпературный электролиз водяного пара. Проводится в ячейках с твёрдым электролитом на основе оксидов циркония, оксидов некоторых элементов (оксиды кальция, иттрия, иттербия, селена, ванадия) для увеличения его электропроводимости. Подобный электролит обладает униполярной проводимостью — ток через него переносится ионами кислорода, образующимися при диссоциации воды и выделении водорода на катоде:
Н2О (пар) + 2е → О2 + Н2 (газ) катод О 2(–) → 0,5 О2 (газ) + 2е.
Вывод водорода осуществляется из катодного пространства вместе с непрореагировавшим паром.
Принципиальная схема ячейки для высокотемпературного электролиза водяного пара с коаксиальным расположением электродов: 1 — катодное пространство ячейки; 2 — катод; 3 — твёрдый электролит на основе оксидов циркония; 4 — анод; 5 — анодное пространство ячейки
Независимо от способа реализации, основной вклад в стоимость водорода, производимого методом электролиза (70–90 %), вносят затраты на электроэнергию!
В комментариях к прошлой статьи читатель писал о якобы новом изобретённом им способе электролиза для получения водорода из морской воды. Но ничего нового тут нет. Смотрим формулу:
2NaCl + 2H2O = H2+ Cl2+ 2NaOH.
Ну это же элементарно, давно известно и вовсю применяется.
Для получения водорода из воды при электролизе требуется, как минимум, столько же энергии, сколько её выделяется при сгорании водорода. Однако не вся эта энергия должна поступать в виде электроэнергии — можно использовать в электролизёрах и тепловую энергию воды. Тут имеется энергетический баланс: чем выше её температура, тем больше вклад тепловой энергии и меньше вклад электрической. В ряде случаев это сулит немалую выгоду — можно использовать тепло от любого источника: скажем, от ядерного реактора. Особенно значительна экономия электроэнергии при температурах воды в районе тысячи градусов. Однако, в этих условиях сама вода переходит в пар, и снова потребуется твердый термостойкий электролит.
Многочисленные работы, в которых сделана попытка дать технико-экономическую оценку путей развития производства водорода на ближайшие годы, свидетельствуют о перспективности разрабатываемых электрохимических методов.
В перспективе можно ожидать, что параллельно с разработкой термических, термохимических, биохимических и других методов получения водорода из воды, начнутся интенсивные работы по усовершенствованию существующих и созданию более экономичных новых методов электролитического разложения воды на базе электрической энергии станций, работающих на атомной энергии. Одно из таких направлений уже разрабатывается — электролиз воды под давлением.
2. Паровая, или парокислородная конверсия метана (ПКМ).
Производство водорода методом риформинга конверсии метана
Метан – основной компонент природного газа, его концентрация в нём достигает от 77 до 99%. Высокое содержание метана и в попутных нефтяных газах – от 31 до 91%. Метан — это, фактически, большая молекула водорода, которая состоит из одного атома углерода и 4-х атомов водорода. Уже из химической формулы ясно, что метан «сильно обогащён» водородом. Следовательно, получение водорода именно из метана должно быть наиболее рентабельным.
Схема реактора паровой конверсии метана
Процесс отделения водорода от углеродной основы в метане протекает в трубчатых печах (химических паровых реформерах) с внешним подводом теплоты при температурах 750–850 градусов Цельсия через стенку трубы на каталитических поверхностях (никель, корунд и др.):
CH4+H2O ↔ CO+3H2;
далее с монооксидом углерода, или попросту «угарным газом», идёт реакция:
CO+H2O ↔ CO2+H2.
Это самый дешёвый и рентабельный способ получения водорода. Себестоимость процесса — от 2 до 5 долларов за 1 кг водорода!
В парокислородной конверсии вместе с горячим паром в активную зону реактора подаётся кислород. Реакции процесса аналогичные, что и для ПКМ, однако дополнительно происходит окисление метана кислородом:
CH4+O2 ↔ 2CO+3H2.
Реагирование веществ в парокислородной конверсии метана даёт общий результирующий тепловой эффект, равный нулю!
Это делает установку дороже на 5–10 %.
Главное преимущество парокислородной конверсии по сравнению с ПКМ — передача теплоты напрямую, а не через стенку теплообменника.
Сравнение характеристик ПКМ и парокислородной конверсии
В настоящий момент уже разработан высокоэффективный проточный мембранный аппарат для одновременного риформинга метана и окисления СО на никелевых и палладиевых катализаторах. Чистота водорода достигает 99,999 %, тогда как при конверсии природного газа — всего 76,2 %.
3. Газификация угля
Установка газификация угля
Самый старейшим с 1940-вых годов способом получения водорода является газификация угля. Справедливо встаёт вопрос: причём здесь уголь, ведь в его составе всего около 6% нужного нам газа? Однако, получение водорода из угля связано с термическим разложением воды, а сам уголь непосредственно используется в качестве энергоресурса и химического реагента. В угле много углерода, который и будет реагировать с кислородом, водой и угарным газом.
Воздействуя на уголь одновременно водяным паром и кислородом, получаем уже знакомую парокислородную конверсию.
Основные реакции процесса газификации угля:
C+O2 ↔ CO2;
C+2H2O ↔ CO2+2H2;
C+H2O ↔ CO+H2;
C+CO2 ↔ 2CO.
Существует большое количество способов газификации угля. Они отличаются термодинамическими параметрами, размером и принципом подачи угля в газогенератор, а также способом удаления шлака. Существует многоступенчатый процесс производства водорода железопаровым способом:
Fe3O4+CO ↔ 3FeO+CO2;
Fe3O4+H2 ↔ 3FeO+H2O.
Все рассмотренные методы — это автотермическое проведение реакций газификации, где в методе с CO2-акцептором осуществлён аллотермический подвод теплоты за счёт реакции СаО с двуокисью углерода. Далее, в регенераторе карбонат кальция разлагается термически:
CaO+CO2 ↔ CaCO3;
CaCO3 ↔ CaO+CO2.
Есть и классические процессы: Лурги, Копперс-Тотцека и Винклера.
Производство синтез-газа, в состав которого входят: водород, метан, окислы углерода и прочие газы — может быть также основано на переработке биомассы и промышленно-бытовых отходов, что одновременно способствует решению эколо
