Какие закономерности наблюдаются в изменении свойств

26-Авг-2012 | комментарий 21 | Лолита Окольнова
по периодам и группам
Химические свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома.
Не надо учить наизусть химические свойства каждого атома, не надо зазубривать химические реакции… ответ на любой вопрос по химии находится в Периодической системе элементов.

Как изменяются электронные конфигурации s-, p-элементов (по группам и периодам) и d-элементов, тоже можно почитать отдельно.
Давайте рассмотрим, как изменяются свойства химических элементов в группах и в периодах.
1. Изменения свойств химических элементов и их соединений в группах:

В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
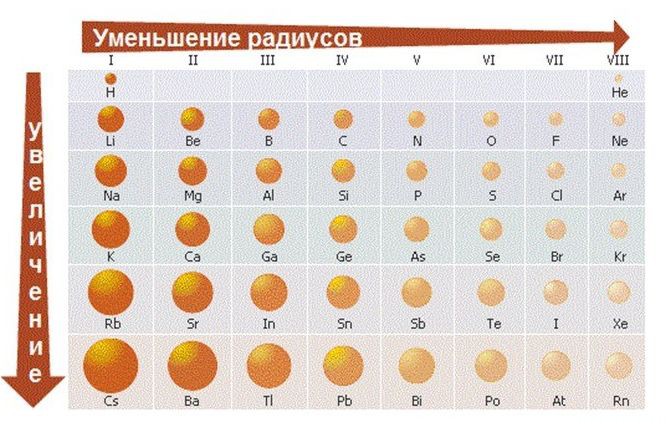
- Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
- В группах сверху вниз возрастают металлические свойства элементов
- усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:
В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
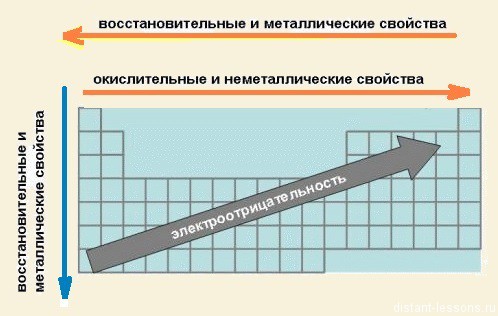
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
- В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
- усиливаются кислотные свойства их соединений

Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.
Итак, подведем итог:
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.
К ним относятся:
- Zn
- Cr
- Al
- Sn
- Pb
- Mn
- Fe
- Be
- вопросы заданий ЕГЭ по этой теме — А2
- А2 ГИА (ОГЭ)
Тест
1. В ряду Li → Ве → В → С
усиливаются восстановительные свойства простых веществ
усиливается основность соединений
усиливаются кислотные свойства соединений
кислотные свойства элементов ослабевают
2. Усиление металлических свойств элементов представлено в ряду:
N → Р → As
S → Р → Si
Sb → As → P
Al → C → N
3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0)имеет ион
Ca(0)
Al(3+)
Cs(+)
K(+)
4. В каком ряду кислотность соединений возрастает
Cr(0), Cr(3+), Cr(+6)
Mn(+6), Mn(+4), Mn(+2)
Cl(+7), Cl(+3), Cl(+1)
S(+6), S(+4), S(0)
5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO — Cr2O3 — CrO3
основной — кислотный — амфотерный
основной — амфотерный — кислотный
все основные
все несолеобразующие
6. Даны элементы: F, O, N, Cl. Какие утверждения верны?
в заданном ряду элементов электроотрицательность уменьшается
основные свойства оксидов этих элементов ослабевают, а кислотные усиливаются
неметаллические свойства простых веществ усиливаются
степень окисления атомов в высших оксидах одинакова
7. Наиболее выражены металлические свойства у:
фософра
азота
рубидия
водорода
8. Только амфотерные оксиды указаны в ряду:
Na2O, ZnO, CuO
ZnO, Al2O3, Cr2O3
Al2O3, FeO, SO3
CO2, CO, N2O5
9. Выберите правильное утверждение: А 9.в ряду элементов: Na – Si – Cl неметалличность простых веществ, образуемых этими элементами, усиливается B. в этом ряду степени окисления атомов в соединениях с кислородом увеличиваются
утвеждение А верно
веное утверждение — B
оба утверждения верны
оба неверны
10. Соединения элемента с порядковым номером 20
простое вещество проявляет металлические свойства
оксид элемента — кислотный
при взаимодействии с водой оксид элемента образует кислоту
в соединениях проявляет отрицательную степень окисления
Категории:
|
Обсуждение: «Закономерности изменения химических свойств элементов и их соединений»
(Правила комментирования)
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Анонимный вопрос · 30 октября 2018
253,9 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
При движении по группе главной подгруппы сверху вниз⬇️
????Радиус атома увеличтвается
????Электроотрицательность уменьшается
????Окислительные свойства ослабевают
????Восстановительные свойства усиливаются
????Неметаллические ослабевают
????Металлические усиливаются
По периоду слева направо всё наоброт????
????Радиус уменьшается
????ЭО возрастает
????Окислительные свойства усиливаются
????Восстановительные ослабевают
????Неметаллические увеличиваются
????Металлические свойства ослабевают
Педагог, музыкант, начинающий путешественник и немножко психолог
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
В группах (сверху… Читать далее
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
что происходит с электронами при разделении атома?
Сусанна Казарян, США, Физик
Если «разделение атома» подразумевает изменение только числа электронов в атоме, например действием света (фотоэффект) или повышением температуры, то такой процесс называется ионизацией атома. Асимптотически, такой процесс может привести к полному отрыву электронных оболочек и созданием «голого» атомного ядра.
Если «разделение атома» в вопросе подразумевает термин «деление атомного ядра», то это область Ядерной физики, а сам процесс называется радиоактивным распадом, или расщеплением ядра (если он вызван искусственно). Распад (или расщепление) атомного ядра подразумевает изменение состава ядра, т.е. числа протонов (заряд ядра, Z) и полного числа протонов и нейтронов (массовое число адра, А). Если в результате распада атомного ядра изменился и заряд ядра, то на столько же должно измениться и число электронов, для обеспечения нейтральности атома. Избыточные электроны просто выталкиваются своими собратьями и становятся свободными от ядра. Если расщепление ядра сопровождается фрагментацией ядра, то материнское ядро обычно сохраняет соответствующую электронную оболочку, в то время как фрагменты (осколки) ядра вылетает голыми. При очень больших энергиях взаимодействия с ядром, возбужденный остаток ядра может также потерять остаточную электронную оболочку.
Как изменяются свойства в следующих цепочках mn ti ca?
Всем, привет! Тема семьи и отношений очень близка мне, но, став мамой, нужно…
Они у вас расположены не совсем в правильноп порядке, сначла идёт Кальций, затем Титан , а уже дальше Марганец. Если брать измения в группе , то слева направо начинает уменьшаться радиус атома, увеличивается окислительная активность, ослабляются металлические свойства.
Сколько ещё, теоретически, можно открыть новых химических элементов?
Химия, фотография, моделизм
До недавнего времени считалось теоретически невозможным существование элементов с порядковым номером больше 170-180 из-за возможного поглощения электронов ядром и уменьшения заряда. На сегодняшний день считается, что ограничений нет. Другой вопрос, что все новые элементы являются сверхтяжелыми и нестабильными. И с учетом космической стоимости получения минимального количества нового элемента, необходимого для исследования, и его короткого срока жизни возникает вопрос о разумной целесообразности дальнейших работ. Впрочем, согласно современной теории оболочечного строения ядра должны быть т.наз. «острова стабильности», т.е. должны быть более устойчивые сверхтяжелые элементы с предельно заполненными протонными и нейтронными оболочками ядра. Так что поживем — увидим)))
Почему в группе сверху вниз радиус атомов увеличивается, и металлические свойства усиливаются?
Химия / Медицина / Биология / Русский язык / Физика / Математика / География /…
В группах (сверху вниз) радиусы атомов увеличиваются за счёт увеличения числа электронных уровней (слоёв).
В группе металлические свойства усиливаются (сверху вниз), так как радиус, по которому движутся внешние электроны увеличивается, а следовательно притяжение между ядром и электронами становится меньше — внешние электроны легче отдаются.
Надеюсь, что помог.
Почему высшая валентность изменяется периодически?
TutorOnline — одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов. Наша цель… · tutoronline.ru
С увеличением порядкового номера элемента в периоде увеличивается количество электронов на внешнем энергетическом поле, которые могут создавать химические связи. Больше электронов — выше валентность! В малых периодах с увеличением зарядов ядер радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается. Они всё сильнее притягиваются к ядру и труднее отрываются от атома. Легче всего отрываются электроны от атомов щелочного металла франция. В периоде с увеличением заряда ядра радиус атома уменьшается, число валентных электронов и их притяжение к ядру растёт, и атомам всё легче присоединять дополнительные электроны на внешний уровень. Наиболее активно принимают электроны атомы галогена фтора.
Видеоурок: Изменение свойств элементов и их соединений по периодам и группам
Лекция: Закономерности изменения свойств элементов и их соединений по периодам и группам
 Закон Д.И. Менделеева
Закон Д.И. Менделеева
 Русский ученый Д. И. Менделеев успешно работал во многих областях науки. Однако наибольшую известность ему принесло уникальное открытие периодического закона химических элементов в 1869 г. Изначально, он звучал таким образом: «Свойства всех элементов, а вследствие и качества образуемых ими простых, а также сложных веществ, стоят в периодической зависимости от их атомного веса».
Русский ученый Д. И. Менделеев успешно работал во многих областях науки. Однако наибольшую известность ему принесло уникальное открытие периодического закона химических элементов в 1869 г. Изначально, он звучал таким образом: «Свойства всех элементов, а вследствие и качества образуемых ими простых, а также сложных веществ, стоят в периодической зависимости от их атомного веса».
В настоящее время формулировка закона иная. Дело в том, что во времена открытия закона ученые не имели представления о строении атома, а за атомный вес принимался вес химического элемента. Впоследствии активного изучения атома и получения новых сведений о его строении, был выведен закон, имеющий актуальность в наши дни: «Свойства атомов хим. элементов и образованных ими простых веществ в периодической зависимости от зарядов ядер их атомов».
Закон так же выражен графически. Наглядно его изображает таблица:

 Периодическая таблица Д.И. Менделеева
Периодическая таблица Д.И. Менделеева
На данном уроке мы научимся извлекать из неё важную и нужную для постижения науки информацию. В ней вы видите строки. Это периоды. Всего их семь. Вспомните из предыдущего урока, что номер каждого периода демонстрирует количество энергетических уровней, на которых размещаются электроны атома химического элемента. Например, натрий (Na) и магний (Mg) находятся в третьем периоде, значит их электроны размещены на трех энергетических уровнях. Все периоды, за исключением 1 – го берут начало со щелочного металла, и завершаются благородным газом.
Электронная конфигурация:
щелочного металла — ns1,
благородного газа — ns2p6, за исключением гелия (Не) — 1s2.
Где n — является номером периода.
Еще мы видим в таблице вертикальные столбцы – это группы. В одних таблицах вы можете увидеть 18 групп, нумерованных арабскими цифрами. Такая форма таблица называется длинной, она появилась после обнаружения отличий d-элементов от s- и p-элементов. Но традиционной, созданной Менделеевым является короткая форма, где элементы сгруппированы в 8 групп, нумерованных римскими цифрами:
 В дальнейшем мы будем пользоваться уже знакомой и привычной для вас короткой таблицей.
В дальнейшем мы будем пользоваться уже знакомой и привычной для вас короткой таблицей.
Итак, какую информацию нам дают номера групп? Из номера мы узнаем число электронов, образующих химические связи. Они называются
валентными
. 8 групп подразделены на две подгруппы: главная и побочная.
В главную входят электроны s- и p-подуровней. Это подгруппы IА, IIА, IIIА, IVА, VА, VIА, VIIА и VIIIА. Например, аллюминий (Al) – элемент главной подгруппы III группы имеет … 3s2 3p1 валентных электрона.
Элементы, располагающиеся в побочных подгруппах, содержат электроны d — подуровня. Побочными являются группы IБ, IIБ, IIIБ, IVБ, VБ, VIБ, VIIБ и VIIIБ. Например, марганец (Mn) – элемент главной подгруппы VII группы имеет …3d5 4s2 валентных электрона.
В короткой таблице s- элементы обозначены красным, p-элементы желтым, d-элементы синим и f-элементы белым цветами.
- Какую еще информацию мы можем извлечь из таблицы? Вы видите, что каждому элементу присвоен порядковый номер. Тоже не случайно. Судя по номеру элемента, мы можем судить о количестве электронов в атоме данного элемента. К примеру, кальций (Ca) находится под номером 20, значит электронов в его атоме 20.
Но следует помнить, что численность валентных электронов периодически меняется. Связанно это с периодическими изменениями электронных оболочек. Так, при перемещении вниз по подгруппе атомные радиусы всех химических элементов начинают расти. Потому что растет количество электронных слоев. Если же перемещаться горизонтально по одному ряду радиус атома уменьшается. Почему так происходит? А связанно это с тем, что при заполнении одной электронной оболочки атома, происходящем поочередно, ее заряд возрастает. Это приводит к увеличению взаимопритяжения электронов и их сжиманию вокруг ядра.
Еще из таблицы можно сделать и такой вывод, чем выше порядковый номер элемента, тем меньше радиус атома. Почему? Дело в том, что при увеличении общего количества электронов, происходит уменьшение радиуса атома. Чем больше электронов, тем выше энергия их связи с ядром. Например, ядро атома фосфора (Р) намного сильнее удерживает электроны своего внешнего уровня, чем ядро атома натрия (Na), имеющего один электрон на внешнем уровне. И если атомы фосфора и натрия вступят в реакцию, фосфор отберет этот электрон у натрия, потому что фосфор более электроотрицательный. Этот процесс называется электроотрицательностью. Запомните, при движении вправо по одному ряду элементов таблицы их электроотрицательность возрастает, а внутри одной подгруппы она уменьшается. О данном свойстве элементов мы подробнее скажем на следующих уроках.
Запомните:
1. В периодах с увеличением порядкового номера мы можем наблюдать:
- увеличение ядерного заряда и уменьшение атомного радиуса;
- увеличение числа внешних электронов;
- увеличение ионизации и электроотрицательности;
- возрастание неметаллических окислительных свойств и убывание металлических восстановительных свойств;
- возрастание кислотности и ослабевание основности гидроксидов и оксидов.
2. В А-группах с увеличением порядкового номера мы можем наблюдать:
- увеличение ядерного заряда и увеличение атомного радиуса;
- уменьшение ионизации и электроотрицательности;
- убывание неметаллических окислительных свойств и возрастание металлических восстановительных свойств;
- возрастание основности и ослабевание кислотности гидроксидов и оксидов.
Вспомним химическую терминологию:
Ионизация — это процесс превращения атомов в ионы (положительно заряженные катионы или отрицательно заряженные анионы) во время химической реакции.
Электроотрицательность — это способность атома к притягиванию электрона другого атома во время химических реакций.
Окисление — процесс передачи электрона атома восстановителя (донора электрона) атому окислителя (акцептору электрона) и увеличение степени окисления атома вещества.
Существуют три значения степени окисления:
- при высокой электроотрицательности элемента, он сильнее притягивает к себе электроны и его атомы приобретают отрицательную степень окисления (к примеру, фтор всегда имеет степень окисления — 1);
- при низкой электроотрицательности, элемент отдает электроны и приобретает положительную степень окисления (все металлы имеют +степень, к примеру, калий +1, кальций +2, алюминий +3);
- атомы простых веществ, состоящих из одного элемента у атомов с высокими и свободные атому имеют нулевую степень.
Степень окисления ставится над символом элемента:
Восстановление — встречный окислению процесс приема электрона атома окислителя (акцептора электрона) атомом восстановителя (донором электрона) и уменьшение степени окисления атома вещества.
Кислотность — способность вещества (органического соединения) отдавать протон другим атомам, т. е. быть донором протона.
Основность — способность вещества (органического соединения) принимать протон другого атома, т. е. быть акцептором протона.
