Какие закономерности наблюдаются в изменении металлических свойств

26-Авг-2012 | комментарий 21 | Лолита Окольнова
по периодам и группам
Химические свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома.
Не надо учить наизусть химические свойства каждого атома, не надо зазубривать химические реакции… ответ на любой вопрос по химии находится в Периодической системе элементов.

Как изменяются электронные конфигурации s-, p-элементов (по группам и периодам) и d-элементов, тоже можно почитать отдельно.
Давайте рассмотрим, как изменяются свойства химических элементов в группах и в периодах.
1. Изменения свойств химических элементов и их соединений в группах:

В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
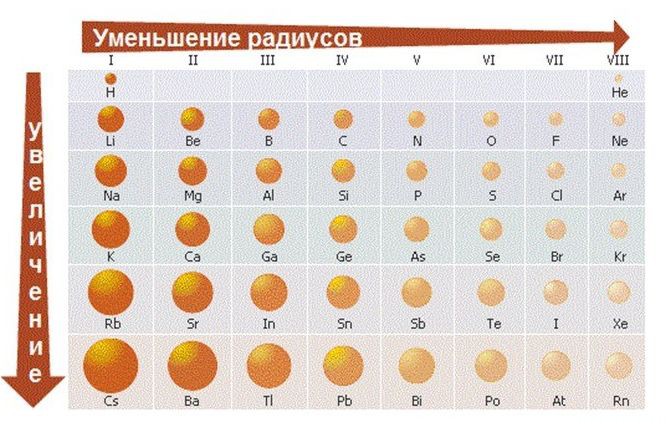
- Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
- В группах сверху вниз возрастают металлические свойства элементов
- усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:

В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
- В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
- усиливаются кислотные свойства их соединений

Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.
Итак, подведем итог:
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.
К ним относятся:
- Zn
- Cr
- Al
- Sn
- Pb
- Mn
- Fe
- Be
- вопросы заданий ЕГЭ по этой теме — А2
- А2 ГИА (ОГЭ)
Тест
1. В ряду Li → Ве → В → С
усиливаются восстановительные свойства простых веществ
усиливается основность соединений
усиливаются кислотные свойства соединений
кислотные свойства элементов ослабевают
2. Усиление металлических свойств элементов представлено в ряду:
N → Р → As
S → Р → Si
Sb → As → P
Al → C → N
3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0)имеет ион
Ca(0)
Al(3+)
Cs(+)
K(+)
4. В каком ряду кислотность соединений возрастает
Cr(0), Cr(3+), Cr(+6)
Mn(+6), Mn(+4), Mn(+2)
Cl(+7), Cl(+3), Cl(+1)
S(+6), S(+4), S(0)
5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO — Cr2O3 — CrO3
основной — кислотный — амфотерный
основной — амфотерный — кислотный
все основные
все несолеобразующие
6. Даны элементы: F, O, N, Cl. Какие утверждения верны?
в заданном ряду элементов электроотрицательность уменьшается
основные свойства оксидов этих элементов ослабевают, а кислотные усиливаются
неметаллические свойства простых веществ усиливаются
степень окисления атомов в высших оксидах одинакова
7. Наиболее выражены металлические свойства у:
фософра
азота
рубидия
водорода
8. Только амфотерные оксиды указаны в ряду:
Na2O, ZnO, CuO
ZnO, Al2O3, Cr2O3
Al2O3, FeO, SO3
CO2, CO, N2O5
9. Выберите правильное утверждение: А 9.в ряду элементов: Na – Si – Cl неметалличность простых веществ, образуемых этими элементами, усиливается B. в этом ряду степени окисления атомов в соединениях с кислородом увеличиваются
утвеждение А верно
веное утверждение — B
оба утверждения верны
оба неверны
10. Соединения элемента с порядковым номером 20
простое вещество проявляет металлические свойства
оксид элемента — кислотный
при взаимодействии с водой оксид элемента образует кислоту
в соединениях проявляет отрицательную степень окисления
Категории:
|
Обсуждение: «Закономерности изменения химических свойств элементов и их соединений»
(Правила комментирования)
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Анонимный вопрос · 30 октября 2018
253,7 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
При движении по группе главной подгруппы сверху вниз⬇️
????Радиус атома увеличтвается
????Электроотрицательность уменьшается
????Окислительные свойства ослабевают
????Восстановительные свойства усиливаются
????Неметаллические ослабевают
????Металлические усиливаются
По периоду слева направо всё наоброт????
????Радиус уменьшается
????ЭО возрастает
????Окислительные свойства усиливаются
????Восстановительные ослабевают
????Неметаллические увеличиваются
????Металлические свойства ослабевают
Педагог, музыкант, начинающий путешественник и немножко психолог
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
В группах (сверху вниз): увеличивается… Читать далее
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
Почему в группе сверху вниз радиус атомов увеличивается, и металлические свойства усиливаются?
Химия / Медицина / Биология / Русский язык / Физика / Математика / География /…
В группах (сверху вниз) радиусы атомов увеличиваются за счёт увеличения числа электронных уровней (слоёв).
В группе металлические свойства усиливаются (сверху вниз), так как радиус, по которому движутся внешние электроны увеличивается, а следовательно притяжение между ядром и электронами становится меньше — внешние электроны легче отдаются.
Надеюсь, что помог.
Как изменяются свойства в следующих цепочках mn ti ca?
Всем, привет! Тема семьи и отношений очень близка мне, но, став мамой, нужно…
Они у вас расположены не совсем в правильноп порядке, сначла идёт Кальций, затем Титан , а уже дальше Марганец. Если брать измения в группе , то слева направо начинает уменьшаться радиус атома, увеличивается окислительная активность, ослабляются металлические свойства.
Объясните,как правильно нужно расставлять коэффициенты в уровнении реакций (химия)?
Химик, книгоголик, театрофил, сентиментальный пирожок
Прежде всего, нужно убедиться, что реакция записана правильно, что из данных реагентов получаются данные продукты, нет где-нибудь потерявшейся воды или лишнего осадка. Если речь о школьной химии, то, скорее всего, у вас на руках уже есть готовая реакция с исходниками слева и продуктами справа, в которой нужно только расставить коэффициенты, так что перейдём к следующему шагу.
В левой и правой частях уравнения должно сойтись количество атомов одного и того же элемента (если слева пять кислородов, то и справа должно быть тоже пять). Обычно проблема с расстановкой коэффициентов возникает в окислительно-восстановительных реакциях (ОВР), и тут удобнее всего, на мой взгляд, пользоваться методом электронного баланса. Сначала нужно определить, какие элементы в процессе реакции меняют свою степень окисления и на сколько. Вот, например, простая реакция образования оксида фосфора (V):
xP + yO2 = zP2O5
У элементного фосфора степень окисления равна нулю. У элементного кислорода — тоже. У фосфора же в оксиде степень окисления равна +5, а степень окисления кислорода в оксиде равна -2. Значит (е = электрон):
Р(0) — 5е = Р(+5) — фосфор отдаёт 5 электронов;
О2 + 4е = 2 О(-2) — кислород принимает 4 электрона.
Чтобы количество отданных и принятых электронов уравнялось и не было ничего лишнего/недостающего, нужно первое уравнение умножить на 4, а второе — на 5. Тогда 4 атома фосфора отдадут 20 электронов, а 5 молекул кислорода примут 20 электронов. Получаем:
4Р + 5 О2 = zP2O5
Отсюда:
4Р + 5 О2 = 2 Р2О5. Реакция уравнена.
Это достаточно простой пример, который, тем не менее, неплохо иллюстрирует электронный баланс. Вот здесь можно ознакомиться с более сложными примерами. И, конечно, теорию нужно закреплять на практике: берите уравнения и расставляйте в них коэффициенты, и очень скоро всё начнёт получаться даже с объёмными реакциями со всякими страшными перманганатами и перхлоратами. Удачи! (:
Прочитать ещё 1 ответ
Как построена периодическая система химических элементов?
Интересы часто менялись, поэтому во многих областях знаний что-то знаю:)
В периодической системе отражаются сходства свойств различных элементов.
Выделяют:
- группы (столбцы таблицы), в рамках которых элементы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках.
- периоды (строки таблицы), в рамках которых элементы демонстрируют определённые закономерности в атомном радиусе, энергии ионизации и электроотрицательности, а также в энергии сродства к электрону.
- блоки, элементы в которых объединены тем, на какой оболочке находится последний электрон. Блоковая структура выглядит так:
Подробнее почитать обо всех закономерностях периодической системы можно здесь
В современной науке таблицу Д. И. Менделеева называют периодической системой химических элементов, т. к. общие закономерности в изменении свойств атомов, простых и сложных веществ, образованных химическими элементами, повторяются в этой системе через определенные интервалы — периоды. Таким образом, все существующие в мире химические элементы подчиняются единому, объективно действующему в природе периодическому закону, графическим отображением которого является периодическая система элементов. Этот закон и система носят имя великого русского химика Д. И. Менделеева.
Периоды — это ряды элементов, расположенные горизонтально, с одинаковым максимальным значением главного квантового числа валентных электронов. Номер периода соответствует числу энергетических уровней в атоме элемента. Периоды состоят из определенного количества элементов: первый — из 2 , второй и третий — из 8 , четвертый и пятый — из 18, шестой период включает 32 элемента. Это зависит от количества электронов на внешнем энергетическом уровне. Седьмой период является незавершенным. Все периоды (исключение составляет первый) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом. Когда начинает заполняться новый энергетический уровень, начинается новый период. В периоде с увеличением порядкового номера химического элемента слева направо металлические свойства простых веществ уменьшаются, а неметаллические возрастают.
Металлические свойства — это способность атомов элемента при образовании химической связи отдавать свои электроны, а неметаллические свойства — это способность атомов элемента при образовании химической связи присоединять электроны других атомов. У металлов электронами заполняется внешний s-подуровень, что подтверждает металлические свойства атома. Неметаллические свойства простых веществ проявляются при формировании и заполнении электронами внешнего р-подуровня. Неметаллические свойства атома усиливаются в процессе заполнения электронами р-подуровня (от 1 до 5). Атомы с полностью заполненным внешним электронным слоем (ns2np6) образуют группу благородных газов, которые являются химически инертными.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются неметаллические. В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в четных рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
Группы — это вертикальные столбцы элементов с одинаковым числом валентных электронов, равных номеру группы. Существует деление на главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов. Валентные электроны этих элементов расположены на внешних ns- и nр-подуровнях. Побочные подгруппы состоят из элементов больших периодов. Их валентные электроны находятся на внешнем ns-подуровне и внутреннем (n — 1) d -подуровне (или (n — 2) f-подуровне). В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы разделяются на:
1) s-элементы — элементы главной подгруппы I и II групп;
2) р-элементы — элементы главных подгрупп Ш—VII групп;
3) d -элементы — элементы побочных подгрупп;
4) f-элементы — лантаноиды, актиноиды.
Сверху вниз в главных подгруппах металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп отличаются по свойствам. Номер группы показывает высшую валентность элемента. Исключение составляют кислород, фтор, элементы подгруппы меди и восьмой группы. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I—III групп (исключение составляет бор) преобладают основные свойства, с IV по VIII — кислотные. Для элементов главных подгрупп формулы водородных соединений общие. Элементы I—III групп образуют твердые вещества — гидриды, так как степень окисления водорода -1 . Элементы IV-VII групп — газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) — нейтральны, V группы (ЭН3) являются основаниями, VI и VII групп (Н2Э и НЭ) — кислотами.
Радиусы атомов, их периодические изменения в системе химических элементов
Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т. к. притяжение ядром электронных оболочек усиливается. Происходит своеобразное их «сжатие». От лития к неону заряд ядра постепенно увели-чивается (от 3 до 10), что обуславливает возрастание сил притяжения электронов к ядру, размеры атомов уменьшаются. Поэтому в начале периода расположены элементы с небольшим числом электронов на внешнем электронном слое и большим радиусом атома. Электроны, находящиеся дальше от ядра, легко от него отрываются, что характерно для элементов-металлов.
В одной и той же группе с увеличением номера периода атомные радиусы возрастают, т. к. увеличение заряда атома оказывает противоположный эффект. С точки зрения теории строения атомов принадлежность элементов к металлам или неметаллам определяется способностью их атомов отдавать или присоединять электроны. Атомы металлов сравнительно легко отдают электроны и не могут их присоединять для достраивания своего внешнего электронного слоя.
Радиусы атомов
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
Д. И. Менделеев в 1869 г. сформулировал периодический закон, который звучит так: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов. Систематизируя химические элементы на основе их относительных атомных масс, Менделеев уделял большое внимание также свойствам элементов и образованных ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы — группы. В соответствии с современными представлениями о строении атома, основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка периодического закона такова: свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер. Периодичность в изменении свойств элементов объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в периодической системе символику.
a) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
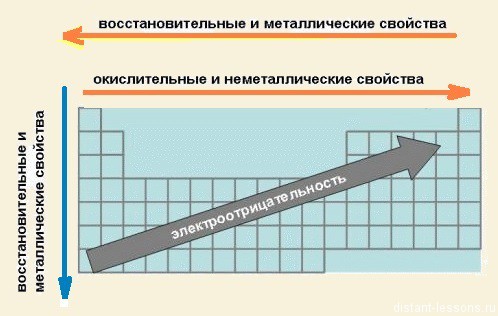
- При перемещении СПРАВА НАЛЕВО вдоль ПЕРИОДА МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении — возрастают неметаллические. Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
- Например, углерод — более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод. Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!), все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того — в левой или правой части таблицы они находятся.
- У d- и f-элементов, как мы знаем, есть «резервные» электроны из «предпоследних» оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
- Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы. Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам. Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный «блок» (это сделано в “длинной” форме таблицы), то обнаружится закономерность, показанная на Левая нижняя часть блока содержит типичные металлы, правая верхняя — типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
- Полуметаллы расположены примерно вдоль диагонали, проходящей по p-элементам от левого верхнего к правому нижнему углу Периодической таблицы
- Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной «октетной» ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них — существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
- При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой «шубой» из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
- Перечисленные выше причины объясняют, почему СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ — ВОССТАНОВИТЕЛЬНЫЕ свойства элементов.
- Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У «тяжелых» благородных газов криптона и ксенона, которые находятся в нижней части группы, удается «отобрать» электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для «легких» гелия, неона и аргона это осуществить не удается.
- В правом верхнем углу таблицы находится самый активный неметалл-окислитель фтор (F), а в левом нижнем углу — самый активный металл-восстановитель цезий (Cs). Элемент франций (Fr) должен быть еще более активным восстановителем, но его химические свойства изучать крайне трудно из-за быстрого радиоактивного распада.
- По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
- При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
- в) Закономерности, связанные с размерами атомов.
- Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода.
- При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
г) Закономерности, связанные с валентностью элементов.
- Элементы одной и той же ПОДГРУППЫ имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
- s-Элементы имеют валентности, совпадающие с номером их группы.
- p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы (число электронов на внешней оболочке).
- d-Элементы обнаруживают много разных валентностей, которые нельзя точно предсказать по номеру группы.
- Не только элементы, но и многие их соединения — оксиды, гидриды, соединения с галогенами — обнаруживают периодичность. Для каждой ГРУППЫ элементов можно записать формулы соединений, которые периодически «повторяются» (то есть могут быть записаны в виде обобщенной формулы).
Итак, подытожим закономерности изменения свойств, проявляемые в пределах периодов:
Изменение некоторых характеристик элементов в периодах слева направо:
- заряд ядер атомов увеличивается;
- радиус атомов уменьшается;
- электроотрицательность элементов увеличивается;
- количество валентных электронов увеличивается от 1 до 8 (равно номеру группы);
- высшая степень окисления увеличивается (равна номеру группы);
- число электронных слоев атомов не изменяется;
- металлические свойства уменьшается;
- неметаллические свойства элементов увеличивается.
Изменение некоторых характеристик элементов в группе сверху вниз:
- заряд ядер атомов увеличивается;
- радиус атомов увеличивается;
- число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода);
- число электронов на внешнем слое атомов одинаково (равно номеру группы);
- прочность связи электронов внешнего слоя с ядром уменьшается;
- электроотрицательность уменьшается;
- металличность элементов увеличивается;
- неметалличность элементов уменьшается.
Z — порядковый номер, равен числу протонов; R — радиус атома; ЭО — электроотрицательность; Вал е- —количество валентных электронов; Ок. св. — окислительные свойства; Вос. св. — востановительные свойства; Эн. ур. — энергитические уровни; Ме — металические свойства; НеМе — неметаллические свойства; ВСО — высшая степень окисления
Шпаргалки
Справочный материал для прохождения тестирования:

Таблица Менделеева

Таблица растворимости
