Какие свойства у растворимости

Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
Зависимость растворимости веществ от температуры выражается с помощью кривых растворимости. По кривым растворимости производят различные расчёты. Например, можно определить массу вещества, которое выпадет в осадок из насыщенного раствора при его охлаждении.
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе — приводит к образованию некоторых минералов, участвует в процессах, протекающих в горных породах.
Способы выражения характеристик растворимости[править | править код]
Характеристики растворимости подразделяются на качественные и количественные.
Качественные характеристики определяют мнение исследователя в отношении растворимости данного вещества — хорошо растворимо, плохо растворимо, мало растворимо, нерастворимо и т. п., и являются субъективными. Попытка сделать их более объективными была сделана в Государственной фармакопее СССР для обозначения растворимости лекарственных средств, но она не получила распространения.
Количественные характеристики определяют количество вещества, растворённого в данном количестве растворителя при данных условиях и обычно имеют размерности концентрации (моль/л, г/100 г растворителя, г/100 г раствора, г/кг растворителя, мольная доля и т. д.).
Качественная и количественная растворимость приводится в справочной литературе.
Влияние условий на растворимость[править | править код]
Для определения качественной растворимости часто используется эмпирическое правило «подобное растворяется в подобном». Это правило разные источники объясняют немного по-разному: полярные вещества растворяются в полярных растворителях, вещества имеющие гидроксильные группы хорошо растворяются в растворителях с гидроксильными группами и т. п.
Растворимость зависит от
- растворяемого вещества,
- растворителя,
- температуры,
- давления,
- наличия в растворителе других веществ.
Растворимость большинства газов растет с ростом давления и уменьшается с ростом температуры. Для твёрдых и жидких веществ влияние давления на растворимость менее значимо, чем для газов. Температура имеет различное влияние на различные системы «растворяемое вещество — растворитель», но в большинстве случаев при увеличении температуры растёт растворимость (обратной зависимостью обладают, например, многие соли кальция). Так как растворяемое вещество часто увеличивает температуру кипения растворителя, растворимость при атмосферном давлении может быть измерена и выше температуры кипения растворителя. При повышенном давлении и температуре растворимость может сильно увеличиваться (например, в воде при высоком давлении и температуре относительно хорошо растворяются углеводороды и кварц, которые почти нерастворимы при обычных условиях).
Наличие в растворителе других веществ может сильно влиять на растворимость. Примеры:
- добавление солей в водный раствор неполярных веществ может привести к выделению неполярного вещества в осадок, за счет эффекта высаливания,
- наличие растворённого кислорода сильно влияет на растворимость ртути в воде за счет эффектов поверхностного окисления,
- наличие небольшого количества влаги в абсолютном этаноле может сильно изменить растворимость неполярных веществ.
Энергетические эффекты при растворении[править | править код]
Растворение веществ часто происходит с разогреванием или охлаждением раствора.
Способы измерения растворимости[править | править код]
Самым старым способом измерения растворимости является растворение вещества до его выпадения в осадок, выдерживание такой смеси при определенной температуре, отделение осадка и вычисление растворившегося вещества.
В современных условиях для измерения очень малых значений растворимости часто пользуются хроматографическими системами.
При измерениях растворимости важно учесть все факторы, которые могут повлиять на растворимость.
Литература[править | править код]
- Химическая энциклопедия. — Т. 4. — М.: Большая российская энциклопедия, 1995
См. также[править | править код]
- Таблица растворимости (рус.)
- Произведение растворимости
- Константа равновесия
- Ионная жидкость
- Растворимость газов (рус.)
- Растворимость некоторых газов в воде при нормальных условиях (рус.)
Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.

Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых):

Жидкие растворы могут быть водные и неводные. Водные растворы — это растворы, в которых растворителем является вода. Неводные растворы — это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и т. д.). На практике чаще применяются водные растворы.
Растворение веществ
Растворение — сложный физико-химический процесс. Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя — это физический процесс. Одновременно происходит взаимодействие молекул растворителя с частицами растворенного вещества, т.е. химический процесс. В результате этого взаимодействия образуются сольваты.
Сольваты — продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя.
Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов. Например:

Что представляет собой и как образуется кристаллическое вещество синего цвета? При растворении в воде сульфата меди (II) происходит его диссоциация на ионы:
Образующиеся ионы взаимодействуют с молекулами воды:
При выпаривании раствора образуется кристаллогидрат сульфата меди (II) — CuSО4 • 5Н2О.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. Вода, входящая в их состав, называется кристаллизационной водой. Примеры кристаллогидратов:

Впервые идею о химическом характере процесса растворения высказал Д. И. Менделеев в разработанной им химической (гидратной) теории растворов (1887 г.). Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении, т. е. выделение или поглощение теплоты.
Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический — с выделением.
Если в результате гидратации (сольватации) выделяется больше теплоты, чем ее поглощается при разрушении структуры вещества, то растворение — экзотермический процесс. Выделение теплоты наблюдается, например, при растворении в воде таких веществ, как NaOH, AgNО3, H2SО4, ZnSО4 и др.
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение — эндотермический процесс. Это происходит, например, при растворении в воде NaNО3, KCl, K2SO4, KNO2, NH4Cl и др.
Растворимость веществ
Мы знаем, что одни вещества хорошо растворяются, другие — плохо. При растворении веществ образуются насыщенные и ненасыщенные растворы.
Насыщенный раствор — это раствор, который содержит максимальное количество растворяемого вещества при данной температуре.
Ненасыщенный раствор — это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре.
Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре.
Растворимость выражают в граммах на литр (г/л).
По растворимости в воде вещества делят на 3 группы:
Таблица растворимости солей, кислот и оснований в воде:
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления — увеличивается.
Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить: 1) коэффициент растворимости веществ при различных температурах; 2) массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t1oC до t2oC.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией. Перекристаллизация используется для очистки веществ.
Ðàñòâîðèìîñòü – ñïîñîáíîñòü âåùåñòâà ïðè îïðåäåë¸ííûõ óñëîâèÿõ îáðàçîâûâàòü ñ äðóãèìè âåùåñòâàìè ãîìîãåííûå ñèñòåìû – ðàñòâîðû, â êîòîðûõ âåùåñòâà íàõîäèòñÿ â âèäå îòäåëüíûõ àòîìîâ, èîíîâ, ìîëåêóë èëè ÷àñòèö.
Ðàñòâîðèìîñòü çàâèñèò îò ïðèðîäû ðàñòâîð¸ííîãî âåùåñòâà è ðàñòâîðèòåëÿ, à òàêæå îò âíåøíèõ óñëîâèé (òåìïåðàòóðû, äàâëåíèÿ).
Ðàñòâîðèìîñòü õàðàêòåðèçóåòñÿ:
1. Êà÷åñòâåííûìè õàðàêòåðèñòèêàìè – ñïîñîáíîñòüþ ðàñòâîðÿòüñÿ â äàííîì ðàñòâîðèòåëå ïðè îïðåäåëåííûõ óñëîâèÿõ:
- õîðîøî ðàñòâîðèìî;
- ïëîõî ðàñòâîðèìî;
- ìàëî ðàñòâîðèìî;
- íåðàñòâîðèìî è ò.ï.
2. Êîëè÷åñòâåííûìè õàðàêòåðèñòèêàìè – êîíöåíòðàöèåé íàñûùåííîãî ðàñòâîðà äàííîãî âåùåñòâà ïðè çàäàííûõ òåìïåðàòóðå è äàâëåíèè.
Êîýôôèöèåíò ðàñòâîðèìîñòè ks – îòíîøåíèå ìàññû áåçâîäíîãî ðàñòâîð¸ííîãî âåùåñòâà ê ìàññå âîäû:
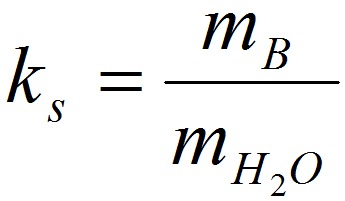
Ðàñòâîðèìîñòü íåêîòîðûõ âåùåñòâ â âîäå ïðè 20 o Ñ
Âåùåñòâî | Ðàñòâîðèìîñòü, ã íà 100 ã H2O |
NH4NO3 | 177 |
NaCl | 36 |
NaHCO3 | 10 |
H3BO3 | 6 |
CaCO3 | 0,0006 |
AgI | 0,0000002 |
Ðàñòâîðèìîñòü èîäèäà êàëèÿ â ðàçëè÷íûõ ðàñòâîðèòåëÿõ ïðè 20 o Ñ
Ðàñòâîðèòåëü | Ðàñòâîðèìîñòü, % (ìàññ.) |
Àììèàê (æèäê.) | 64 |
Âîäà | 59 |
Ìåòàíîë | 15 |
Àöåòîí | 1,3 |
Áóòàíîë | 0,2 |
Íèòðîáåíçîë | 0,0002 |
Òàáëèöà ðàñòâîðèìîñòè êèñëîò, ñîëåé è îñíîâàíèé â âîäå

Óñëîâíûå îáîçíà÷åíèÿ:
«Ð» – ðàñòâîðÿåòñÿ (>1 ã íà 100 ã H2O);
«Ì» – ìàëî ðàñòâîðÿåòñÿ (îò 0,1 ã äî 1 ã íà 100 ã H2O);
«Í» – íå ðàñòâîðÿåòñÿ (<0,01 ã íà 1000 ã H2O);
«–» – â âîäíîé ñðåäå ðàçëàãàåòñÿ.
Ìàññà âåùåñòâà â ðàñòâîðå, îíëàéí ðàñ÷åò | |
| Ðàñ÷åò ïàðàìåòðû ðàñòâîðà, òàêèå êàê ìàññà ðàñòâîðåííîãî âåùåñòâà, îáúåì, êîíöåíòðàöèþ è ìîëåêóëÿðíóþ ìàññó ðàñòâîðà. | |
| Ìàññà âåùåñòâà â ðàñòâîðå, îíëàéí ðàñ÷åò | |
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
В фармакопейном анализе понятие растворимости приводится в качестве характеристики приблизительной растворимости фармацевтических субстанций и вспомогательных веществ (далее – веществ) при фиксированной температуре. Испытание, если нет других указаний в фармакопейной статье, следует проводить при температуре (20 ± 2) ºC.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Растворимость ОФС.1.2.1.0005.15
Взамен ГФ XII, ч.1, ОФС 42-0049-07
В фармакопейном анализе понятие растворимости приводится в качестве характеристики приблизительной растворимости фармацевтических субстанций и вспомогательных веществ (далее – веществ) при фиксированной температуре. Испытание, если нет других указаний в фармакопейной статье, следует проводить при температуре (20 ± 2) ºC.
Если растворимость является показателем чистоты вещества, то в фармакопейной статье должны быть представлены конкретные количественные соотношения вещества и растворителей.
Рекомендуется использовать растворители разной полярности (обычно три); не рекомендуется использование легкокипящих и легковоспламеняющихся (например, диэтиловый эфир) или очень токсичных (например, бензол, метиленхлорид) растворителей.
Растворимость вещества (в пересчете на 1 г вещества) выражают в следующих терминах, приведенных в таблице.
Таблица — Обозначения растворимости фармацевтических субстанций и вспомогательных веществ
| Термин | Примерное количество растворителя (мл), необходимое для растворения 1 г вещества |
| Очень легко растворим | до 1 включительно |
| Легко растворим | от 1 до 10 включительно |
| Растворим | от 10 до 30 включительно |
| Умеренно растворим | от 30 до100 включительно |
| Мало растворим | от 100 до 1000 включительно |
| Очень мало растворим | от 1000 до 10 000 включительно |
| Практически нерастворим | более 10 000 |
Вещество считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. В растворе могут присутствовать следовые количества физических примесей, например, таких как волокна фильтровальной бумаги. Для веществ, образующих при растворении опалесцирующие растворы, соответствующее указание должно быть приведено в фармакопейной статье.
Термин «смешивается с…» используется для характеристики жидкостей, смешивающихся с указанным растворителем во всех соотношениях.
Если указано, что вещество растворимо в жирных маслах, то имеется в виду, что оно растворимо в любом масле, относящемся к классу жирных масел.
Методика определения растворимости
К навеске растертого в тонкий порошок вещества прибавляют отмеренное количество растворителя и непрерывно встряхивают в течение 10 мин при (20 ± 2) ºC.
Для медленно растворимых веществ, требующих для своего растворения более 10 мин, допускается нагревание на водяной бане до 30 ºC. Наблюдение производят после охлаждения раствора до комнатной температуры и энергичного встряхивания в течение 1 – 2 мин.
Условия растворения медленно растворимых веществ указывают в фармакопейных статьях.
Для веществ с неизвестной растворимостью испытание проводят по следующей методике.
К 1,0 г растертого вещества прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно очень легко растворимо.
Если вещество растворилось не полностью, то к 100 мг растертого вещества прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно легко растворимо.
Если вещество растворилось не полностью, то добавляют 2,0 мл растворителя и продолжают растворение. Если вещество полностью растворилось, оно растворимо.
Если вещество растворилось не полностью, то добавляют 7,0 мл растворителя и продолжают растворение. Если вещество полностью растворилось, оно умеренно растворимо.
Если вещество растворилось не полностью, то к 10 мг растертого вещества прибавляют 10,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно мало растворимо.
Если вещество растворилось не полностью, то к 10 мг растертого вещества прибавляют 100 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно очень мало растворимо.
Если вещество не растворилось, оно практически нерастворимо в данном растворителе.
Для веществ с известной растворимостью испытание проводят по описанной выше методике, но только для крайних значений, относящихся к указанному термину. Например, если вещество растворимо, то 100 мг растертого вещества не должны растворяться в 1,0 мл растворителя, но должны раствориться полностью в 3,0 мл растворителя.
Скачать в PDF ОФС.1.2.1.0005.15 Растворимость
Ïðîèçâåäåíèå ðàñòâîðèìîñòè – âåëè÷èíà, êîëè÷åñòâåííî õàðàêòåðèçóþùàÿ ñïîñîáíîñòü ýëåêòðîëèòà ðàñòâîðÿòüñÿ â íàñûùåííîì ðàñòâîðå ïðè äàííîé òåìïåðàòóðå è ïðîèçâåäåíèå êîíöåíòðàöèé èîíîâ åñòü âåëè÷èíà ïîñòîÿííàÿ.
Ðàñòâîðåíèå òâåðäîãî âåùåñòâà â âîäå îñòàíàâëèâàåòñÿ òîãäà, êîãäà îáðàçóåòñÿ íàñûùåííûé ðàñòâîð, ò.å. óñòàíàâëèâàåòñÿ ðàâíîâåñèå ìåæäó òâåðäûì âåùåñòâîì è ÷àñòèöàìè òîãî æå âåùåñòâà, íàõîäÿùèìèñÿ â ðàñòâîðå. Íàïðèìåð, â íàñûùåííîì ðàñòâîðå õëîðèäà ñåðåáðà íàáëþäàåòñÿ ðàâíîâåñèå:
AgClòâ⇆Ag+âîäû+Ñl-âîäû.
È êîíñòàíòà ðàâíîâåñèÿ ìîæåò áûòü çàïèñàíà ñëåäóþùèì îáðàçîì:
K=[Ag+]·[Cl-].
À íå òàê:

Ñêîðîñòè 2õ ïðîòèâîïîëîæíûõ íàïðàâëåííûõ ïðîöåññîâ – ðàñòâîðåíèÿ è êðèñòàëëèçàöèè – ïðîïîðöèîíàëüíû ïëîùàäè ïîâåðõíîñòè òâåðäîãî âåùåñòâà. Ïðè äîñòèæåíèè ðàâíîâåñèÿ ïëîùàäè ïîâåðõíîñòè âçàèìíî ñîêðàùàþòñÿ. Ïîýòîìó èìåííî ýòè êîíöåíòðàöèè çàïèñûâàþòñÿ â âûðàæåíèè äëÿ êîíñòàíòû ðàâíîâåñèÿ.
Ïîýòîìó ïðîèçâåäåíèå ðàñòâîðèìîñòè ÏÐ áóäåò âûãëÿäåòü òàê:
ÏÐAgCl = [Ag+][Cl-].
Ïðîèçâåäåíèÿ ðàñòâîðèìîñòè íåêîòîðûõ ñîåäèíåíèé.

Ïðîèçâåäåíèå ðàñòâîðèìîñòè äëÿ äàííîãî ñîåäèíåíèÿ ìîæíî îïðåäåëèòü ïî ðåçóëüòàòàì èçìåðåíèÿ åãî ðàñòâîðèìîñòè è íàîáîðîò.
Ðàññìîòðèì ïðèìåð ðàñ÷åòà: íåîáõîäèìî âû÷èñëèòü ðàñòâîðèìîñòü AgCl. Îáîçíà÷èì èñêîìóþ ðàñòâîðèìîñòü õëîðèäà ñåðåáðà ÷åðåç s, òîãäà ðàçíîâåñíûå êîíöåíòðàöèè òàêæå áóäóò ðàâíû s:
[Ag+]=[Cl]=[AgCl]=s.
Òîãäà:

Çíà÷åíèå ÏÐ – ïðîèçâåäåíèå ðàâíîâåñíûõ êîíöåíòðàöèé èîíîâ.
Ìàññà âåùåñòâà â ðàñòâîðå, îíëàéí ðàñ÷åò | |
| Ðàñ÷åò ïàðàìåòðû ðàñòâîðà, òàêèå êàê ìàññà ðàñòâîðåííîãî âåùåñòâà, îáúåì, êîíöåíòðàöèþ è ìîëåêóëÿðíóþ ìàññó ðàñòâîðà. | |
| Ìàññà âåùåñòâà â ðàñòâîðå, îíëàéí ðàñ÷åò | |
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Êîëëîèäíûå ðàñòâîðû. | |
| Êîëëîèäíûå ðàñòâîðû ýòî äèñïåðñíûå ñèñòåìû, â êîòîðûõ ÷àñòèöû (êàïëè, ïóçûðüêè) èìåþùèå ðàçìåð â ïðåäåëàõ îò 1 — 100 íì, ðàñïðåäåëåíû â äèñïåðñèîííîé ñðåäå. | |
| Êîëëîèäíûå ðàñòâîðû. | |
