Какие свойства у натрия

Таблица
^
=>>
v
Натрий в минеральном масле
и натрий в ампуле
(фото сайта periodictable.ru)

История открытия:
Натроном первоначально называли гидроксид натрия. В 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы — калий и натрий, назвав их потассий (Potassium) и содий (Sodium). Берцелиус, и затем Гесс в России предложили названия Natrium / Натрий, которое и закрепилось.
Нахождение в природе, получение:
В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав различных соединений. Наиболее важным является соединение натрия с хлором NaCl, которое образует залежи каменной соли (Донбасс, Соликамск, Соль-Илецк и др.). Хлорид натрия содержится также в морской воде и соляных источниках. Натрий относится к числу распространенных элементов. Содержание натрия в земной коре составляет 2,64%.
Получают электролизом расплавленного хлорида натрия или гидроксида натрия. Применяется также и восстановление его оксидов, хлоридов, карбонатов алюминием, кремнием, кальцием, магнием при нагревании в вакууме.
Физические свойства:
Натрий — серебристо-белый металл, его плотность — 0,97 г/см3, очень мягкий, легко режется ножом. Между атомами металлическая связь. Для вещества с такой связью характерны металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Химические свойства:
Атом натрия при химическом взаимодействии легко отдает валентные электроны, переходя в положительно заряженный ион. На воздухе быстро окисляется, поэтому его хранят под слоем керосина.
При сгорании в избытке кислорода образует пероксид натрия, Na2O2
С водородом при нагревании образует гидрид Na + H2 = 2NaH
Легко взаимодействует со многим неметаллами — галогенами, серой, фосфором и др.
Бурно реагирует с водой:
2Na + 2H2O = 2NaOH + H2
Важнейшие соединения:
Оксид натрия, Na2O (бесцветный), реагирует с парами воды, углекислым газом, потому хранить лучше в безводном бензоле.
При непосредственной реакции натрия с кислородом получается смесь оксида и пероксида натрия. Для получения чистого оксида можно использовать реакцию: Na2O2 + 2Na = 2Na2O
Пероксид натрия, Na2O2 (желтый) кристаллическое вещество с ионной решеткой, взаимодействует с влажным углекислым газом воздуха, выделяя кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Гидроксид натрия, NaOH — кристаллическое белое вещество, сравнительно легкоплавкое, термически очень устойчиво. При нагревании испаряется без потери воды. Хорошо растворяется в воде, в спиртах.
Галогениды натрия, бесцветные кристаллические вещества, хорошо растворимы в воде, за исключением NaF. Для них характерны восстановительные свойства.
Сульфид натрия, — Na2S. Бесцветное кристаллическое вещество с ионной решеткой. Хорошо растворимо в воде, является сильным восстановителем.
Соли, все соли хорошо растворимы, являются сильными электролитами.
Гидрид натрия, NaH — бесцветное кристаллическое вещество с кристаллической решеткой типа NaCl, анионом является H -. Получают пропусканием водорода над расплавленными металлом. Подвергается термической диссоциации не плавясь, легко разлагаются водой:
2NaH = 2Na + H2
NaH + H2O = NaOH + H2
Применение:
Соединения натрия — важнейшие компоненты химических производств. Используются в мыловарении, производстве стекла, средств бытовой химии.
Натрий важен для большинства форм жизни, включая человека. В живых организмах ионы натрия вместе с ионами калия выполняют функцию передатчиков нервного импульса. Также его ионы играют важную роль в поддержании водного режима организма.
Бондарева Мария Александровна
ХФ ТюмГУ, 561 группа.
Источники: Г.П. Хомченко «Пособие по химии для поступающих в ВУЗы»
«Неорганическая химия в схемах и таблицах»
История натрия
Натрий в чистом виде получил в 1807 году Хемфри Дэви – английский химик, который незадолго до натрия открыл калий. Дэви проводил процесс электролиза одного из соединений натрия – гидроксида, расплавив который и получил натрий. Соединениями натрия человечество пользовалось со времён глубокой древности, содой природного происхождения пользовались ещё в Древнем Египте (calorizator). Называли элемент содий (sodium), иногда именно это название можно встретить даже сейчас. Привычное название натрий (от латинского natrium – сода) было предложено шведом Йенсом Берцелиусом.
Общая характеристика натрия
Натрий является элементом I группы III третьего периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 11 и атомную массу 22,99. Принятое обозначение – Na (от латинского natrium).

Нахождение в природе
Соединения натрия содержатся в земной коре, морской воде, в виде примеси, имеющей свойство окрашивать каменную соль в синий цвет из-за действия радиации.
Физические и химические свойства
Натрий является мягким пластичным щелочным металлом, имеет серебристо-белый цвет и блеск на свежем срезе (натрий вполне возможно разрезать ножом). При применении давления превращается в прозрачное вещество красного цвета, при обычной температуре кристаллизуется. При взаимодействии с воздухом быстро окисляется, поэтому хранить натрий необходимо под слоем керосина.

Суточная потребность в натрии
Натрий – важный для организма человека микроэлемент, суточная потребность в нём для взрослых составляет 550 мг, для детей и подростков – 500-1300 мг. В период беременности норма натрия в сутки составляет 500 мг, а в некоторых случаях (обильное потоотделение, обезвоживание, приём мочегонных препаратов) должна быть увеличена.
Продукты питания богатые натрием
Натрий содержится практически во всех морепродуктах (раках, крабах, осьминогах, кальмарах, мидиях, морской капусте), рыбе (анчоусах, сардинах, камбале, корюшке и т.д.), куриных яйцах, крупах (гречневой, рисе, перловой, овсяной, пшённой), бобовых (горохе, фасоли), овощах (томатах, сельдерее, моркови, капусте, свёкле), молочных продуктах и мясных субпродуктах.

Полезные свойства натрия и его влияние на организм
Полезными для организма свойствами натрия являются:
- Нормализация водно-солевого обмена;
- Активизация ферментов слюнной и поджелудочной желез;
- Участие в выработке желудочного сока;
- Поддержание нормального кислотно-щелочного баланса;
- Генерирование функций нервной и мышечной системы;
- Сосудорасширяющее действие;
- Поддержание осмотической концентрации крови.
Усвояемость натрия
Натрий содержится практически во всех продуктах, хотя большую его часть (около 80%) организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонком кишечнике. Витамин D улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию.
Взаимодействие с другими
Повышенное потребление натрия вызывает накопление жидкости в организме, отеки, повышает кровяное давление. Большой прием натрия (соли) приведет к истощению запасов калия, кальция и магния.
Применение натрия в жизни
Применение металлического натрия – химическая и металлургическая промышленность, где он выступает в роли сильнейшего восстановителя. Хлоридом натрия (поваренной солью) пользуются все без исключения жители нашей планеты, это самое известное вкусовое средство и древнейший консервант.
Признаки нехватки натрия
Нехватка натрия обычно случается при чрезмерном потоотделении – в жарком климате или при физических нагрузках. Недостаток натрия в организме характеризуется ухудшением памяти и потерей аппетита, головокружением, быстрой утомляемостью, обезвоживанием, мышечной слабостью, а иногда – судорогами, кожными высыпаниями, желудочными спазмами, тошнотой, рвотой.
Признаки избытка натрия
Излишнее количество натрия в организме даёт о себе знать постоянной жаждой, отёками и аллергическими реакциями.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Содержание статьи:
- Свойства
- Функции в организме человека
- Польза
- Вред
- Суточная норма
- В каких продуктах содержится натрий
- Недостаток и избыток
Ценность натрия для человеческого организма сложно переценить, ведь элемент контролирует многие обменные процессы. Его наличие может избавить от многих неприятных симптомов, макроэлемент даже способен продлить молодость. Однако и избыток натрия чреват серьезными проблемами со здоровьем. Поэтому крайне важно иметь представление о его вреде и пользе, а также о симптомах передозировки и дефицита макроэлемента.
Натрий известен человечеству еще со времен Древнего Египта. Правда, тогда он назывался содий, современное название элементу дал Йенс Берцелиус. Макроэлемент имеет отношение к числу щелочных металлов. В системе Менделеева его можно увидеть в первой группе, третьего периода. Впервые он был получен в чистом виде Хэмфри Дэви. Этот химик, английского происхождения, в 1807 году поставил эксперимент, в ходе которого был получен натрий.

Свойства натрия
Натрий обладает рядом физических и химических свойств:
- высокий уровень теплопроводности;
- металл белого цвета, с заметным сероватым оттенком;
- обладает хорошей электропроводностью;
- имеет высокую пластичность, можно сделать разрез при помощи обычного ножа;
- если сделать срез, то на металле выступит явный блеск;
- при воздействии кислорода элемент быстро окисляется, поэтому его хранят лишь под слоем керосина;
- при комнатной температуре происходит процесс кристаллизации натрия;
- приобретает прозрачность и красный окрас, если было использовано давление.
Функции натрия в организме человека

Натрий выполняет ряд функций, без которых нормальная работа организма человека была бы невозможна:
- провоцирует выработку ферментов, которые обеспечивают переваривание пищи;
- способствует функционированию выделительной системы в нормальном режиме;
- является одним из компонентов необходимых для продуцирования гормона вазопрессина;
- предупреждает обезвоживание, так как натрий удерживает влагу в тканях;
- доставляет клеткам дозу глюкозы необходимую для обеспечения энергией;
- осуществляет контроль над продуцированием гормона адреналина;
- сокращает риски возникновения кислотно-щелочного дисбаланса;
- выступает одним из компонентов, обеспечивающих продуцирование соляной кислоты стенками желудка;
- поддерживает в тонусе сосуды;
- обеспечивает образование натрийуретические пептидов, которые избавляют организм от излишка воды, и отвечают за расширение сосудов;
- помогает глюкозе проникнуть внутрь клетки;
- является необходимым элементом, способствующим формированию канальцеввнутри клеточных мембран.
Благодаря этим канальцам клетки могут получать полезные вещества. Помимо перечисленных функций натрий осуществляет поддержку осмотического давления. Благодаря этому, клетки могут получать питательные вещества и выводить вредные. Правда, подобное воздействие возможно лишь в паре с достаточным количеством хлора.
Совместное действие этих элементов обеспечивает сокращение мышечных тканей. Кроме того, они позволяют сигналам, идущим от нервной системы, перемещаться свободно. Помимо хлора, натрий активно взаимодействует и с калием. Их тандем позволяет организму осуществлять контроль за балансом электролитов на клеточном уровне.
Польза натрия для организма

Макроэлемент в разумных дозах необходим организму для правильной работы. Ведь ему отведена ключевая роль во многих процессах.
Польза натрия для организма заключается в следующем:
- Способствует выводу диоксида углерода.
- Обеспечивает правильную работу мозга. Макроэлемент способствует функционированию головного мозга. Уменьшение суточной дозы натрия может спровоцировать приступ головокружения, в редких случаях возможны летаргические припадки. Вдобавок уменьшение потребления натрия может привести к спутанности сознания.
- Способствует улучшению всасываемости полезных веществ. Натрий помогает кишечнику абсорбировать хлориды, глюкозу, аминокислоты. Способствует выводу излишков через выделительную систему.
- Замедляет процессы старения. Макроэлемент обладает свойством бороться с воздействием свободных радикалов, что делает его незаменимым в косметологии. Антивозрастной эффект выражается в поддержании тургора кожи, что значительно замедляет процесс старения.
- Поддерживает безопасное соотношение положительно и отрицательно заряженных ионов. Натрий сокращает риск появления дисбаланса. Поддержание безопасного соотношения разно заряженных ионов обеспечивает передачу нервных импульсов, способствует функционированию мышц.
Помимо перечисленных свойств для натрия характерно антисептическое воздействие. Благодаря этому его используют при производстве мыла, шампуня, зубной пасты и ополаскивателя для полости рта.
Вред натрия

Употребление натрия на постоянной основе в увеличенных дозах может принести вред организму и спровоцировать целый ряд заболеваний. Ведь макроэлемент негативно влияет на обменные процессы в организме. Из-за обилия натрия жидкости хуже циркулируют. В результате повышается кровяное давление, организм перестает выводить жидкость.
Избыток жидкости приводит к отекам, из-за которых осложняется работа внутренних органов, происходит нагрузка на сосуды. Вдобавок натрий способствует вымыванию кальция из костей, что может привести к возникновению частых переломов. Макроэлемент приводит и к уменьшению запасов магния и калия, что может вызывать проблемы сердцем.
Суточная норма натрия

Ежедневно для обеспечения правильной работы организма человек должен потреблять около 1300-1500 мг натрия. Не допускается употребление более 2 г, так как это может привести к передозировке. Подобное количество макроэлемента находится в 5-6 г соли, что равняется 1 чайной ложке без горки.
Для детей норма потребления разниться в зависимости от возраста:
- до 1 года содержание натрия не должно превышать 200-300 мг;
- с 1 до 3-х лет дозировку можно повысить до 500 мг;
- до 7 лет допускается употребление 700 мг;
- в возрастном периоде от 7 до 11 лет нормой будет считаться 1000 мг;
- до 14 лет дозировка натрия в рационе достигает 1100 мг;
- с 14 по 18 лет можно употреблять на 200 мг больше, чем в предыдущем возрастном периоде – 1300 мг.
В некоторых случаях суточная норма натрия может быть увеличена:
- Если область проживания расположена в государствах с жарким климатом. К примеру, страны Африканского континента или Южной Америки.
- Если основная деятельность связана с постоянными физическими нагрузками. Например, спортсмены или разнорабочие.
- Если работа осуществляется в условиях повышенной температуры. К примеру, при службе на металлургическом производстве.
- При различных отравлениях, вызывающих расстройство желудка.
- В случае приема мочегонных средств.
- При наличии гипергидроза или заболеваний надпочечников.
В каких продуктах содержится натрий

Самый простой способ восстановить норму натрия в организме – употребление соли. Одной чайной ложки будет достаточно, чтобы восполнить суточную дозу. Обычно основное количество полезных веществ поступает в организм через пищу.
Наибольшее количество натрия содержится в следующих продуктах:
- В полуфабрикатах, консервах или готовой продукции. К примеру, копченая колбаса содержит около 2180 мг, а соленой сельди порядка 4800 мг.
- В овощах, фруктах и зелени. Например, стручковая фасоль содержит порядка 400 мг, а в шпинате – 85 мг. Среди фруктов высокой концентрацией отличаются бананы и абрикосы — 54 и 31 мг.
- Морепродукты. Раки обогатят организм натрием на 380 мг, а камбала на 200 мг.
Недостаток и избыток натрия в организме

В настоящее время дефицит натрия встречается крайне редко. Обычно он связан с работой в условиях повышенного температурного режима. В некоторых случаях его возникновение могут спровоцировать различные заболевания, для которых характерны лихорадочные состояния. При этом натрий активно выводится из организма под действием жара.
Недостаток натрия в организме может проявиться по другим причинам:
- проведение диет, при которых ограничивается или исключается из рациона соль;
- сбои продуцирования антидиуретического гормона;
- периодическое промывание кишечника, посредством клизм;
- потребление кофеиносодержащих напитков в неконтролируемом количестве;
- заболевания эндокринной природы;
- цирроз печени;
- потребление продуктов, содержащих большое количество калия;
- наличие травм, сильных ожогов или операций.
В этом случае макроэлемент будет скапливаться в поврежденных местах провоцируя более ускоренное заживление.
К основным признакам нехватки макроэлемента можно отнести:
- возникновение головокружений, затяжные головные боли;
- рефлекторные мышечные подергивания;
- ощущение сильной жажды, высыхание слизистых;
- развитие метеоризма, появление рвоты и тошноты;
- при длительном дефиците – мышечная дистрофия;
- возникновении гипотонии;
- выпадение волос;
- кожа приобретает синюшный оттенок, из-за кислородного голодания, которое провоцирует нехватка натрия;
- нарушение сердечного ритма, его значительное учащение;
- слабость и сонливость;
- нарушение координации движений;
- снижение веса;
- сухость кожи, появление морщин и трещин;
- озноб.
Все перечисленные симптомы объясняются довольно просто. Из-за наличия длительного дефицита макроэлемента, его содержание в межклеточной жидкости сокращается. В свою очередь это провоцирует скопление азотистых соединений. Их избыток постепенно отравляет организм, и может даже привести к смерти.
Намного чаще дефицита макроэлемента, ставится диагноз передозировка. Это не удивительно, ведь многие продукты содержат скрытый натрий, поэтому контролировать его содержание довольно сложно.
К основным причинам, провоцирующим развитие избытка натрия можно отнести:
- сахарный диабет;
- чрезмерное употребление снековой продукции (чипсов, сухарей, орехов);
- малое употребление воды;
- бесконтрольное употребление соли;
- регулярный прием лекарств, обеспечивающих функционирование почек (Кортизон).
Передозировка натрия характеризуются следующими симптомами:
- развитие судорог;
- повышение давления;
- возникновение одышки;
- появление отеков;
- возбудимость нервной системы;
- гиперемия кожных покровов;
- набор веса.
Вдобавок существуют исследования, доказавшие связь между избытком натрия и формированием катаракты. В этом случае болезнь развивается из-за хронического повышения внутриглазного давления, которое провоцирует увеличение дозы макроэлемента в организме пациента. Избыток натрия вызывает скопление эритроцитов, что приводит к риску появления тромбоза. Кроме того, постоянные перепады давления тоже могут объясняться дисбалансом натрия.
Ñîåäèíåíèÿ íàòðèÿ ñòàëè èçâåñòíû ÷åëîâå÷åñòâó ñ ãëóáîêîé äðåâíîñòè.
Ñåé÷àñ, òàêæå, êàê è ðàíüøå íåâîçìîæíî âîîáðàçèòü ñâîþ æèçíü áåç ïðèñóòñòâèÿ â íåé ñîåäèíåíèé íàòðèÿ.
 íàøè äíè àáñîëþòíî âñå ëþäè åæåäíåâíî âñòðå÷àþò âîêðóã ñåáÿ îãðîìíîå êîëè÷åñòâî ñîåäèíåíèé íàòðèÿ, äàæå, ïîðîé, íå çíàÿ îá ýòîì. Ýòî è îáû÷íàÿ ïîâàðåííàÿ ñîëü, ïèùåâàÿ ñîäà, ùåëî÷íûå ÷èñòÿùèå ñðåäñòâà, ìûëî è ñðåäñòâà äëÿ ìûòüÿ ïîñóäû, ëåêàðñòâåííûå ñðåäñòâà (àñïèðèí, òåòðàáîðàò íàòðèÿ è äðóãèå), ñòåêëî, ëàìïû è ìíîæåñòâî äðóãèõ òîâàðîâ ìàññîâîãî ïîòðåáëåíèÿ.
Ñàìûì ðàñïðîñòðàíåííûì èñòî÷íèêîì íàòðèÿ íà ïëàíåòå ñ÷èòàåòñÿ êàìåííàÿ ñîëü (ãàëèò). Ãàëèò ýòî ïðàêòè÷åñêè ÷èñòûé NaCl.
Äåñÿòêè ñàìûõ ðàçíûõ ñîåäèíåíèé íàòðèÿ èñïîëüçóþòñÿ ñåãîäíÿ âî âñåõ ñôåðàõ íàøåé äåÿòåëüíîñòè.
Î íàèáîëåå âàæíûõ ñîåäèíåíèÿõ íàòðèÿ, à òàêæå îá èõ èñïîëüçîâàíèè â ïðîìûøëåííîñòè è ïîéäåò ðå÷ü íèæå.
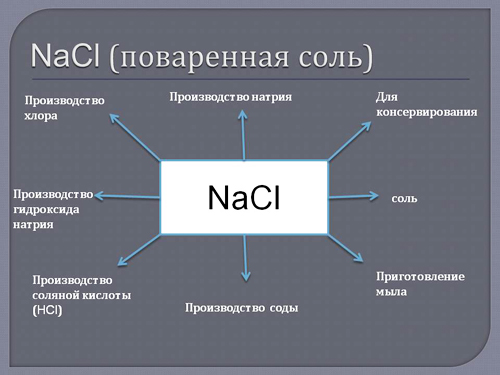
Õëîðèä íàòðèÿ NaCl íàèáîëåå èçâåñòíîå âñåì ïðèìåíåíèÿ ïîëó÷èë â êà÷åñòâå óñèëèòåëÿ âêóñà. Âåäü õëîðèä íàòðèÿ íè ÷òî èíîå, êàê ïîâàðåííàÿ ñîëü. Êðîìå óëó÷øåíèÿ âêóñîâûõ êà÷åñòâ õëîðèä íàòðèÿ îáëàäàåò àíòèáàêòåðèàëüíûìè ñâîéñòâàìè, ïîýòîìó èñïîëüçóåòñÿ â êà÷åñòâå êîíñåðâàíòà.
Ïîä âîçäåéñòâèåì ýëåêòðè÷åñêîãî òîêà èç NaCl, ðàñòâîðåííîãî â âîäå, ïîëó÷àþò ñðàçó òðè âàæíåéøèõ äëÿ ïðîìûøëåííîñòè ýëåìåíòà. Ýòî ãàçîîáðàçíûé õëîð (Cl2), ãèäðîîêñèä íàòðèÿ (âòîðîå íàçâàíèå — êàóñòè÷åñêàÿ ñîäà) (NaOH) è ãàçîîáðàçíûé âîäîðîä (H2).
 ñâîþ î÷åðåäü õëîð ïðèìåíÿåòñÿ â ïðîèçâîäñòâå, êðàñîê, ðàñòâîðèòåëåé, ïëàñòìàññ, ïåñòèöèäîâ, èñïîëüçóåòñÿ â òåêñòèëüíîé è ôàðìàöåâòè÷åñêîé ïðîìûøëåííîñòè.
Ãèäðîîêñèä íàòðèÿ è ðàñòâîð ãèäðîîêñèäà íàòðèÿ íàøëè áîëüøîå ïðèìåíåíèå â ìåòàëëóðãè÷åñêîé, íåôòåïåðåðàáàòûâàþùåé, êîñìåòè÷åñêîé, òåêñòèëüíîé, à òàêæå ïèùåâîé ïðîìûøëåííîñòÿõ. Êðîìå òîãî ýòè ñîåäèíåíèÿ óñïåøíî ïðèìåíÿþòñÿ äëÿ îáðàáîòêè âîäû.
Êàðáîíàò íàòðèÿ( Na2CO3) âñåì èçâåñòíàÿ ñîäà. Ýòî ñîåäèíåíèå íàòðèÿ íàøëî ïðèìåíåíèå â ïðîèçâîäñòâå ñòåêëà, áóìàãè è öåëëþëîçû, ìûëà, ÷èñòÿùèõ è ìîþùèõ ñðåäñòâ, â ëåãêîé ïðîìûøëåííîñòè. Ïèùåâàÿ ñîäà âõîäèò â ñîñòàâ ïðîäóêòîâ ïèòàíèÿ. Òàêæå èñïîëüçóåòñÿ äëÿ î÷èñòêè ñòî÷íûõ âîä, êðîìå òîãî ÿâëÿåòñÿ îòïðàâíîé òî÷êîé äëÿ ïðîèçâîäñòâà äðóãèõ ñîåäèíåíèé íàòðèÿ.
Áèêàðáîíàò íàòðèÿ (NaHCO3) ïðè ðàñòâîðåíèè â âîäå âûçûâàåò ðåàêöèþ øèïåíèÿ. Íàïðèìåð, ãàçèðîâàííûå íàïèòêè, ðàçðûõëèòåëü äëÿ òåñòà, àñïèðèí â «øèïó÷èõ» òàáëåòêàõ çäåñü èñïîëüçóåòñÿ áèêàðáîíàò íàòðèÿ.
Ãèïîõëîðèò íàòðèÿ ( NaOCl) èñïîëüçóåòñÿ â ôàðìàöåâòè÷åñêîé ïðîìûøëåííîñòè, â êà÷åñòâå îäíîãî èç êîìïîíåíòîâ, âõîäÿùèõ â ñîñòàâ áûòîâîé õèìèè, òàêîé, êàê îòáåëèâàòåëè, îáåçæèðèâàòåëè , ÷èñòÿùèå ñðåäñòâà; ïðèìåíÿòñÿ äëÿ îáåççàðàæèâàíèÿ è äåçèíôåêöèè âîäû.
Íèòðèò íàòðèÿ (NaNO2) àçîòîñîäåðæàùåå óäîáðåíèå, ïèùåâîé êîíñåðâàíò è óëó÷øèòåëü îêðàñêè Å250. Íèòðèò íàòðèÿ øèðîêî èñïîëüçóåòñÿ â ìåäèöèíå è âåòåðèíàðèè êàê ñîñóäîðàñøèðÿþùåå ñðåäñòâî, áðîíõîëèòè÷åñêîå, ñëàáèòåëüíîå, ñðåäñòâî ïðîòèâ ñïàçìîâ è ïðîòèâîÿäèå ïðè îòðàâëåíèè öèàíèäàìè.  ôîòîãðàôèè íèòðèò íàòðèÿ íàøåë ïðèìåíåíèå êàê ðåàãåíò, ïðîòèâîìîðîçíàÿ äîáàâêà äëÿ áåòîíà, ïðèìåíÿåòñÿ ïðè èçãîòîâëåíèè êàó÷óêà è âçðûâ÷àòûõ âåùåñòâ.
Íèòðàò íàòðèÿ (NaNO3) — ýòî ñîåäèíåíèå íàòðèÿ òàêæå ïîëó÷èëî øèðî÷àéøåå ïðèìåíåíèå: êîíñåðâàíò Å251 (ïðîòèâîìèêðîáíàÿ äîáàâêà), óäîáðåíèå. Òàêæå èñïîëüçóåòñÿ ïðè èçãîòîâëåíèè ðàêåòíîãî òîïëèâà, âõîäèò â ñîñòàâ âçðûâ÷àòûõ âåùåñòâ, à òàêæå â ìåòàëëîîáðàáàòûâàþùåé è ñòåêîëüíîé ïðîìûøëåííîñòè.
Àëüãèíàò íàòðèÿ (NaC 6 H 7 O 6 ) ïðîèçâîäñòâî öåìåíòà, êðàñêè íà âîäíîé îñíîâå, çàãóñòèòåëü â ìîðîæåíîì è äðóãèõ ïðîäóêòàõ ïèòàíèÿ.
Áèôòîðèä íàòðèÿ (KHF 2 ) àíòèñåïòèê, íå ïèùåâîé êîíñåðâàíò, òàêæå èñïîëüçóåòñÿ ïðè ïðîèçâîäñòâå æåñòè è òðàâëåíèè ñòåêëà;
Äèóðàíàò íàòðèÿ, èëè « æåëòûé óðàí » (Na 2 U 2 O 7 ) èñïîëüçóåòñÿ äëÿ ïðîèçâîäñòâà îðàíæåâîé ãëàçóðè äëÿ êåðàìèêè;
Ôòîðñèëèêàò íàòðèÿ (Na 2 SiF 6 ) èñïîëüçóåòñÿ ïðè èçãîòîâëåíèè çóáíûõ ïàñò ñî ôòîðîì, õîçÿéñòâåííîãî ìûëà, òàêæå èñïîëüçóåòñÿ ïðè èçãîòîâëåíèè ñðåäñòâ äëÿ áîðüáû ñ êðûñàìè è íàñåêîìûìè. Êðîìå òîãî ôòîðñèëèêàò íàòðèÿ íàøåë ïðèìåíåíèå â êà÷åñòâå êîíñåðâàíòà äëÿ êîæè è äåðåâà.
Ìåòàáîðàò íàòðèÿ (NaBO 2 ) ãåðáèöèä, ïðèìåíÿåòñÿ äëÿ óíè÷òîæåíèÿ ðàñòèòåëüíîñòè.
Ñòåàðàò íàòðèÿ (NaOOCC 17 H 35 ) èñïîëüçóåòñÿ êàê äîáàâêà â êîñìåòè÷åñêèå ñðåäñòâà è çóáíûå ïàñòû. Ïðèìåíÿåòñÿ â êà÷åñòâå ãèäðîèçîëÿöèè è êàê êîìïîíåíò, ïðåäîòâðàùàþùèé ðàçðóøåíèå ïëàñòèêà.
Ãëèêîëÿò íàòðèÿ öèðêîíèÿ (NaZrH 3 (H 2 COCOO) 3 ) ýòî âåùåñòâî âõîäèò â ñîñòàâ äåçîäîðàíòîâ, ïðîòèâîìèêðîáíûõ ïðåïàðàòîâ, òàêæå ïðèìåíÿåòñÿ ïðè èçãîòîâëåíèè îãíåñòîéêèõ ìàòåðèàëîâ.
Ïàðàïåðèîäàò íàòðèÿ (Na 3 H 2 IO 6 ) — ýòî ñîåäèíåíèå ïîìîãàåò áóìàãå ñîõðàíÿòü ïðî÷íîñòü ïðè íàìîêàíèè.
Ãèäðîôòîðèä íàòðèÿ( NaHF2) àíòèñåïòèê, èñïîëüçóåòñÿ ïðè ïðîèçâîäñòâå ïëàâèêîâîé êèñëîòû, òàêæå íàøåë ïðèìåíåíèå äëÿ òðàâëåíèÿ ñòåêëà.
Âîëüôðàìèò íàòðèÿ (NaWO4) èçãîòîâëåíèå ïèãìåíòîâ.
Ãåêñàìåòàëôîñôàò íàòðèÿ (Na6P6O18) òåêñòèëüíàÿ, êîæåâåííàÿ, íåôòÿíàÿ ïðîìûøëåííîñòü, ñìÿã÷åíèå âîäû.
Äèòèîíèò íàòðèÿ (Na2S2O4) ïðîèçâîäñòâî êðàñèòåëåé
Ñàëèöèëàò íàòðèÿ C7H5NaO3 ôàðìàöåâòèêà.
Ìåòàñèëèêàò íàòðèÿ (Na2SiO3) ïðîèçâîäñòâî áåòîíà, öåìåíòíûõ ðàñòâîðîâ, ñòåêëà.
Ãèäðèä íàòðèÿ (NaH) c ïîìîùüþ ðàñòâîðà NaH â ãèäðîîêñèäå íàòðèÿ ñíèìàþò îêàëèíó ñî ñòàëåé è òóãîïëàâêèõ ìåòàëëîâ.
Áèñóëüôèò íàòðèÿ (NaHSO3) ôîòîãðàôèÿ, áóìàæíàÿ, òåêñòèëüíàÿ, êîæåâåííàÿ èíäóñòðèÿ, î÷èñòêà âîäû.
Ôîñôàò íàòðèÿ (Na3PO4) êîñìåòè÷åñêèå ïðåïàðàòû, çóáíàÿ ïàñòà, ïèùåâàÿ äîáàâêà.
Ñåëåíèò íàòðèÿ ( Na2SeO3) ìèíåðàëüíàÿ äîáàâêà, ôàðìàöåâòèêà, âåòåðèíàðèÿ.
Òèîñóëüôàò íàòðèÿ ôàðìàöåâòè÷åñêàÿ ïðîìûøëåííîñòü
Ñòàííèò íàòðèÿ (Na2SnO2) ñ åãî ïîìîùüþ îòêðûâàþò èîíû êîáàëüòà â ñòàëÿõ, äîáûâàþò ìåòàëëè÷åñêîå ñåðåáðî, áëàãîäàðÿ ñòàííèòó íàòðèÿ âîçìîæíî ïîëíîå âîññòàíîâëåíèå îðãàíè÷åñêèõ ñîåäèíåíèé ðòóòè.
Ìåòàñòàííàò íàòðèÿ Na2[Sn(OH)6] ãàëüâàíèêà, ëóæåíèå àëþìèíèÿ.
Òèîöèàíàò íàòðèÿ ( òðàäèöèîííîå íàçâàíèå -ðîäàíèò íàòðèÿ) (NaSCN) èñïîëüçóåòñÿ â êà÷åñòâå ðåàêòèâà äëÿ ôîòîìåòðè÷åñêîãî îïðåäåëåíèÿ æåëåçà, òàêæå èñïîëüçóåòñÿ â ôîòîãðàôèè è òåêñòèëüíîé ïðîìûøëåííîñòè.
Íàòðèé-áóòàäèåíîâûé êàó÷óê ñàìûé âîñòðåáîâàííûé èç âñåõ êàó÷óêîâ
Àìèä íàòðèÿ (NaNH2) — ó÷àñòâóåò â ñèíòåçå äðóãèõ õèìè÷åñêèõ âåùåñòâ, âêëþ÷àÿ âèòàìèí À.
Àöåòàò íàòðèÿ (C2H3O2Na) ëåãêàÿ, ïèùåâàÿ ïðîìûøëåííîñòü, òàêæå èñïîëüçóåòñÿ â áûòó.
Ïèðîñóëüôèò íàòðèÿ (Na2(SO2SO3)) ïèùåâîé êîíñåðâàíò, òàêæå íàøåë ïðèìåíåíèå â õèìè÷åñêîé è ôàðìàöåâòè÷åñêîé îòðàñëÿõ.
Êðåìíåôòîðèñòûé íàòðèé (Na2SiO6) è Ãåêñàôòîðîñèëèêàò íàòðèÿ (Na2[SiF6] ) íåîáõîäèìû ïðè ïîëó÷åíèè áåðèëëà è ìàðãàíöà, èñïîëüçóåòñÿ ïðè èçãîòîâëåíèè öåìåíòîâ, ñòåêîë, ýìàëåé, çàìàçîê.
Ìåòèëàò íàòðèÿ (CH3NaO) íåîáõîäèì äëÿ ñèíòåçà â ïðè èçãîòîâëåíèè ëåêàðñòâåííûõ ïðåïàðàòîâ è õèìèêàòîâ.
Ïåðåêèñü íàòðèÿ (Na2O2) âåëèêîëåïíûé îòáåëèâàòåë.ü
Ôåíîëÿò íàòðèÿ èñïîëüçóåòñÿ äëÿ äåçèíôåêöèè.
Ôòîðèä íàòðèÿ (NaF)- ïðè èçãîòîâëåíèè çóáíîé ïàñòû, êðîìå òîãî êîìïîíåíò ñîñòàâîâ ôëþñà äëÿ ñâàðêè, ïàéêè ìåòàëëîâ, ýìàëåé, ñòåêîë, êåðàìèêè, âõîäèò â ñîñòàâ ñðåäñòâ äëÿ î÷èñòêè ìåòàëëîâ è ò.ä.
Ðàäèîàêòèâíûå èçîòîïû íàòðèÿ èìåþò êàê ìåäèöèíñêîå, òàê è íå ìåäèöèíñêîå ïðèìåíåíèå (íàïðèìåð, ïðîâåðÿò íåôòåïðîâîäû íà ïðåäìåò óòå÷åê)
Áîëüøèíñòâî ëþäåé íèêîãäà íå âèäåëè ìåòàëëè÷åñêèé íàòðèé (Na). Äà è â âèäå ñâîáîäíîãî ýëåìåíòà â ïðèðîäå îí íèêîãäà íå âñòðå÷àåòñÿ. Îí íàñòîëüêî àêòèâåí, ÷òî îáû÷íî õðàíèòñÿ â æèäêîñòè, ñ êîòîðîé íå ðåàãèðóåò, ÷àùå âñåãî èñïîëüçóþò êåðîñèí. Òåì íå ìåíåå, è â âèäå ñâîáîäíîãî ýëåìåíòà íàòðèé íàøåë áîëüøîå ïðèìåíåíèÿ â ðàçëè÷íûõ îáëàñòÿõ ïðîìûøëåííîñòè. Ýòî è òåïëîîáìåííàÿ ñðåäà â àòîìíûõ ýëåêòðîñòàíöèÿõ, è ïðîèçâîäñòâî äðóãèõ ìåòàëëîâ, âêëþ÷àÿ òèòàí, ïðîèçâîäñòâî àêêóìóëÿòîðîâ, ýëåêòðè÷åñêèõ ïðîâîäîâ, íàòðèåâûõ ëàìï, èñêóññòâåííîãî êàó÷óêà è ïðî÷åå.
Ïîäâîäÿ èòîã âñåìó âûøåñêàçàííîìó, íåîáõîäèìî îòìåòèòü, ÷òî ïåðåîöåíèòü ðîëü òàêîãî õèìè÷åñêîãî ýëåìåíòà, êàê íàòðèé, êðàéíå ñëîæíî. Îäíàêî, âàæíåéøèì èç âñåõ ñîåäèíåíèé íàòðèÿ, ïî ïðàâó ìîæåò ñ÷èòàòüñÿ îáûêíîâåííàÿ ïèùåâàÿ ñîëü. Âåäü èìåííî õëîðèä íàòðèÿ èìååò îãðîìíîå âëèÿíèå íà ðÿä îñíîâíûõ ôóíêöèé ó ðàñòåíèé, æèâîòíûõ è ëþäåé. Èìåííî õëîðèä íàòðèÿ ïðèíèìàåò íåïîñðåäñòâåííîå ó÷àñòèå â âîäíî-ñîëåâîì îáìåíå, îäíîì èç âàæíåéøèõ ïðîöåññîâ, ïðîòåêàþùèõ â îðãàíèçìàõ æèâîòíûõ è ëþäåé.
