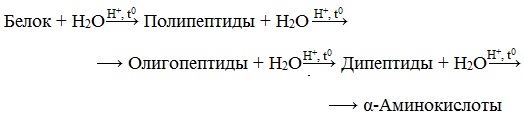Какие свойства у белков

Áåëêè – ïðèðîäíûå ïîëèïåïòèäû ñ îãðîìíîé ìîëåêóëÿðíîé ìàññîé. Îíè âõîäÿò â ñîñòàâ âñåõ æèâûõ îðãàíèçìîâ è âûïîëíÿþò ðàçëè÷íûå áèîëîãè÷åñêèå ôóíêöèè.
Ñòðîåíèå áåëêà.
Ó áåëêîâ ñóùåñòâóåò 4 óðîâíÿ ñòðîåíèÿ:
- ïåðâè÷íàÿ ñòðóêòóðà áåëêà – ëèíåéíàÿ ïîñëåäîâàòåëüíîñòü àìèíîêèñëîò â ïîëèïåïòèäíîé öåïè, ñâåðíóòûõ â ïðîñòðàíñòâå:

- âòîðè÷íàÿ ñòðóêòóðà áåëêà – êîíôîðìàöèÿ ïîëèïåïòèäíîé öåïè, ò.ê. ñêðó÷èâàíèå â ïðîñòðàíñòâå çà ñ÷åò âîäîðîäíûõ ñâÿçåé ìåæäó NH è ÑÎ ãðóïïàìè. Åñòü 2 ñïîñîáà óêëàäêè: α-ñïèðàëü è β— ñòðóêòóðà.
α-ñïèðàëü Íà îäíîì âèòêå óêëàäûâàþòñÿ 4 àìèíîêèñëîòíûõ îñòàòêà, êîòîðûå íàõîäÿòñÿ ñíàðóæè ñïèðàëè. |
β-ñòðóêòóðà. Ïîëèïåïòèäíàÿ öåïü ðàñòÿíóòà, åå ó÷àñòêè ðàñïîëàãàþòñÿ ïàðàëëåëüíû äðóã äðóãó è óäåðæèâàþòñÿ âîäîðîäíûìè ñâÿçÿìè. |
- òðåòè÷íàÿ ñòðóêòóðà áåëêà – ýòî òðåõìåðíîå ïðåäñòàâëåíèå çàêðó÷åííîé α-ñïèðàëü èëè β-ñòðóêòóðû â ïðîñòðàíñòâå:

Ýòà ñòðóêòóðà îáðàçóåòñÿ çà ñ÷åò äèñóëüôèäíûõ ìîñòèêîâ –S-S- ìåæäó öèñòåèíîâûìè îñòàòêàìè.  îáðàçîâàíèè òàêîé ñòðóêòóðû ó÷àñòâóþò ïðîòèâîïîëîæíî çàðÿæåííûå èîíû.
- ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà îáðàçóåòñÿ çà ñ÷åò âçàèìîäåéñòâèÿ ìåæäó ðàçíûìè ïîëèïåïòèäíûìè öåïÿìè:

Ñèíòåç áåëêà.
 îñíîâå ñèíòåçà ëåæèò òâåðäîôàçíûé ìåòîä, â êîòîðîì ïåðâàÿ àìèíîêèñëîòà çàêðåïëÿåòñÿ íà ïîëèìåðíîì íîñèòåëå, à ê íåé ïîñëåäîâàòåëüíî ïîäøèâàþòñÿ íîâûå àìèíîêèñëîòû. Ïîñëå ïîëèìåð îòäåëÿþò îò ïîëèïåïòèäíîé öåïè.
Ôèçè÷åñêèå ñâîéñòâà áåëêà.
Ôèçè÷åñêèå ñâîéñòâà áåëêà îïðåäåëÿþòñÿ ñòðîåíèåì, ïîýòîìó áåëêè äåëÿò íà ãëîáóëÿðíûå (ðàñòâîðèìûå â âîäå) è ôèáðèëëÿðíûå (íåðàñòâîðèìûå â âîäå).
Õèìè÷åñêèå ñâîéñòâà áåëêîâ.
1. Äåíàòóðàöèÿ áåëêà (ðàçðóøåíèå âòîðè÷íîé è òðåòè÷íîé ñòðóêòóðû ñ ñîõðàíåíèåì ïåðâè÷íîé). Ïðèìåð äåíàòóðàöèè – ñâåðòûâàíèå ÿè÷íûõ áåëêîâ ïðè âàðêå ÿèö.
2. Ãèäðîëèç áåëêîâ – íåîáðàòèìîå ðàçðóøåíèå ïåðâè÷íîé ñòðóêòóðû â êèñëîì èëè ùåëî÷íîì ðàñòâîðå ñ îáðàçîâàíèåì àìèíîêèñëîò. Òàê ìîæíî óñòàíîâèòü êîëè÷åñòâåííûé ñîñòàâ áåëêîâ.
3. Êà÷åñòâåííûå ðåàêöèè:
Áèóðåòîâàÿ ðåàêöèÿ – âçàèìîäåéñòâèå ïåïòèäíîé ñâÿçè è ñîëåé ìåäè (II) â ùåëî÷íîì ðàñòâîðå. Ïî îêîí÷àíèþ ðåàêöèè ðàñòâîð îêðàøèâàåòñÿ â ôèîëåòîâûé öâåò.
Êñàíòîïðîòåèíîâàÿ ðåàêöèÿ — ïðè ðåàêöèè ñ àçîòíîé êèñëîòîé íàáëþäàåòñÿ æåëòîå îêðàøèâàíèå.
Áèîëîãè÷åñêîå çíà÷åíèå áåëêà.
1. Áåëêè – ñòðîèòåëüíûé ìàòåðèàë, èç íåãî ïîñòðîåíû ìûøöû, êîñòè, òêàíè.
2. Áåëêè — ðåöåïòîðû. Ïåðåäàþò è âîñïðèíèìàþò ñèãíàë, ïîñòóïàþùèõ îò ñîñåäíèõ êëåòîê èç îêðóæàþùåé ñðåäû.
3. Áåëêè èãðàþò âàæíóþ ðîëü â èììóííîé ñèñòåìå îðãàíèçìà.
4. Áåëêè âûïîëíÿþò òðàíñïîðòíûå ôóíêöèè è ïåðåíîñÿò ìîëåêóëû èëè èîíû â ìåñòî ñèíòåçà èëè íàêîïëåíèÿ. (Ãåìîãëîáèí ïåðåíîñèò êèñëîðîä ê òêàíÿì.)
5. Áåëêè – êàòàëèçàòîðû – ôåðìåíòû. Ýòî î÷åíü ìîùíûå ñåëåêòèâíûå êàòàëèçàòîðû, êîòîðûå óñêîðÿþò ðåàêöèè â ìèëëèîíû ðàç.
Åñòü ðÿä àìèíîêèñëîò, êîòîðûå íå ìîãóò ñèíòåçèðîâàòüñÿ â îðãàíèçìå — íåçàìåíèìûå, èõ ïîëó÷àþò òîëüêî ñ ïèùåé: òèçèí, ôåíèëàëàíèí, ìåòèíèí, âàëèí, ëåéöèí, òðèïòîôàí, èçîëåéöèí, òðåîíèí.
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
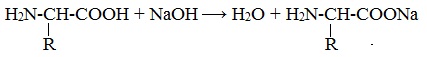
При действии же кислот он выступает в форме катиона:
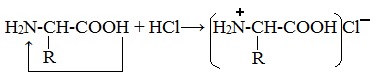
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
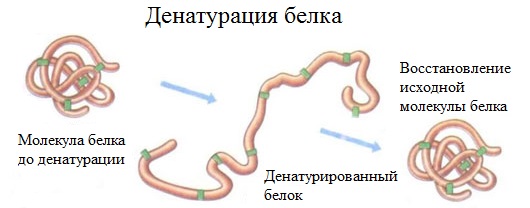
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.

![]()
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: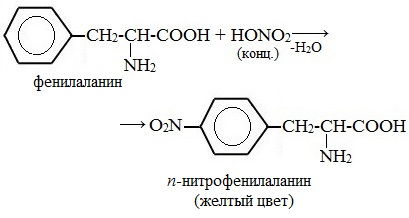
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.

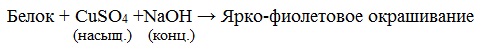
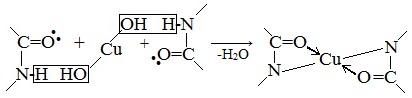
Причина появления окраски – образование комплексных соединений с координационным узлом: 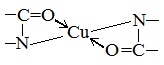
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)

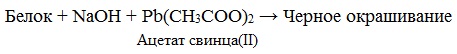
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
Белки — это высокомолекулярные соединения (биополимеры), мономерами которых яв
ляются аминокислоты, соединенные пептидными связями.
Аминокислотой называют органическое соединение, имеющее карбоксильную и амино
группу, а также радикал. В природе встречается около 200 аминокислот, которые
различаются взаимным расположением функциональных групп и радикалами, но только 20 из них входят в состав белков. Такие аминокислоты называют протеиногенными.

Не все протеиногенные аминокислоты могут синтези
роваться в организме человека. Аминокислоты, которые
образуются в организме человека в необходимом коли
честве, называют заменимыми (их насчитывается 12),
а аминокислоты, которые не синтезируются и должны
поступать с пищей, — незаменимыми (8). К незамени
мым аминокислотам относят валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин.

Уровни структурной организации белка.
У белков различают первичную, вторичную,третичную и четвертичную структуры.


Первичная структура белка — это последовательность аминокислот, соединенных пептидной связью. Особенности аминокислотного состава белка обусловливают его
пространственную укладку — возникновение вторичной и третичной структур. Изменение
расположения хотя бы одной аминокислоты в первичной структуре влечет за собой измене
ние более высоких структур, а также свойств белка в целом.
Вторичная структура представляет собой упорядоченную пространственную структуру
белковой молекулы в виде спиралей или складок, поддерживаемых водородными связями, которые возникают между атомами кислорода и водорода. Болееменее длинные
участки со вторичной структурой имеют, например, кератины волос и ногтей, фиброин шелка.
Третичная структура белка является
формой пространственной укладки поли
пептидной цепи в виде глобулы (клубка),
поддерживаемой гидрофобными, водород
ными, дисульфидными (S—S) и ионными
связями . Она характерна для
большинства белков организма, напри
мер, миоглобина мышц.
Четвертичная структура — это про
странственная организация нескольких
глобул, которая поддерживается слабы
ми взаимодействиями (гидрофобными,
ионными, водородными и др.).
Четвертичная структура характер
на для гемоглобина и хлорофилла.
По форме молекулы различают фи
бриллярные и глобулярные белки. Первые
из них вытянуты, как, например, колла
ген соединительной ткани или кератины
волос и ногтей. Глобулярные же белки
имеют форму глобулы, как миоглобин
мышц.

Свойства белков.
Одни белки хорошо растворимы в воде, а другие растворяются толь
ко в растворах солей, щелочей, кислот или органических растворителях. Структура молекулы белка и его функциональная активность зависят от условий окружающей среды. Утрата белковой молекулой структуры, вплоть до первичной, называется денатурацией. Денатурация происходит вследствие изменения температуры, рН, атмосферного давления, под действием кислот,
щелочей, солей тяжелых металлов, органических растворителей и др. Обратный процесс восстановления структуры называется ренатурацией, однако он не всегда возможен. Полное разрушение белковой молекулы называется деструкцией

Функции белков:
Белки выполняют в клетке ряд функций: пластическую (строительную), каталитическую (ферментативную), энергетическую, сигнальную (рецепторную), сократительную (двигательную), транспортную, защитную, регуляторную и запасающую.Строительная функция белков связана с их наличи
ем в клеточных мембранах и структурных компонентах клетки. Энергетическая обусловлена тем, что при
расщеплении 1 г белка высвобождается 17,2 кДж энер
гии. Белки — рецепторы мембран принимают участие
в восприятии сигналов окружающей среды и их пе
редаче в клетке, а также в межклеточном узнавании.
Без белков невозможно движение клеток и организмов
в целом. Они составляют основу жгутиков и ресничек,
а также обеспечивают сокращение мышц и перемеще
ние внутриклеточных компонентов. В крови человека
и многих животных белок гемоглобин переносит кисло
род и часть углекислого газа, другие белки транспортируют ионы и электроны. Защитная роль белков связана
с иммунитетом: белок интерферон способен уничтожать
многие вирусы, а белкиантитела участвуют в иммун
ных реакциях. Среди белков и пептидов есть регулято
ры, например, гормон поджелудочной железы, инсулин,
регулирующий концентрацию глюкозы в крови. У неко
торых организмов белки могут откладываться в запас,
как у бобовых в семенах, или у птиц и пресмыкающихся в яйцах.

ТЕСТ ДОМАШНИЙ


Белки — органические вещества с большой молекулярной массой, основными компонентами которых являются альфа аминокислоты, связанные между собой цепочкой пептидных связей. Выявлено множество свойств и функций белков, в зависимости от среды обитания и самих живых организмов, в которых они обитают. Физико-химические свойства белков также различны, что объясняется разным составом аминокислот.
Особенности белков и их химические свойства
Особенно интересны химические свойства белков, так как некоторые из них совершенно противоположны друг-другу. Одни белки легко растворяются в воде, другие же, напротив, не растворяются вообще. Существуют белки, на которые не действуют разнообразные химические агенты, соответственно есть и такие, которым достаточно самого малого воздействия, вроде, лёгкого прикосновения или небольшого освещения, чтобы измениться. Некоторые разновидности в облике нитей, длинною в сотню нанометров, а встречаются напоминающие шар, имеющий в диаметре около шести нанометров. Однако, вне зависимости от своих размеров и форм свойства белка и его функции остаются неизменными. Белок кератина, например, имеет твёрдость стали и способствует образованию защитных механизмов у животных, таких, как копыта, когти, рога, панцирь, волосяной покров и перья. В мышечный состав включены состоящие из нитевидных молекул белки, обеспечивающие двигательную активность клеток благодаря своей эластичности и способности удлиняться или сужаться. Для перемещения веществ по организму необходимы представители с небольшими, круглыми молекулами. Быстрорастворимые, с легко изменяющейся структурой, белки принимают и передают в клетку сигналы, которые получают из окружающей среды.

Как происходит денатурации белка
Для того чтобы свойства и функции белка изменились, необходима денатурация. Что же это такое? Денатурация – это изменение изначальной структуры белка. Изменить ее можно, воздействуя на белок физическими или химическими факторами, вроде больших температур, механических воздействий или при помощи некоторых химических веществ. Наглядным примером денатурации является сваренное яйцо: из жидкого оно превращается в плотное. Белок перестаёт быть растворимыми и облегчает пищеварительными ферментам своё воздействие на него.
Однако, этот процесс обратим в том случае, если конструкция белка устанавливается особым порядком последовательности аминокарбоновых кислот в полипептидной цепи и его составом. В этом случае уже развёрнутая полипептидная цепь способна в произвольном порядке закрутиться спиралью и уложиться в единую. Эта способность основывается на системе раздражимости, свойственной всему живому.

Белки: функции и свойства
Первостепенная задача белков – строительная. Именно из них составлены мембраны клеток и ее органоидов, стенки системы кровоснабжения организма, сухожилий, хрящей и т.д.
Второй, но не менее важной задачей, является каталитическая. Ферменты являются катализаторами клетки, их активность очень высока. Благодаря им, химические реакции внутри организма ускоряются в разы. Белки являются ферментами по своему химическому составу. Именно они катализируют самые мизерные молекулы, используя для ускорения лишь активный центр белка. Такая реакция возможна лишь при близком нахождении молекул и геометрически верных пропорций конформаций вещества и активного центра белка. При процессе денатурации ускорение активности фермента пропадает по причине того, что конструкция активного центра расстраивается. Для любой химической реакции предусмотрен организмом определённый фермент — катализатор.

Следующие функции белка — сигнальная и защитная. Сигнальная функция отвечает за то, чтобы молекулы белков, входящие во внешнюю мембрану клетки и имеющие способность менять свою структуру под воздействием внешних раздражителей, принимали сигналы из окружающей среды и передавали в клетку команды. Защитная — за обезвреживание инородных клеток и веществ, вводимых в организм.

Помимо этого, белки обладают двигательной и транспортной функциями. За двигательные функции отвечают сократительные ферменты, демонстрирующие жизненную активность организма. Любое движение, от мерцания ресничек или движения жгутиков у простейших, вплоть до сокращения мышц у животных или человека, осуществляется при помощи актина и миозина. Транспортная функция отвечает за присоединение разнообразных веществ и перемещение их из разных клеточных мест в другие. К примеру, гемоглобин – белок, содержащийся в крови, отвечает за присоединение кислорода и доставку его ко всем тканям и органам организма.
И последняя функция – энергетическая. В клетке происходит распад белков на аминокислоты, одна часть которых обеспечивает синтез белков, а другая тщательно расщепляется для высвобождения энергии.
Читайте также:
Лучшее на сайте
Дата публикации: 
29.11.2015
©
Алина