Какие свойства растворов называются коллигативными приведите примеры
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 июля 2017;
проверки требуют 4 правки.
Коллигативные свойства растворов — это свойства растворов, обусловленные только самопроизвольным движением молекул, то есть они определяются не химическим составом, а числом кинетических единиц — молекул в единице объёма или массы[1]. К таким коллигативным свойствам относятся:
- Понижение упругости растворителя над раствором,
- Повышение температуры кипения растворов (в сравнении с чистыми растворителями),
- Понижение температуры замерзания растворов (в сравнении с чистыми растворителями),
- Возникновение осмотического давления,
- Диффузия.
Законы Рауля[править | править код]
Первый закон Рауля[править | править код]
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя.
В 1886 (1887) году Ф. М. Рауль сформулировал закон:
Давление насыщенного пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
Для растворов электролитов используют несколько другую форму уравнения, позволяющую добавить в неё изотонический коэффициент:
Δp = i · p0 · χв-ва, где
Δp — собственно изменение давления по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе.
Второй закон Рауля[править | править код]
Также Рауль экспериментально доказал, что
повышение температуры кипения раствора по сравнению с температурой кипения растворителя равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва, где
Kэб/кр — соответственно эбуллиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе.
Осмотическое давление[править | править код]
Рассмотрим ситуацию, при которой частично проницаемая мембрана (то есть, такая, через которую могут проходить лишь мелкие объекты, например, молекулы растворителя, но не крупные — например, молекулы растворённого вещества) разделяет чистый растворитель и раствор (или два раствора с разными концентрациями). Тогда молекулы растворителя находятся практически в равных физических условиях по обе стороны мембраны, однако в более насыщенном растворе некоего вещества их концентрация, разумеется, меньше, чем в более разбавленном (в котором меньше места в растворе занимают молекулы растворённого вещества). Следовательно, со стороны менее насыщенного раствора через мембрану диффундирует большее число молекул, чем с противоположной стороны. А это значит, что растворитель попросту переходит из менее насыщенного раствора в более насыщенный, разбавляя его (выравнивая концентрации обоих растворов) и создавая давление на мембрану. Процесс этот (он называется осмосом) можно прекратить, оказав определённое давление на более насыщенный раствор (например, при помощи поршня) —— это давление и называется осмотическим давлением.
Растворы с одинаковым осмотическим давлением называются изотоническими.
Определить осмотическое давление раствора можно по формуле, полученной в 1886 году Я. Х. Вант-Гоффом:
π = CMв-ва · R · T, где
CMв-ва — молярная концентрация раствора, выраженная в , а не в , как обычно;
R — универсальная газовая постоянная;
T — термодинамическая температура системы.
См. также[править | править код]
- Осмос
Примечания[править | править код]
- ↑ Д.А.Фридрихсберг. Курс коллоидной химии. — Ленинград «Химия», 1984. — С. 368.
Литература[править | править код]
- Ершов Ю.А. Общая химия.Биофизическая химия.Химия биогенных элементов. — Издание восьмое,стериотипное. — Москва: Высшая школа, 2010. — 559 с.
После изучения этой темы вы должны:
— иметь представления о следующих понятиях и явлениях:
— осмос, осмотическое давление (закон Вант-Гоффа), его роль.
— закон Рауля о давлении паров растворителя над раствором и изменении температур кипения и замерзания растворов (следствия закона Рауля).
Коллигативные свойства – это свойства, которые не зависят от природы частиц растворенного вещества, а зависят только от концентрации частиц в растворе.
Коллигативными свойствами разбавленных растворов являются:
— скорость диффузии
— осмотическое давление (Закон Вант-Гоффа)
— давление насыщенного пара растворителя над раствором (Закон Рауля)
— температура кипения раствора (1следствие из закона Рауля)
— температура кристаллизации раствора (2 следствие из закона Рауля)
Свойства неэлектролитов
Осмосом называется самопроизвольное перемещение молекул растворителя через полупроницаемую мембрану из раствора меньшей концентрации в раствор большей концентрации. В результате протекания осмоса возникает осмотическое давление раствора. Гипертоническим раствором называют тот раствор, у которого осмотическое давление больше. Гипотоническим раствором – раствор с меньшим осмотическим давлением. Изотоничные растворы – это растворы с одинаковой величиной осмотического давления.
Растительная клетка (С >) (внутриклеточный раствор)
Внешняя среда (С <) (межклеточный раствор)
Н2О Н2О
Вант-Гофф, изучая зависимость осмотического давления от внешних факторов установил, что оно не зависит от природы растворенного вещества, а зависит только от числа частиц в растворе и от температуры:
Росм = СмRT, где Росм [кПа], T [K] — абсолютная температура, R = 8,32 кДж/моль — универсальная газовая постоянная, См — молярная концентрация раствора [моль/л].
Осмотическое давление раствора, содержащего несколько веществ, равно сумме осмотических давлений, вызываемых каждым из них.
Давление насыщенного пара растворителя над раствором (Закон Рауля):
Относительное понижение давления насыщенного пара над раствором прямо пропорционально мольной доле растворенного вещества: где — давление насыщенного пара над чистым растворителем; РА-давление насыщенного пара растворителя над раствором; NB — мольная доля растворенного вещества: , где na, nb – число молей растворителя (а) и растворенного вещества (b).
Набольшее практическое значение получили I, II следствие закона Рауля.
I следствие закона Рауля: Повышение температуры кипения раствора прямо пропорционально молярной концентрации растворенного вещества: Dtкип = Kэб.Сm , где Dtкип = t кип р-ра – t кип н2o, 0С ; Kэб – эбулиоскопическая константа растворителя (Kэб н2о ); Сm- моляльная концентрация растворенного вещества, моль/1000г растворителя.
II следствие закона Рауля: Понижение температуры замерзания раствора прямо пропорционально молярной концентрации растворенного вещества: Dtзам = Kкр.Сm , где Dt = t зам.н2о – t зам р-ра, 0С; Kкр — криоскопическая константа растворителя (Ккр н2о =1,86); Сm- моляльная концентрация растворенного вещества, моль/1000г растворителя.
| Росм = См R T Dtкип = Кэб Cm Dtзам = Ккр Cm | ß | Коллигативные свойства для молекулярных растворов |
Примечание: см. приложение 7 – «Криоскопические константы некоторых растворителей», приложение 8 – «Эбулиоскопические константы некоторых растворителей».
Эти уравнения справедливы только для растворов, в которых отсутствует взаимодействие частиц, т.е. для идеальных растворов. В реальных растворах имеют место межмолекулярные взаимодействия между молекулами вещества и растворителя, которые могут приводить либо к процессам диссоциации, либо к процессам ассоциации молекул. Диссоциация молекул вещества в водном растворе характерна для сильных электролитов. В результате диссоциации число частиц увеличивается.
Доля (i) образовавшихся частиц определяется как отношение общего числа частиц к первоначальному числу молекул. Она зависит от степени диссоциации электролита и от числа частиц, на которые распадается молекула:
i = (n -1)a + 1, i – получил название изотонический коэффициент, n – число частиц (ионов), на которые распадается молекула, a – степень диссоциации (в долях).
| Росм = iСМ R Т Dt кип = i Кэб Сm Dtзам = i Ккр Сm | ß | Коллигативные свойства для растворов электролитов |
Примеры расчетов температур кипения, замерзания, осмотического давления растворов различных концентраций.
Пример 1. Вычислить температуру замерзания, кипения раствора этилового спирта с процентной концентрацией (w), равной 40 %.
Решение: Вычислим температуру замерзания раствора исходя из II следствия закона Рауля: Dtзам = Kкр.Сm, однако для решения необходимо перейти от одного вида концентрации к другому:
w [m в-ва, г 100г р-ра] ® Сm[ n молей 1000 г р-ля ]
1. Перейдем от массы вещ-ва (m) к молям (n) через пропорцию:
1 моль С2Н5ОН содержит ——- 46 г
х моль //——//——-//——-//——40 г
или по формуле х(n) = = моль/100р-ра,
где m(с2н5он) = 40г, M(с2н5он) = 46г/моль
2. Перейдем от массы раствора к массе растворителя:
m р-ля = m р-ра — m в-ва = 100 – 40 = 60г р-ля
2. Через пропорцию выразим Сm :
0,87 молей С2Н5ОН содержит в 60 г растворителя
х (Сm) -//——//——//——//——/- 1000 г
х (Сm) = = 14,5 молей/1000г р-ля
4. По формуле Dtзам = Kкр.Сm найдем Dt: Dt = 1,86.14,5 = 26,97 0C
5. Dt = tзам н2о – tзамр-ра Þ tзам р-ра = tзам н2о – Dt = 0 — 26,97 = -26,97 0C — температура замерзания 40 % раствора этилового спирта.
Вычислим температуру кипения раствора исходя из I следствия закона Рауля: Dtкип = Kэб. Сm, Сm = 14,5 моль/1000р-ля (см. выше)
Из формулы найдем Dt: Dt = 0,516 . 14,5 = 7,48 0C
Dt = tкипр-ра – tкип н2о Þ tкип р-ра = tкип н2о + Dtкип = 100 + 7,48 = 107,48 0C- температура кипения 40% раствора этилового спирта.
Пример 2. Вычислить концентрацию физиологического раствора (NaCl) изотоничного с осмотическим давлением крови равное » 800 Кпа. Степень диссоциации NaCl принять за 90%.
Решение: Для растворов электролитов Росм(NaCl ) = i·См·R·T Þ
См = (1)
Условие изотоничности означает, что Росм(NaCl ) = Росм крови = 800 кПа,
i = (n-1)·a + 1= (2 — 1) ·0,9 = 1,9
NaCl Û Na++Cl-, где n = 2, a = 0,9
Подставим найденные значения в формулу (1) См = 0,17 моль/л – концентрация хлорида натрия, которая создает осмотическое давление 800 кПа.
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К их числу относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давление паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу. Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль
p = p0 · nр-ля/(nв-ва + nр-ля), где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
(p – p)/p = χв-ва
(p – p)/p = nв-ва/(nв-ва + nр-ля)
При этом принимаем, что χв-ва + χр-ль= 1
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
p – p = Δр
Δp = i · p0 · χв-ва, где
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе. То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
i = 1+α(n—1), где
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации)
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления. При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя. Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как II закон Рауля:
ΔTкип = E· mв-ва,
ΔTкрист = K·mв-ва, где
E—эбулиоскопическая константа,
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
ΔTкип = i·E·mв-ва
ΔTкрист = i·К·mв-ва
Осмотическое давление раствора
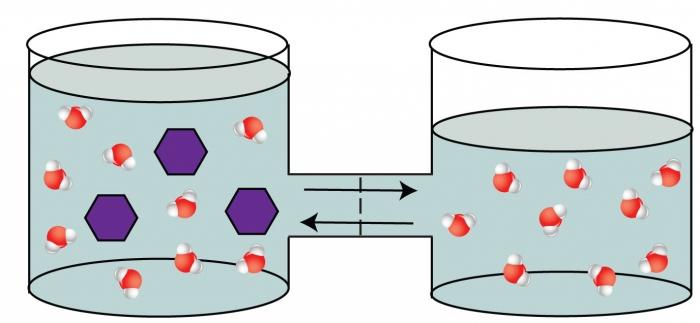
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида. Так, перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
 ОСМОС
ОСМОС
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию. Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением. Осмотическое давление и концентрацию раствора позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
π = C·R·T,
где C — молярная концентрация раствора, моль/м3,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
π·V = m·R·T /M
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
π` = i·C·R·T ,
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими. Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Растворы — это однородные системы, которые содержат две и более составляющих, а также продукты, которые являются результатом взаимодействия этих составляющих. Они могут находиться в твердом, жидком или газообразном состоянии. Рассмотрим жидкое агрегатное состояние растворов. В состав их входят растворитель и вещество, растворенное в нем (последнего меньше).
Коллигативные свойства растворов – это такие их характеристики, которые находятся в прямой зависимости только от растворителя и концентрированности раствора. Они еще называются коллективными или общими. Коллигативные свойства растворов проявляются в смесях, в которых нет взаимодействия химической природы между составляющими их компонентами. К тому же силы взаимного действия между частицами сольвента и частицами сольвента и растворенного в нем вещества равны в идеальных растворах.
Коллигативные свойства растворов:
1) Давление пара более низкое над раствором, чем над растворителем.
2) Кристаллизация раствора идет при температуре ниже температуры кристализации сольвента в чистом виде.
3) Кипение раствора происходит при более высокой температуре, чем кипение самого растворителя.
4) Явление осмоса.

Рассмотрим коллигативные свойства в отдельности.
Равновесие на границе фаз в закрытой системе: жидкость – пар характеризуется давлением насыщенных паров. Так как в растворе часть поверхностного слоя заполнена молекулами растворенного вещества, то равновесие будет достигаться при меньшем значении давления пара.
Второе коллигативное свойство – снижение температуры кристализации раствора по сравнению с растворителем – связано с тем, что частицы растворенного вещества мешают в построении кристаллов и тем самым препятствуют кристаллизации при снижении температуры.
Температура кипения смеси выше, чем сольвента в чистом виде, в связи с тем, что равенство атмосферного давления и давления насыщенного пара достигается при большем нагреве, так как часть молекул растворителя связана с частицами растворенного вещества.

Четвертое коллигативное свойство растворов – явление осмоса.
Явление осмоса – это способность сольвента мигрировать через перегородку, которая является проницаемой для одних частиц (молекулы растворителя) и непроницаемой для других (молекулы вещества растворенного). Эта перегородка отделяет раствор с большим содержанием растворенного вещества от менее концентрированного раствора. Примером такой полупроницаемой перегородки может служить мембрана живой клетки, бычий пузырь и др. Явление осмоса обусловлено выравниванием концентраций по обе стороны, разделенные мембраной, что является термодинамически более выгодным для системы. Вследствие перемещения растворителя в более концентрированный раствор в этой части сосуда наблюдается повышение давления. Это избыточное давление получило название осмотическое.
Коллигативные свойства растворов неэлектролитов математически могут быть представлены уравнениями:
∆ Ткип.= Екип∙См;
∆ Ткр. = Кзам∙См;
π = CRT.
Коллигативные свойства в численном выражении различаются для растворов электролитов и растворов неэлектролитов. Для первых они несколько больше. Это связано с тем, что в них происходит электролитическая диссоциация, и количество частиц значительно увеличивается.
Коллигативные свойства растворов находят широкое применение в быту и на производстве, так, например, явление осмоса используется для получения чистой воды. В живых организмах многие системы также построены на коллигативных свойствах растворов (например, рост клеток растений).
