Какие свойства проявляют оксиды и гидроксиды металлов

Тема: Оксиды и гидроксиды металлов
Обучающая цель: обобщить и систематизировать материал о важнейших оксидах и гидроксидах металлов.
Развивающая цель:развитие внимания, мышления, логики, умения анализировать и делать выводы.
Воспитательная цель: воспитывать интерес к химии.
Принципы обучения: научность, связь теории с практикой, доступность, индивидуальный подход к учащемуся, активизация учебного процесса.
Методыопрос, рассказ, беседа.
Тип урока: Изучение нового материала
Средства обучения: доска, таблицы.
Ход урока
І. Организация работы группы (оглашение темы, цели, плана работы на уроке, заполнение журнала).
ІІ. Проверка домашнего задания.
Опрос по предыдущей теме.
ІІІ. Актуализация опорных знаний.
Тест
Вариант II
1. Металлический элемент:
a) S; б) Ва; в) Al.
1. Переходный элемент:
a) Zn; б) Р; в) Na.
2. Металл, способный вытеснить водород:
из воды:
а) Сu; б) Li; в) Рb.
из раствора кислоты:
а) Са; б) Ag; в) Hg.
3. Из раствора соли сульфата меди (II)
медь могут вытеснить:
медь не вытесняют:
a) Zn; б) Са; в) Fe; г) Na; д) Ag.
4. Растворится ли образец смеси металлов
Al, Мn, Сu в растворе:
a) HCl; б) КОН.
Fe, Ag, Zn в растворе:
a) H2SO4; б) КОН.
Составить уравнения реакций.
Ответы на вопросы теста
Вариант II
1) «б»;
2) «б»;
3) «а», «в»;
4) а) в НСl;
![]()

1) «а»;
2) «а»;
3) «б», «г», «д»;
4) a) ![]()
![]()
![]()
ІV. Изучение нового материала.
1. Оксиды, образованные металлами, особенности их свойств в зависимости от С.О. элемента и радиуса иона; изменение свойств оксидов элементов в периодах и в группах, главных подгруппах.
2. Гидроксиды, образованные оксидами металлов; изменение характера гидроксида в зависимости от С.О. элемента и радиуса его иона.
3. Характер оксидов и гидроксидов, образованных металлами побочных подгрупп. ПСХЭ длиннопериодная и укороченная.
Все металлы образуют солеобразующие оксиды. Однако одни оксиды проявляют свойства основных оксидов, а другие проявляют кислотно-основные, то есть амфотерные свойства. От чего это зависит? Следует знать следующее — металл, проявляющий С.О. +1, +2 образует оксиды основного характера, т. к. это типичные металлы, которые расположены в I и II группах, главных подгруппах.
Пример: 1 группа, главная подгруппа представлена элементами Li, Na, К, Rb, Cs, Fe. К концу группы главной подгруппы у элементов возрастает атомный радиус. При отдаче электрона с внешнего уровня образуются катионы. С.О. у всех элементов к концу группы не изменяется, а вот характер оксидов — основной, будет усиливаться,
![]()
Усиливается основной характер
![]()
Возрастает радиус нового элемента
Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов III периода, то следует отметить, что в атомах этих элементов количество энергетических уровней одинаково, однако изменяется С.О. К концу периода она возрастает, что вызывает уменьшение радиуса иона. Вследствие чего характер оксида изменяется от основного через амфотерный к кислотному.
![]()
С.О. возрастает
![]()
Радиус иона уменьшается, характер оксида изменяется от основного к амфотерному
Оксидам металлов соответствуют гидроксиды. Если С.О. металлов +1, +2, +3, +4, то они образуют оксиды: ![]() и гидроксиды:
и гидроксиды: ![]()
Характер гидроксида зависит также от С.О. элемента и радиуса иона. Чем больше С.О., тем меньше радиус иона, характер гидроксида в большей степени кислотно-основной, то есть проявляет амфотерность:
в периодах:
Пример: III период.
Гидроксиды: ![]()
Ослабление свойства основания, усиление кислотного свойства
![]()
Возрастает С.О.: уменьшается радиус иона; щелочь, основание, амфотерное основание.
в группах, главных подгруппах:
Пример: I группа, главная подгруппа.
![]()
С.О. не изменяется
![]()
Возрастает радиус иона, усиливаются свойства гидроксидов как оснований
Переходные элементы, расположенные в малых периодах — это Ве (II период), Аl (IIIпериод), образуют оксиды BeO, Аl2O3 и гидроксиды Ве(ОН)2 и Аl(ОН)3 — проявляющие амфотерные кислотно-основные свойства. Что это означает?
Эксперимент
Al(OH)3: а) получение, б) кислотно-основные свойства.
Основные свойства: взаимодействие с кислотами, оксидами и гидроксидами.

Кислотные свойства: взаимодействие с щелочами и оксидов, и гидроксидов.

и если раствор щелочи, то образуется комплекс
![]()
Итак, с увеличением С.О. металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основного к кислотно-основному, а далее проявляют кислотный характер.
У элементов побочных подгрупп изменение С.О. можно рассмотреть на примере одного металла.
Пример: металл хром может проявлять С.О. +2, +3, +6.
![]() — основной оксид, гидроксид Сr(ОН)2 — основание;
— основной оксид, гидроксид Сr(ОН)2 — основание;
![]() — амфотерный оксид, гидроксид Сr(ОН)3 — амфотерное основание;
— амфотерный оксид, гидроксид Сr(ОН)3 — амфотерное основание;
![]() — кислотный оксид, гидроксид Н2СrO4, Н2Сr2O7 — кислота.
— кислотный оксид, гидроксид Н2СrO4, Н2Сr2O7 — кислота.
Нам известно, что С.О. максимальная определяется по номеру группы. Элемент хром расположен в VI группе, побочной подгруппе. Элемент сера также расположен в VI группе, только главной подгруппе. В высшей степени окисления они образуют кислотные оксиды ![]() которым соответствуют кислоты Н2СrO4 и H2SO4. Знание такого сходства многих элементов позволило Д. И. Менделееву построить укороченную таблицу химических элементов, где в отличие от длиннопериодной кроме групп появились подгруппы главная и побочная. Все элементы одной группы проявляют максимальную валентность, С.О. соответственно равна номеру группы.
которым соответствуют кислоты Н2СrO4 и H2SO4. Знание такого сходства многих элементов позволило Д. И. Менделееву построить укороченную таблицу химических элементов, где в отличие от длиннопериодной кроме групп появились подгруппы главная и побочная. Все элементы одной группы проявляют максимальную валентность, С.О. соответственно равна номеру группы.
Вернемся к примеру с хромом.
![]() — оксиды
— оксиды
![]() — гидроксиды
— гидроксиды
1) Что происходит со С.О.?
Ответ: С.О. возрастает.
2) Как вы думаете, а радиус иона как изменяется?
Ответ: радиус иона хрома с увеличением С.О. уменьшается.
3) Как эти изменения сказываются на свойствах соединения?
Ответ: происходит изменение свойств оксидов и гидроксидов от основного, через амфотерный к кислотным.
V. Закрепление изученного на уроке.
Составить формулу оксида и гидроксида хрома (III). Уравнениями реакций подтвердить их амфотерность.
Ответ: Сr2O3 — оксид хрома (II).
![]() — основной оксид взаимодействия с кислотой.
— основной оксид взаимодействия с кислотой.
![]() — кислотный оксид взаимодействия с щелочью.
— кислотный оксид взаимодействия с щелочью.
![]() — гидроксил хрома (III).
— гидроксил хрома (III).
![]() — осадок исчезает.
— осадок исчезает.
Гидроксид хрома — основание, взаимодействует с кислотой.
![]() — осадок исчезает.
— осадок исчезает.
Гидроксид хрома проявляет кислотные свойства, т. к. взаимодействует с растворами щелочи.
VI. Подведение итогов урока.
Объяснение домашнего задания, оценивание деятельности учащихся.
VII. Домашнее задание.
Выучить конспект.
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
![]() Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):![]() Основные оксиды реагируют с кислотными оксидами с образованием солей:
Основные оксиды реагируют с кислотными оксидами с образованием солей:![]() Аналогично реагируют и с кислотами, но с выделением воды:
Аналогично реагируют и с кислотами, но с выделением воды:![]() Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:![]()
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:![]() Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:![]() Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:![]() Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:![]() Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:![]()
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: ![]() И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом:  При обжиге или горении различных бинарных соединений:
При обжиге или горении различных бинарных соединений:![]() Термическое разложение солей, кислот и оснований :
Термическое разложение солей, кислот и оснований : Взаимодействие некоторых металлов с водой:
Взаимодействие некоторых металлов с водой:![]()
Применение оксидов
 Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
 Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода. Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
Получение
Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2 + CI2
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.

Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый

Фенолфталеин придаёт раствору щёлочи малиновую окраску
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + H2SO4 → K2SO4 + 2H2O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
нерастворимое
Взаимодействие с кислотными оксидами:
2KOH + SO3 → K2SO4 + H2O
Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + H2O,
NaOH + AI(OH)3 → NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 → CaO + H2O,
Cu(OH)2 → CuO + H2O.
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
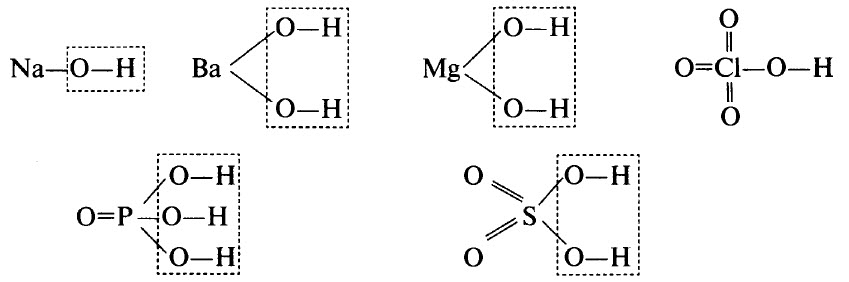
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
