Какие свойства проявляют бинарные соединения
Бинарные соединения — это вещества, которые образованы двумя различными химическими элементами. Этот термин применяют при обозначении качественного и количественного состава неорганических соединений.
Бинарные химические соединения считаются важным объектом в изучении природы веществ. При их описании используют следующие понятия: поляризация связи, степень окисления, валентность. Данные химические термины позволяют понять суть образования химической связи, особенности строения неорганических веществ.
Рассмотрим основные классы бинарных соединений, особенности их химического строения и свойства, некоторые области их промышленного применения.

Оксиды
Данный класс неорганических веществ является самым распространенным в природе. Среди известных представителей этой группы соединений выделим:
- оксид кремния (речной песок);
- оксид водорода (вода);
- углекислый газ;
- глина (оксид алюминия);
- железняки (оксиды железа).
Такие бинарные соединения — это сложные вещества, в составе которых обязательно присутствует кислород, проявляющий степень окисления -2.
Агрегатное состояние оксидов
Соединения меди, кальция, железа являются кристаллическими твердыми веществами. Такое же агрегатное состояние имеют оксиды некоторых неметаллов, например шестивалентной серы, пятивалентного фосфора, кремния. Жидкостью при нормальных условиях является вода. Подавляющее большинство кислородных соединений неметаллов являются газами.
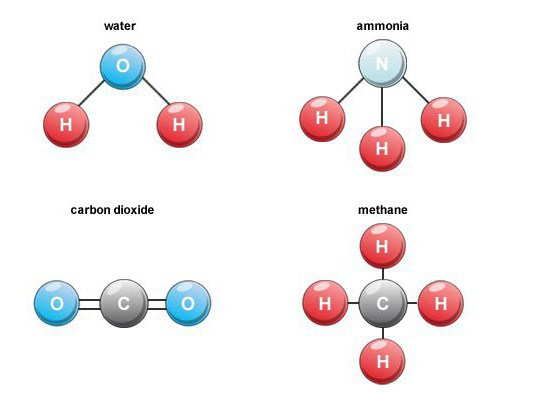
Особенности образования
Многие бинарные кислородные соединения образуются в природе. Например, при сгорании топлива, дыхании, гниении органических веществ формируется углекислый газ (оксид углерода 4). В воздухе его объемное содержание составляет около 0,03 процентов.
Подобные бинарные соединения — это продукты деятельности вулканов, а также составная часть минеральной воды. Углекислый газ не поддерживает горения, поэтому данное химическое соединение применяется для тушения пожаров.
Летучие водородные соединения
Такие бинарные соединения — это важная группа веществ, в составе которых присутствует водород. Среди представителей, имеющих промышленное значение, отметим метан, воду, сероводород, аммиак, а также галогеноводороды.
Часть летучих водородных соединений присутствует в почвенных водах, живых организмах, поэтому можно вести речь об их геохимической и биохимической роли.
Чтобы составлять бинарные соединения такого вида, на первое место ставят водород, имеющий валентность. В качестве второго элемента выступает неметалл, имеющий отрицательную степень окисления.
Для расстановки индексов в бинарном соединении между валентностями определяется наименьшее общее кратное. Количество атомов каждого элемента определяют путем деления его на валентности каждого элемента, входящего в состав соединения.
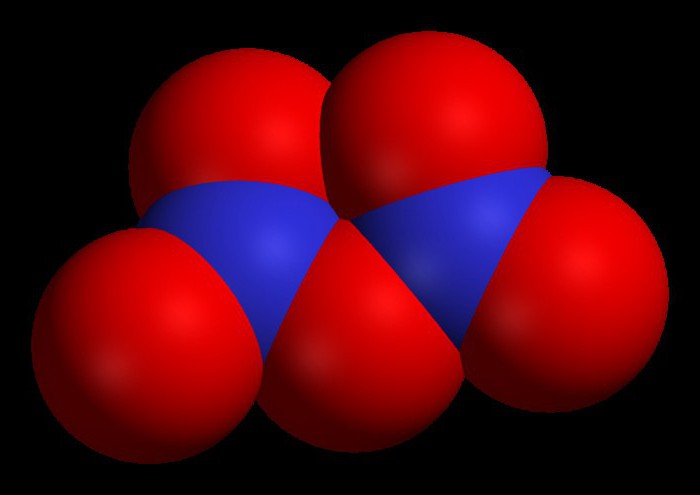
Хлороводород
Рассмотрим формулы бинарных соединений: хлороводорода и аммиака. Именно эти вещества имеют значение для современной химической промышленности. HCl при нормальных условиях является газообразным соединением, хорошо растворимым в воде. После растворения газообразного хлороводорода образуется соляная кислота, используемая во многих химических процессах и производственных цепочках.
Это бинарное соединение содержится в желудочном соке человека и животных, является барьером для болезнетворных микробов, проникающих с пищей в желудок.
Среди основных областей применения соляной кислоты выделим получение хлоридов, синтез хлорсодержащих продуктов, травление металлов, очистку труб от оксидов и карбонатов, кожевенное производство.
Аммиак, имеющий формулу NH3, является бесцветным газом, обладающим специфическим резким запахом. Его неограниченная растворимость в воде позволяет получать нашатырный спирт, востребованный в медицине. В природе данное бинарное соединение образуется в процессе гниения органических продуктов, в составе которых присутствует азот.

Классификация оксидов
Кислородсодержащее бинарное соединение металла, имеющего валентность 1 или 2, является основным оксидом. Например, к этой группе относят оксиды щелочных и щелочноземельных металлов.
Оксиды неметаллов, а также металлов с валентностью больше 4, являются кислотными соединениями.
В зависимости от химических свойств представителей данного класса делят на солеобразующие и несолеобразующие группы.
Среди типичных представителей второй группы отметим угарный газ (CO), оксид азота 1 (NO).
Формирование систематических названий соединений
Среди заданий, предлагаемых выпускникам, сдающим государственный экзамен по химии, есть и такое: «Составьте молекулярные формулы возможных бинарных кислородных соединений серы (азота, фосфора)». Для того чтобы справиться с поставленной задачей, необходимо иметь представление не только об алгоритме, но и об особенностях номенклатуры данного класса неорганических веществ.
При формировании наименования бинарного соединения, первоначально указывают тот элемент, который в формуле располагается справа, добавляя суффикс «ид». Далее указывают название первого элемента. Для ковалентных соединений добавляют приставки, по которым можно установить количественное соотношение между составными частями бинарного соединения.
Например, SO3 – триоксид серы, N2O4 – тетроксид диазота, I2CL6 – гексахлорид диода.
Если в бинарном соединении присутствует химический элемент, способный проявлять разные степени окисления, после названия соединения в круглых скобках указывают состояние окисления.
К примеру, два соединения железа отличаются по названию: FeCL3 — оксид железа (3), FeCL2 – оксид железа (2).
Для гидридов, в частности неметаллических элементов, пользуются тривиальными названиями. Так, H2O – вода, HCL – хлороводород, HI – йодоводород, HF – плавиковая кислота.
Катионы
Положительным ионам тех элементов, которые способны образовывать только один устойчивый ион, дают такие же названия, как и у самих символов. К ним относятся все представители первой и второй групп периодической системы Менделеева.
Например, катионы натрия и магния имеют вид: Na+, Mg2+. Переходные элементы способны образовывать несколько видов катионов, поэтому в названии необходимо указывать валентность, проявляемую в каждом отдельном случае.
Анионы
У простых (одноатомных) и комплексных (многоатомных) анионов применяется суффикс –ид.
Распространенным оксоанионом определенного элемента является суффикс –ам. Для оксоаниона элемента, находящегося в формуле с меньшей степенью окисления, применяется суффикс –ит. Для минимального состояния окисления используется приставка гипо-, а для максимального значения – пер-. Например, ион О2- является оксид-ионом, а О- — пероксидом.
Существуют и разнообразные тривиальные названия гидридов. Например, N2H4 именуют гидразином, а PH3 называют фосфином.
Серосодержащие оксоанионы имеют следующие названия:
- SO42- — сульфат;
- S2O32- — тиосульфат;
- NCS- — тиоцианат.
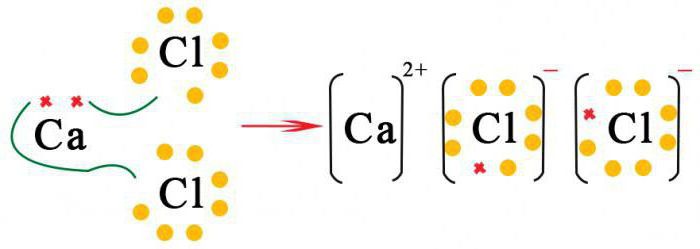
Соли
Во многих итоговых тестах по химии предлагается следующее задание: «Составьте формулы бинарных соединений металлов». Если в составе таких соединений есть анионы хлора, брома, йода, такие соединения называют галогенидами, относят к классу солей. При составлении формул этих бинарных соединений на первое место ставится металл, затем соответствующий галогенид-ион.
Для определения количества атомов каждого элемента находят наименьшее кратное между валентностями, при делении получают индексы.
У таких соединений высокая температура плавления и кипения, хорошая растворимость в воде, при нормальных условиях они являются твердыми веществами. Например, хлориды натрия и калия входят в состав морской воды.
Поваренную соль люди применяют с древних времен. В настоящее время использование этого бинарного соединения не ограничивается употреблением в пищу. При электролизе водного раствора хлорида натрия получают металлический натрий и газообразный хлор. Эти продукты используются в различных производственных процессах, например для получения гидроксида натрия, хлороводорода.
Значение бинарных соединений
К данной группе относится огромное количество веществ, поэтому можно с уверенностью говорить о масштабности их использования в разных сферах человеческой деятельности. Аммиак в химической промышленности применяют в качестве прекурсора при изготовлении азотной кислоты, производстве минеральных удобрений. Именно это бинарное соединение применяют в тонком органическом синтезе, долгое время использовали в холодильных установках.
Благодаря уникальной твердости карбида вольфрама, это соединение нашло применение в изготовлении многообразного режущего инструмента. Химическая инертность этого бинарного соединения позволяет применять его в агрессивных средах: лабораторном оборудовании, печах.
«Веселящий газ» (оксид азота 1) в смеси с кислородом используется в медицине для общего наркоза.
Все бинарные соединения имеют ковалентный либо ионный характер химической связи, молекулярную, ионную или атомную кристаллическую решетку.
Заключение
При составлении формул бинарных соединений необходимо соблюдать определенный алгоритм действий. Сначала записывается элемент, который проявляет положительную степень окисления (имеет меньшее значение электрической отрицательности). При определении значения степени окисления у второго элемента из восьми вычитают номер группы, в котором он находится. Если полученные числа отличаются между собой, определяется наименьшее общее кратное, затем вычисляются индексы.
Помимо оксидов, к данным соединениям причисляют карбиды, силициды, пероксиды, гидриды. Карбиды алюминия и кальция используют для лабораторного получения метана и ацетилена, пероксиды используют в химической промышленности в качестве сильных окислителей.
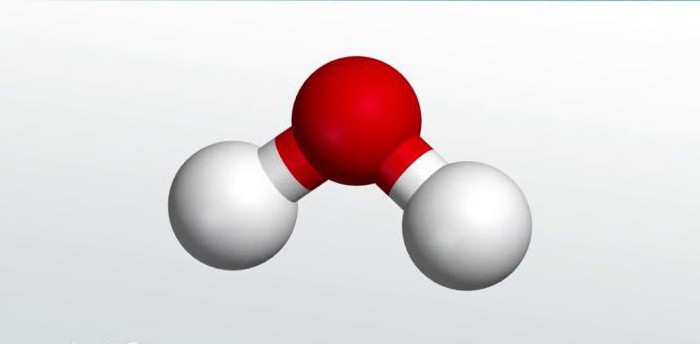
Такой галогенид, как фтороводород (плавиковая кислота), используется в электротехнике при паянии. Среди самых важных бинарных соединений, без которых трудно представить себе существование живых организмов, лидирует вода. Особенности строения этого неорганического соединения подробно изучаются в школьном курсе химии. Именно на ее примере ребята получают представления о последовательности действий при составлении формул бинарных соединений.
В заключение отметим, что сложно найти такую сферу современной промышленности, область человеческой жизни, где бы ни применялись разнообразные бинарные соединения.
Бинарными называются соединения, состоящие из двух элементов. Систематические названия бинарных соединений образуются следующим образом. Сначала указывается название элемента, расположенного в периодической таблице выше и правее, чем другой элемент. К этому названию добавляется суффикс «ид». Затем указывается название другого элемента. В случае ковалентных соединений к названиям одного или
обоих элементов добавляются приставки, указывающие численное соотношение между атомами этих элементов в соединении. Например,
В тех случаях, когда бинарное соединение содержит элемент, который может находиться в двух или нескольких состояниях окисления, после его названия в скобках римской цифрой указывается соответствующее состояние окисления. Например,
Для гидридов, особенно гидридов неметаллических элементов, чаще используются тривиальные названия (табл. 4.8).
Катионы
Катионам элементов, образующих только один устойчивый ион, присваивают те же названия, что и у соответствующего элемента. К таким элементам относятся все элементы I и II группы. Например,
Многие переходные -элементы образуют больше одного устойчивого катиона. В названиях таких ионов после элемента в скобках указывают римскими цифрами степень окисления иона (табл. 4.9).
Названия комплексных (многоатомных) катионов часто заканчиваются на -оний» (табл. 4.10).
Анионы
Простые (одноатомные) и комплексные (многоатомные) анионы имеют суффикс -ид (табл. 4.11).
Название наиболее распространенного оксоаниона конкретного элемента имеет суффикс -ам. Название оксоаниона того же элемента, в котором последний находится в более низком состоянии окисления, имеет суффикс -ит. Название иона элемента, находящегося в самом низком состоянии окисления, включает приставку гипо-, а название иона элемента, находящегося в самом высоком состоянии окисления, включает приставку пер-. Для обозначения серных аналогов оксоанионов используется приставка тио- (табл. 4.12).
В номенклатурной системе ASE названия оксоанионов иногда включают прямое указание степени окисления элемента вместо соответствующей приставки или суффикса либо наряду с ними. Примеры таких названий, приведенные в табл. 4.13, отнюдь не исчерпывают всех подобных случаев. В этой книге встречаются и другие примеры названий многоатомных анионов.
Таблица 4.8. Гидриды, имеющие тривиальные названия
Таблица 4.9. Названия катионов некоторых переходных элементов
Таблица 4.10. Названия некоторых многоатомных катионов
Таблица 4.11. Названия некоторых анионов
Таблица 4.12. Названия серусодержащих аналогов оксоанионов
Таблица 4.13. Названия многоатомных анионов
Комплексные ионы
Комплексный ион состоит из центрального атома, связанного с несколькими лигандами — другими атомами, ионами либо группами атомов.
Формулу комплексного иона заключают в квадратные скобки. Заряд такого иона указывают за правой скобкой. В скобках сначала указывают символ центрального атома. За ним следуют формулы анионных лигандов, а затем нейтральных лигандов, перечисляемых в алфавитном порядке их донорного атома (см. гл. 14). Многоатомные лиганды записывают в круглых скобках.
В названиях комплексных ионов сначала указывают лиганды. Их перечисляют в алфавитном порядке, не учитывая численных приставок. Название комплексного иона завершается названием металла с указанием соответствующей степени окисления (в скобках). В названиях комплексных катионов используются русские названия металлов (табл. 4.14.). В названиях комплексных анионов используются латинские названия металлов с суффиксом -ам.
В табл. 4.15 указаны названия и формулы некоторых наиболее распространенных лигандов, а в табл. 4.16 -названия комплексных анионов некоторых металлов.
Соли
Название соли образуется из названия аниона, за которым следует название катиона (табл. 4.17). В названиях кислых солей к аниону присоединяют приставку гидро-. Численные приставки используются только в названиях некоторых кислых солей. В названиях двойных солей катионы перечисляются в алфавитном порядке. В названиях основных солей анионы перечисляются в алфавитном порядке.
Названия гидратных солей образуются двумя способами. Если известно, что одна или несколько молекул воды координированы с центральным атомом комплексного иона, можно воспользоваться системой наименования комплексных ионов, описанной выше. Для более распространенных гидратных солей степень гидратации указывают численной приставкой к слову «гидрат». Например, называется пентагидрат сульфата меди (II).
Таблица 4.14. Названия комплексных ионов
Таблица 4.15. Названия лигандов в комплексных соединениях
Таблица 4.16. Названия комплексных анионов некоторых элементов
Таблица 4.17. Названия некоторых солей
Кислоты
Название кислоты определяется названием ее аниона (кислотного остатка). Суффиксы в названиях кислот образуются следующим образом:
В номенклатурной системе ASE в названия наименее распространенных оксокислот включают степень окисления центрального атома аниона (табл. 4.18).
Тиокислоты представляют собой серные аналоги оксокислот. Например,
Таблица 4.18. Названия некоторых кислот
Формулы ионных соединений
Формула ионного соединения указывает простейшее количественное соотношение между ионами в ионной решетке. Поскольку кристаллическая решетка в целом должна быть электрически нейтральной, формула ионного соединения должна учитывать эту нейтральность (табл. 4.19).
Таблица 4.19. Формулы ионных соединений
Валентность
При составлении формул ковалентных молекул и ионных соединений удобно пользоваться валентностями атомов, ионов или групп атомов. Валентность — это число электронов, используемых атомом при образовании химической связи. Валентность атома равна числу электронов, теряемых им при образовании катиона либо присоединяемых при образовании аниона. Валентность атома в ковалентной молекуле равна числу электронов, обобществляемых им при образовании связей с другими атомами.
Валентности всегда выражаются небольшими целыми числами. В табл. 4.20 указаны наиболее распространенные валентности элементов. Инертные газы, как, например, гелий, имеют нулевую валентность. В обычных условиях они не образуют
Таблица 4.20. Наиболее распространенные валентности некоторых элементов
соединений. Некоторые элементы, в частности переходные -металлы, могут иметь несколько разных валентностей (табл. 4.21). В табл. 4.22 приведены примеры, показывающие, как пользоваться валентностями для определения формул простейших соединений.
Иногда валентности имеют численные значения, совпадающие со степенями окисления, однако так бывает отнюдь не всегда. Например, углерод всегда имеет валентность 4, а его степень окисления может изменяться от —4 до +4. Поэтому в органической химии принято характеризовать углерод его валентностью, а не степенями окисления. В табл. 4.23 сопоставлены валентность и степени окисления углерода в пяти соединениях.
Таблица 4.21. Элементы, имеющие непостоянную валентность
Таблица 4.22. Использование валентностей для установления формул химических соединений
Таблица 4.23. Валентность и степень окисления углерода в некоторых соединениях
Нестехиометрические соединения
Большинство соединений являются стехиометрическими. Это означает, что соотношение между количеством атомов или ионов в соединении выражается простыми целыми числами. Однако некоторые соединения не характеризуются постоянными целочисленными отношениями атомов или ионов. Точное значение такого отношения может варьировать в зависимости от метода получения соединения. Приведем несколько примеров:
Такие соединения часто называют нестехиометрическими.
Нестехиометрия этих соединений обусловлена наличием дефектов в их кристаллических решетках. В некоторых случаях ионы одного элемента занимают положения в междоузлиях кристалла между другими ионами. В других случаях ионы одного элемента замещают ионы другого элемента в узлах кристаллической решетки. Это приводит к образованию ионных вакансий в решетке из-за необходимости сохранения электрической нейтральности кристалла.
Строго говоря, нестехиометрические соединения не являются соединениями, поскольку они не имеют постоянного состава. По этой причине вместо термина нестехиометрические соединения предпочтительнее пользоваться термином нестехиометрические кристаллы.
Бертоллиды
Нестехиометрические соединения иногда называют бертоллидами по имени Клода Луи Бертолле (1748 1822), который считал, что состав всех соединений меняется непрерывно в некоторых пределах. Это мнение окончательно опроверг Луи Жозеф Пруст (1755 1826), который в 1799 г. сформулировал закон постоянства состава.
Итак, повторим еще раз.
1. Чистые вещества подразделяются на два типа: простые вещества (элементы) и соединения.
2. Смеси подразделяются на гомогенные (однородные) и гетерогенные (неоднородные).
3. Все вещества состоят из частиц трех типов: атомов, молекул и ионов.
4. Основные количественные законы химии включают:
а) закон сохранения материи,
б) закон постоянства состава (закон постоянных отношений),
в) закон кратных отношений,
г) закон эквивалентных отношений.
5. Наиболее распространенные соединения часто имеют тривиальные (традиционные) и систематические названия.
6. Название всякого вещества должно быть однозначным.
7. Химическая формула указывает простейшее соотношение между количеством атомов разных элементов в молекуле, ионе или координационном кристалле.
8. Степень окисления элемента определяется числом атомов кислорода, с которым его атом связан в соединении.
9. Валентность — это число электронов, используемых атомом или ионом при образовании химической связи.
