Какие свойства проявляют атомы кальция
Кальций — это распространенный элемент, часто встречающийся в природе в виде различных соединений, в основном — солей. Скелет любого организма обязан своим существованием этому веществу. Такой важный элемент заслуживает более пристального внимания, поэтому далее будет дана подробная характеристика химического элемента, рассмотрено строение атома кальция….
Признаки
В природе в чистом виде вещество не встречается, определить физические свойства кальция можно только в лабораторных условиях:
- простое состояние это металл, обладающий твердостью, пластичностью, который легко режется,
- плавится при температуре — 842 С,
- температура кипения — 1482С,
- плотность составляет 1,54 г/см3 при 20,
- модуль упругости — 2600 кгс/мм2,
- предельное значение упругости — 0,4 кгс/мм2,
- твердость по Бринеллю — 20-30 кгс/мм2,
- имеет серебристо-белый оттенок,
- при нагревании загорается, пламя имеет кирпично-красный цвет.
 Одной из специфических особенностей является способность изменять свои свойства под давлением. Сначала он теряет металлические качества, проявляя качества полупроводника.
Одной из специфических особенностей является способность изменять свои свойства под давлением. Сначала он теряет металлические качества, проявляя качества полупроводника.
При повышенном давлении металлические свойства возвращаются, элемент приобретает сверхпроводимость. Относится к типу щелочно-земельных металлов.
Атомный порядковый номер элемента — 20. Официально принятое обозначение — Ca (по лат. Calcium).
Каковы химические свойства кальция? Элемент обладает повышенной степенью активности, благодаря чему в чистом виде никогда не встречается. Соединения кальция, напротив, встречаются повсеместно — в составе многочисленных горных пород и организмов. На открытом воздухе происходит быстрая реакция с кислородом или углеводородом, отчего на поверхности элемента возникает серый налет.
С кислотами реагирует бурно, иногда происходит воспламенение. Не менее активно протекает реакция с водой, она сопровождается обильным выделением водорода. Образовавшийся раствор дает щелочную реакцию. Высокая химическая активность кальция, его мгновенное окисление на воздухе вынуждают хранить его в плотно закрытой стеклянной таре, покрытым слоем парафина или под слоем керосина.
С кислородом или галогенами соединяется при обычных условиях. С фосфором, водородом, серой, азотом, углеродом и прочими неметаллическими элементами вступает в химическую реакцию при нагревании, а со фтором реакция идет даже на холоде. С водой взаимодействует активно, с холодной — медленнее, с горячей — очень бурно.
Атомная структура
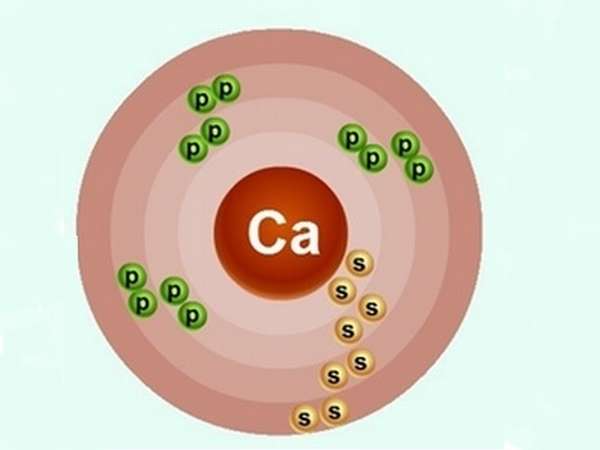 Рассмотрим строение атома кальция. Ядро несет положительный заряд (+20). Внутри него имеются 20 нейтронов и столько же протонов, вокруг ядра движутся по 4 орбитам 20 электронов, распределенных по 2:8:8:2.
Рассмотрим строение атома кальция. Ядро несет положительный заряд (+20). Внутри него имеются 20 нейтронов и столько же протонов, вокруг ядра движутся по 4 орбитам 20 электронов, распределенных по 2:8:8:2.
Степень окисления кальция равняется +2. На внешнем энергетическом уровне атом содержит 2 спаренных s-электрона, которые он легко отдает при химических реакциях.
Они определяют валентность элемента. Электронное строение атома кальция: 1s2 2s2 2p6 3s2 3p6 4s2 (коротко 4s2).
Внимание! Моль — это определенное (6,02 · 1023) количество молекул. Моль одного вещества имеет массу, отличающуюся от массы моля другого вещества, поскольку строение молекул и, соответственно, их вес будут разными.
Молярная масса кальция — это отношение массы вещества к числу молей: Формула, по которой рассчитывается масса в молях:
,Где M — молярная масса.
m — масса вещества.
n — количество моль.
Молярная масса кальция составляет 40,08 г/моль.
Каково отличие атомов от ионов
Ионы — это частицы, образованные при удалении или присоединении электронов к атому. Бывают положительно (катион) или отрицательно (анион) заряженными при потере или получении дополнительных электронов. Могут существовать как в составе молекул химических соединений, так и в самостоятельном виде (плазма, газ или жидкость).
Строение атома кальция отличается от иона. Атом представляет собой нейтральную частицу с одинаковым количеством электронов и протонов. В этом заключается основное отличие атома от иона.
Атом кальция отличается от иона своим зарядом и свойствами. Строение атома кальция таково, что на внешней оболочке находятся 2 электрона, которые могут вступать в различные связи. При соединении элемента 2 внешних электрона переходят на орбиты других атомов, превращая нейтральный атом в положительно заряженный ион Ca++. При этом атом имеет восстановительные свойства, а ион — окислительные.
Главные особенности
 В таблице Менделеева элемент помещен во II группу 4 периода главной подгруппы (А), и все без исключения элементы этой группы относятся к щелочноземельным металлам, со всеми соответствующими признаками и свойствами.
В таблице Менделеева элемент помещен во II группу 4 периода главной подгруппы (А), и все без исключения элементы этой группы относятся к щелочноземельным металлам, со всеми соответствующими признаками и свойствами.
В отличие от типичных металлов кальций обладает некоторыми специфическими свойствами. Есть основания предположить, что это неметалл.
При определенных условиях, как было сказано выше, под высоким давлением он утрачивает металлические свойства.
Элемент химически активен, поэтому в природе соединения кальция содержатся в виде солей, главным образом, в составе минералов или отложений земной коры. Также большое количество кальция содержится в морской воде, где его доля составляет около 1 г/л. Тело человека содержит около 1-1,5 кг вещества, причем, большая его часть содержится в костях, обеспечивая их прочность.
Наиболее богаты кальцием осадочные породы:
- мел.
- известняк.
- гипс.
- мрамор.
- доломит.
- апатит.
Все внутрипещерные образования, сталактиты и сталагмиты представляют собой карбонат СаС03. Строение атома позволяет ему активно вступать в реакцию с другими веществами, поэтому количество разнообразных соединений весьма велико.
Элемент является щелочноземельным металлом. поскольку, вступая в реакцию он отдает электроны, то является восстановителем и степень окисления кальция в соединениях +2. У простого элемента степень окисления равна нулю, как и у всех металлов, поскольку у них равномерно распределена электронная плотность. В неорганической химии понятие «степень окисления» часто тождественно понятию «валентность».
Сфера использования
 Каково применение кальция? Основное направление — металлургия. Он выполняет роль восстановителя при производстве меди, хрома, нержавеющей стали, урана, никеля, тория.
Каково применение кальция? Основное направление — металлургия. Он выполняет роль восстановителя при производстве меди, хрома, нержавеющей стали, урана, никеля, тория.
Для получения редко встречающихся земных элементов металлическую разновидность применяют в металлотермии, причем довольно широко.
Для раскисления стали (удаления кислорода, находящегося в расплаве) используют в составе соединения с алюминием или в качестве отдельного химического элемента.
Кроме того, металлический элемент используется как легирующая добавка, увеличивающая прочность подшипников, ответственных деталей двигателей или летательных аппаратов.
Применяется в нефтеперерабатывающей промышленности для удаления серы, служит для обезвоживания различных органических жидкостей. С его помощью в промышленности производится очистка аргона от азотистых примесей.
Не менее широко используется в медицине, воздействует на многие функции организма, в связи с чем количество элемента постоянно должно пополняться. Кроме того, способствует выводу из организма радионуклидов. Препараты глюконат кальция, хлористый кальций, гипс и другие широко применяются для лечения или профилактики различных заболеваний.
Какую роль играет внутри организма
Имеет важное структурное значение, являясь строительным материалом для твердых покровов, костей, зубов, роговых пластин, копыт животных. Раковины моллюсков практически полностью состоят из кальцинированных соединений. Велика биологическая роль кальция. В организме человека он осуществляет массу функций, участвуя в большинстве жизненно важных процессов:
- регулирует мышечные сокращения, секрецию нейромедиаторов,
- воздействуя на кровеносную систему, регулирует давление,
- принимает активное участие в регулировании свертывания крови и обмена веществ внутри клеток,
- участвует в постоянном обновлении состава костей,
- укрепляет иммунную систему,
- способствует синтезу ферментов и гормонов,
- воздействует на мышцы, регулирует сердечные сокращения,
- влияет на внутриклеточные процессы,
- защищает клетку, регулируя проницаемость мембраны.
Суточное пополнение организма человека кальцием должно составлять не менее 800-1250 мг, предельная норма — 2500 мг/сут.
Важно! Это единственный элемент, способный нормализовать кислотно-щелочной баланс в организме. Преобладание кислоты вызывает активное образование солей, камней в почках, создаст предпосылки к возникновению сердечно-сосудистых заболеваний.
Свойства кальция и его соединений
Химия. Элемент кальций
Заключение
Элемент имеет колоссальное значение в области химии, геологии, биологии, играет важнейшую роль в функционировании живых организмов и активно участвует в общих природных процессах.
Ñ. Ò. Æóêîâ Õèìèÿ 8-9 êëàññ
14.1. Îáùàÿ õàðàêòåðèñòèêà ýëåìåíòîâ IA è
IIA ãðóïï
 IA ãðóïïó âõîäÿò ëèòèé, íàòðèé, êàëèé,
ðóáèäèé è öåçèé. Ýòè ýëåìåíòû íàçûâàþò ùåëî÷íûìè
ýëåìåíòàìè. Â ýòó æå ãðóïïó âõîäèò èñêóññòâåííî
ïîëó÷åííûé ìàëîèçó÷åííûé ðàäèîàêòèâíûé
(íåóñòîé÷èâûé) ýëåìåíò ôðàíöèé. Èíîãäà â IA ãðóïïó
âêëþ÷àþò è âîäîðîä (ñì.ãëàâó 10). Òàêèì
îáðàçîì, â ýòó ãðóïïó âõîäÿò ýëåìåíòû êàæäîãî èç 7
ïåðèîäîâ.
Âî IIA ãðóïïó âõîäÿò áåðèëëèé, ìàãíèé, êàëüöèé,
ñòðîíöèé, áàðèé è ðàäèé. Ïîñëåäíèå ÷åòûðå
ýëåìåíòà èìåþò ãðóïïîâîå íàçâàíèå
ùåëî÷íîçåìåëüíûå ýëåìåíòû.
Ãîâîðÿ î òîì, ñêîëü ÷àñòî âñòðå÷àþòñÿ ïðèðîäå
àòîìû òîãî, èëè èíîãî ýëåìåíòà, îáû÷íî óêàçûâàþò
åãî ðàñïðîñòðàíåííîñòü â çåìíîé êîðå. Ïîä çåìíîé
êîðîé ïîíèìàþò àòìîñôåðó, ãèäðîñôåðó è ëèòîñôåðó
íàøåé ïëàíåòû. Òàê, â çåìíîé êîðå íàèáîëåå
ðàñïðîñòðàíåíû ÷åòûðå èç ýòèõ òðèíàäöàòè
ýëåìåíòîâ: Na (w =2,63 %), K (w = 2,41 %), Mg (w = 1,95 %)
è Ca (w = 3,38 %). Îñòàëüíûå âñòðå÷àþòñÿ
çíà÷èòåëüíî ðåæå, à ôðàíöèé âîîáùå íå
âñòðå÷àåòñÿ.
Îðáèòàëüíûå ðàäèóñû àòîìîâ ýòèõ ýëåìåíòîâ (êðîìå
âîäîðîäà) èçìåíÿþòñÿ îò 1,04 À (ó áåðèëëèÿ) äî 2,52 À (ó
öåçèÿ), òî åñòü ó âñåõ àòîìîâ ïðåâûøàþò 1 àíãñòðåì.
Ýòî ïðèâîäèò ê òîìó, ÷òî âñå ýòè ýëåìåíòû
ïðåäñòàâëÿþò ñîáîé ýëåìåíòû, îáðàçóþùèå
èñòèííûå ìåòàëëû, à áåðèëëèé ýëåìåíò,
îáðàçóþùèé àìôîòåðíûé ìåòàëë.
Îáùàÿ âàëåíòíàÿ ýëåêòðîííàÿ ôîðìóëà ýëåìåíòîâ IA
ãðóïïû ns1, à ýëåìåíòîâ IIÀ ãðóïïû ns2.
Áîëüøèå ðàçìåðû àòîìîâ è íåçíà÷èòåëüíîå ÷èñëî
âàëåíòíûõ ýëåêòðîíîâ ïðèâîäÿò ê òîìó, ÷òî àòîìû
ýòèõ ýëåìåíòîâ (êðîìå áåðèëëèÿ) ñêëîííû îòäàâàòü
ñâîè âàëåíòíûå ýëåêòðîíû. Íàèáîëåå ëåãêî îòäàþò
ñâîè âàëåíòíûå ýëåêòðîíû àòîìû ýëåìåíòîâ IA
ãðóïïû (ñì. ïðèëîæåíèå 6), ïðè ýòîì èç àòîìîâ
ùåëî÷íûõ ýëåìåíòîâ îáðàçóþòñÿ îäíîçàðÿäíûå
êàòèîíû, à èç àòîìîâ ùåëî÷íîçåìåëüíûõ ýëåìåíòîâ
è ìàãíèÿ äâóõçàðÿäíûå êàòèîíû. Ñòåïåíè
îêèñëåíèÿ â ñîåäèíåíèÿõ ó ùåëî÷íûõ ýëåìåíòîâ
ðàâíà +I, à ó ýëåìåíòîâ IIA ãðóïïû +II.
Ïðîñòûå âåùåñòâà, îáðàçóåìûå àòîìàìè ýòèõ
ýëåìåíòîâ, ìåòàëëû. Ëèòèé, íàòðèé, êàëèé,
ðóáèäèé, öåçèé è ôðàíöèé íàçûâàþò ùåëî÷íûìè
ìåòàëëàìè, òàê êàê èõ ãèäðîêñèäû ïðåäñòàâëÿþò
ñîáîé ùåëî÷è. Êàëüöèé, ñòðîíöèé è áàðèé íàçûâàþò
ùåëî÷íîçåìåëüíûìè ìåòàëëàìè. Õèìè÷åñêàÿ
àêòèâíîñòü ýòèõ âåùåñòâ óâåëè÷èâàåòñÿ ïî ìåðå
óâåëè÷åíèÿ àòîìíîãî ðàäèóñà.
Èç õèìè÷åñêèõ ñâîéñòâ ýòèõ ìåòàëëîâ íàèáîëåå
âàæíû èõ âîññòàíîâèòåëüíûå ñâîéñòâà. Ùåëî÷íûå
ìåòàëëû ñèëüíåéøèå âîññòàíîâèòåëè. Ìåòàëëû
ýëåìåíòîâ IIA ãðóïïû òàêæå äîâîëüíî ñèëüíûå
âîññòàíîâèòåëè.
Âñå îíè (êðîìå áåðèëëèÿ) ðåàãèðóþò ñ âîäîé (ìàãíèé
ïðè êèïÿ÷åíèè):
2M + 2H2O = 2Maq
+ 2OHaq + H2,
M + 2H2O = M2 + 2OH + H2.
 ñëó÷àå ìàãíèÿ, êàëüöèÿ è ñòðîíöèÿ
èç-çà ìàëîé ðàñòâîðèìîñòè îáðàçóþùèõñÿ
ãèäðîêñèäîâ ðåàêöèÿ ñîïðîâîæäàåòñÿ
îáðàçîâàíèåì îñàäêà:
M2 + 2OH = Mg(OH)2
Ùåëî÷íûå ìåòàëëû ðåàãèðóþò ñ
áîëüøèíñòâîì íåìåòàëëîâ:
2M + H2 = 2MH (ïðè íàãðåâàíèè),
4M + O2 = 2M2O (M Li),
2M + Cl2 = 2MCl (ïðè îáû÷íûõ óñëîâèÿõ),
2M + S = M2S (ïðè íàãðåâàíèè).
Èç ùåëî÷íûõ ìåòàëëîâ, ñãîðàÿ â
êèñëîðîäå, îáû÷íûé îêñèä îáðàçóåò òîëüêî ëèòèé.
Îñòàëüíûå ùåëî÷íûå ìåòàëëû îáðàçóþò ïåðîêñèäû (M2O2)
èëè íàäïåðîêñèäû (MO2 ñîåäèíåíèÿ,
ñîäåðæàùèå íàäïåðîêñèä-èîí ñ ôîðìàëüíûì çàðÿäîì
1 å).
Êàê è ùåëî÷íûå ìåòàëëû, ìåòàëëû ýëåìåíòîâ IIA
ãðóïïû ðåàãèðóþò ñî ìíîãèìè íåìåòàëëàìè, íî ïðè
áîëåå æåñòêèõ óñëîâèÿõ:
M + H2 = MH2 (ïðè íàãðåâàíèè; êðîìå
áåðèëëèÿ),
2M + O2 = 2MO (ïðè îáû÷íûõ óñëîâèÿõ; Be è Mg ïðè
íàãðåâàíèè),
M + Cl2 = MCl2 (ïðè îáû÷íûõ óñëîâèÿõ),
M + S = MS (ïðè íàãðåâàíèè).
 îòëè÷èå îò ùåëî÷íûõ ìåòàëëîâ ñ êèñëîðîäîì îíè
îáðàçóþò îáû÷íûå îêñèäû.
Ñ êèñëîòàìè ñïîêîéíî ðåàãèðóåò òîëüêî ìàãíèé è
áåðèëëèé, îñòàëüíûå ïðîñòûå âåùåñòâà î÷åíü
áóðíî, ÷àñòî ñî âçðûâîì.
Áåðèëëèé ðåàãèðóåò ñ êîíöåíòðèðîâàííûìè
ðàñòâîðàìè ùåëî÷åé:
Be + 2OH + 2H2O =
[Be(OH)4]2 + H2
 ñîîòâåòñòâèè ñ ïîëîæåíèåì â ðÿäó
íàïðÿæåíèé ñ ðàñòâîðàìè ñîëåé ðåàãèðóþò òîëüêî
áåðèëëèé è ìàãíèé, îñòàëüíûå ìåòàëëû â ýòîì
ñëó÷àå ðåàãèðóþò ñ âîäîé.
ßâëÿÿñü ñèëüíûìè âîññòàíîâèòåëÿìè, ùåëî÷íûå è
ùåëî÷íîçåìåëüíûå ìåòàëëû âîññòàíàâëèâàþò
ìíîãèå ìåíåå àêòèâíûå ìåòàëëû èç èõ ñîåäèíåíèé,
íàïðèìåð, ïðè íàãðåâàíèè ïðîòåêàþò ðåàêöèè:
4Na + MnO2 = 2Na2O + Mn;
2Ca + SnO2 = 2CaO + Sn.
Îáùèé äëÿ âñåõ ùåëî÷íûõ ìåòàëëîâ è ìåòàëëîâ IIA
ãðóïïû ïðîìûøëåííûé ñïîñîá ïîëó÷åíèÿ
ýëåêòðîëèç ðàñïëàâîâ ñîëåé.
Êðîìå áåðèëëèÿ îêñèäû âñåõ ðàññìàòðèâàåìûõ
ýëåìåíòîâ îñíîâíûå îêñèäû, à ãèäðîêñèäû
ñèëüíûå îñíîâàíèÿ (ó áåðèëëèÿ ýòè ñîåäèíåíèÿ
àìôîòåðíûå, ãèäðîêñèä ìàãíèÿ ñëàáîå
îñíîâàíèå).
Óñèëåíèå îñíîâíûõ ñâîéñòâ ãèäðîêñèäîâ ñ
óâåëè÷åíèåì ïîðÿäêîâîãî íîìåðà ýëåìåíòà â
ãðóïïå ëåãêî ïðîñëåæèâàåòñÿ â ðÿäó ãèäðîêñèäîâ
ýëåìåíòîâ IIA ãðóïïû. Be(OH)2 àìôîòåðíûé
ãèäðîêñèä, Mg(OH)2 ñëàáîå îñíîâàíèå, Ca(OH)2,
Sr(OH)2 è Ba(OH)2 ñèëüíûå îñíîâàíèÿ, íî ñ
óâåëè÷åíèåì ïîðÿäêîâîãî íîìåðà ðàñòåò èõ
ðàñòâîðèìîñòü, è Ba(OH)2 óæå ìîæíî îòíåñòè ê
ùåëî÷àì.
ÍÀÄÏÅÐÎÊÑÈÄÛ
1.Ñîñòàâüòå ñîêðàùåííûå ýëåêòðîííûå ôîðìóëû è
ýíåðãåòè÷åñêèå äèàãðàììû àòîìîâ ýëåìåíòîâ IA è IIA
ãðóïï. Óêàæèòå âíåøíèå è âàëåíòíûå ýëåêòðîíû.
2.Ïî êàêèì ïðè÷èíàì âîäîðîä ïîìåùàþò â IA ãðóïïó, à
ïî êàêèì â VIIA ãðóïïó?
3.Ñîñòàâüòå óðàâíåíèÿ ðåàêöèé ñëåäóþùèõ âåùåñòâ
ñ èçáûòêîì êèñëîðîäà: Li, Na, K, LiH, NaH, Li3N, Na2C2.
4.Êðèñòàëëû íåêîòîðîãî âåùåñòâà ñîñòîÿò èç
îäíîçàðÿäíûõ èîíîâ. Â ñîñòàâ êàæäîãî èîíà âõîäèò
ïî 18 ýëåêòðîíîâ. Ñîñòàâüòå à) ïðîñòåéøóþ ôîðìóëó
âåùåñòâà; á) ñîêðàùåííûå ýëåêòðîííûå ôîðìóëû
èîíîâ; â) óðàâíåíèå îäíîé èç ðåàêöèé ïîëó÷åíèÿ
ýòîãî âåùåñòâà; ã) äâà óðàâíåíèÿ ðåàêöèé ñ
ó÷àñòèåì ýòîãî âåùåñòâà.
14.2. Íàòðèé è êàëèé
Íàòðèé è êàëèé âàæíåéøèå ùåëî÷íûå
ýëåìåíòû.
Ïðîñòûå âåùåñòâà, îáðàçóåìûå ýòèìè
ýëåìåíòàìè, ìÿãêèå ëåãêîïëàâêèå ñåðåáðèñòûå
ìåòàëëû, ëåãêî ðåæóòñÿ íîæîì, áûñòðî îêèñëÿþòñÿ
íà âîçäóõå. Õðàíÿò èõ ïîä ñëîåì êåðîñèíà.
Òåìïåðàòóðà ïëàâëåíèÿ íàòðèÿ 98 °Ñ, à êàëèÿ 64 °Ñ.
Îêñèäû ýòèõ ýëåìåíòîâ òèïè÷íûå îñíîâíûå
îêñèäû. Îíè î÷åíü ãèãðîñêîïè÷íû: ïîãëîùàÿ âîäó,
ïðåâðàùàþòñÿ â ãèäðîêñèäû.
Ãèäðîêñèäû íàòðèÿ è êàëèÿ ùåëî÷è. Ýòî
òâåðäûå áåñöâåòíûå êðèñòàëëè÷åñêèå âåùåñòâà,
ïëàâÿùèåñÿ áåç ðàçëîæåíèÿ. Êàê è îêñèäû, îíè
î÷åíü ãèãðîñêîïè÷íû: ïîãëîùàÿ âîäó, ïðåâðàùàþòñÿ
â êîíöåíòðèðîâàííûå ðàñòâîðû. Êàê òâåðäûå
ãèäðîêñèäû, òàê è èõ êîíöåíòðèðîâàííûå ðàñòâîðû
î÷åíü îïàñíûå âåùåñòâà: ïðè ïîïàäàíèè íà êîæó
âûçûâàþò òðóäíîçàæèâàþùèå ÿçâû, âäûõàíèå èõ ïûëè
ïðèâîäèò ê ïîðàæåíèþ äûõàòåëüíûõ ïóòåé.
Ãèäðîêñèä íàòðèÿ (òðèâèàëüíûå íàçâàíèÿ åäêèé
íàòð, êàóñòè÷åñêàÿ ñîäà) îòíîñèòñÿ ê âàæíåéøèì
ïðîäóêòàì õèìè÷åñêîé ïðîìûøëåííîñòè ñ åãî
ïîìîùüþ ñîçäàåòñÿ ùåëî÷íàÿ ñðåäà âî ìíîãèõ
õèìè÷åñêèõ ïðîèçâîäñòâàõ. Ãèäðîêñèä êàëèÿ
(òðèâèàëüíîå íàçâàíèå «åäêîå êàëè»)
èñïîëüçóþò äëÿ ïðîèçâîäñòâà äðóãèõ ñîåäèíåíèé
êàëèÿ.
Áîëüøèíñòâî ñðåäíèõ ñîëåé íàòðèÿ è êàëèÿ
òåðìè÷åñêè óñòîé÷èâûå âåùåñòâà è ðàçëàãàþòñÿ
òîëüêî ïðè î÷åíü âûñîêèõ òåìïåðàòóðàõ. Ïðè
óìåðåííîì íàãðåâàíèè ðàçëàãàþòñÿ òîëüêî ñîëè
ãàëîãåíñîäåðæàùèõ îêñîêèñëîò, íèòðàòû è
íåêîòîðûå äðóãèå ñîåäèíåíèÿ:
NaClO4 = NaCl + 2O2;
8NaClO3 = 6NaClO4 + 2NaCl;
2NaNO3 = 2NaNO2 + O2;
Na2[Zn(OH)4] = Na2ZnO2 + 2H2O .
Êèñëûå ñîëè ìåíåå óñòîé÷èâû, ïðè
íàãðåâàíèè âñå îíè ðàçëàãàþòñÿ:
2NaHS = Na2S + H2S ;
2NaHSO4 = Na2S2O7 + H2O ;
2NaHCO3 = Na2CO3 + H2O + CO2;
NaH2PO4 = NaPO3 + H2O ;
Na2HPO4 = Na4P2O7 + H2O .
Îñíîâíûõ ñîëåé ýòè ýëåìåíòû íå
îáðàçóþò.
Èç ñîëåé íàèáîëüøåå çíà÷åíèå èìååò
õëîðèä íàòðèÿ ïîâàðåííàÿ ñîëü. Ýòî íå òîëüêî
íåîáõîäèìàÿ ñîñòàâíàÿ ÷àñòü ïèùè, íî è ñûðüå äëÿ
õèìè÷åñêîé ïðîìûøëåííîñòè. Èç íåãî ïîëó÷àþò
ãèäðîêñèä íàòðèÿ, ïèòüåâóþ ñîäó (NaHCO3), ñîäó
(Na2CO3) è ìíîãèå äðóãèå ñîåäèíåíèÿ
íàòðèÿ. Ñîëè êàëèÿ íåîáõîäèìûå ìèíåðàëüíûå
óäîáðåíèÿ.
Ïî÷òè âñå ñîëè íàòðèÿ è êàëèÿ ðàñòâîðèìû, ïîýòîìó
äîñòóïíûõ êà÷åñòâåííûõ ðåàêöèé íà èîíû ýòèõ
ýëåìåíòîâ íå. (Êà÷åñòâåííûìè ðåàêöèÿìè íàçûâàþò
õèìè÷åñêèå ðåàêöèè, ïîçâîëÿþùèå îáíàðóæèòü â
ñîåäèíåíèè àòîìû èëè èîíû êàêîãî-ëèáî
õèìè÷åñêîãî ýëåìåíòà, äîêàçàâ ïðè ýòîì, ÷òî
îáíàðóæåí èìåííî ýòè àòîìû èëè èîíû, à íå
êàêèå-íèáóäü äðóãèå, ïîõîæèå íà íèõ ïî õèìè÷åñêèì
ñâîéñòâàì. Òàêæå íàçûâàþò ðåàêöèè, ïîçâîëÿþùèå
îáíàðóæèòü êàêîå-ëèáî âåùåñòâî â ñìåñè)
Îïðåäåëèòü íàëè÷èå â ñîåäèíåíèè èîíîâ íàòðèÿ èëè
êàëèÿ ìîæíî ïî îêðàøèâàíèþ áåñöâåòíîãî ïëàìåíè
ïðè âíåñåíèè â íåãî èññëåäóåìîãî îáðàçöà: â
ñëó÷àå íàòðèÿ ïëàìÿ îêðàøèâàåòñÿ â æåëòûé öâåò, à
â ñëó÷àå êàëèÿ â ôèîëåòîâûé.
ÊÀ×ÅÑÒÂÅÍÍÛÅ
ÐÅÀÊÖÈÈ
Ñîñòàâüòå
óðàâíåíèÿ ðåàêöèé, õàðàêòåðèçóþùèõ
õèìè÷åñêèå ñâîéñòâà à) íàòðèÿ, á) ãèäðîêñèäà
êàëèÿ, â) êàðáîíàòà íàòðèÿ, ã) ãèäðîñóëüôèäà
íàòðèÿ.
Îêðàøèâàíèå ïëàìåíè ñîëÿìè íàòðèÿ è êàëèÿ
14.3. Ìàãíèé è êàëüöèé
Ïðîñòûå âåùåñòâà ìàãíèé è êàëüöèé
ìåòàëëû. Êàëüöèé áûñòðî îêèñëÿåòñÿ íà âîçäóõå, à
ìàãíèé â ýòèõ óñëîâèÿõ çíà÷èòåëüíî óñòîé÷èâåå
îí îêèñëÿåòñÿ ëèøü ñ ïîâåðõíîñòè. Êàëüöèé õðàíÿò
ïîä ñëîåì êåðîñèíà. Òåìïåðàòóðû ïëàâëåíèÿ ìàãíèÿ
è êàëüöèÿ 650 è 851 °Ñ ñîîòâåòñòâåííî. Ìàãíèé è
êàëüöèé çíà÷èòåëüíî áîëåå òâåðäûå âåùåñòâà, ÷åì
ùåëî÷íûå ìåòàëëû. Íåâûñîêàÿ ïëîòíîñòü ìàãíèÿ (1,74
ã/ñì3) ïðè çíà÷èòåëüíîé ïðî÷íîñòè äàåò
âîçìîæíîñòü èñïîëüçîâàòü åãî ñïëàâû â
àâèàöèîííîé ïðîìûøëåííîñòè.
È ìàãíèé, è êàëüöèé ñèëüíûå âîññòàíîâèòåëè
(îñîáåííî ïðè íàãðåâàíèè). Èõ ÷àñòî èñïîëüçóþò
äëÿ âîññòàíîâëåíèÿ äðóãèõ, ìåíåå àêòèâíûõ,
ìåòàëëîâ èç èõ îêñèäîâ (ìàãíèé â ëàáîðàòîðèè, à
êàëüöèé â ïðîìûøëåííîñòè).
Ìàãíèé è êàëüöèé îäíè èç íåìíîãèõ ìåòàëëîâ
ðåàãèðóþùèõ ñ àçîòîì. Ïðè íàãðåâàíèè îíè
îáðàçóåò ñ íèì íèòðèäû Mg3N2 è Ca3N2.
Ïîýòîìó, ñãîðàÿ íà âîçäóõå, ìàãíèé è êàëüöèé
ïðåâðàùàþòñÿ â ñìåñü îêñèäîâ ñ íèòðèäàìè.
Êàëüöèé ëåãêî ðåàãèðóåò ñ âîäîé, à ìàãíèé
òîëüêî ïðè êèïÿ÷åíèè.  îáîèõ ñëó÷àÿõ âûäåëÿåòñÿ
âîäîðîä è îáðàçóþòñÿ ìàëîðàñòâîðèìûå
ãèäðîêñèäû.
Îêñèäû ìàãíèÿ è êàëüöèÿ èîííûå âåùåñòâà; ïî
õèìè÷åñêîìó ïîâåäåíèþ îíè îñíîâíûå îêñèäû.
Îêñèä ìàãíèÿ ñ âîäîé íå ðåàãèðóåò, à îêñèä
êàëüöèÿ (òðèâèàëüíîå íàçâàíèå «íåãàøåíàÿ
èçâåñòü») ðåàãèðóåò áóðíî ñ âûäåëåíèåì
òåïëîòû. Îáðàçóþùèéñÿ ãèäðîêñèä êàëüöèÿ â
ïðîìûøëåííîñòè íàçûâàþò «ãàøåíîé èçâåñòüþ».
Ãèäðîêñèä ìàãíèÿ íåðàñòâîðèì â âîäå, òåì íå
ìåíåå îí ÿâëÿåòñÿ îñíîâàíèåì. Ãèäðîêñèä êàëüöèÿ
çàìåòíî ðàñòâîðèì â âîäå; åãî íàñûùåííûé ðàñòâîð
íàçûâàþò «èçâåñòêîâîé âîäîé», ýòî ùåëî÷íîé
ðàñòâîð (èçìåíÿåò îêðàñêó èíäèêàòîðîâ).
Ãèäðîêñèä êàëüöèÿ â ñóõîì, à îñîáåííî âî âëàæíîì
ñîñòîÿíèè ïîãëîùàåò óãëåêèñëûé ãàç èç
îêðóæàþùåãî âîçäóõà è ïðåâðàùàåòñÿ â êàðáîíàò
êàëüöèÿ. Ýòî ñâîéñòâî ãàøåíîé èçâåñòè ìíîãî
âåêîâ èñïîëüçîâàëîñü â ñòðîèòåëüñòâå: ãàøåíàÿ
èçâåñòü êàê îñíîâíîé êîìïîíåíò âõîäèëà â ñîñòàâ
ñòðîèòåëüíûõ èçâåñòêîâûõ ðàñòâîðîâ, â íàñòîÿùåå
âðåìÿ ïî÷òè ïîëíîñòüþ çàìåíåííûõ öåìåíòíûìè. Îáà
ãèäðîêñèäà ïðè óìåðåííîì íàãðåâàíèè, íå ïëàâÿñü,
ðàçëàãàþòñÿ.
Ñîëè ìàãíèÿ è îñîáåííî êàëüöèÿ âõîäÿò â
ñîñòàâ ìíîãèõ ïîðîäîîáðàçóþùèõ ìèíåðàëîâ. Èç
ýòèõ ãîðíûõ ïîðîä íàèáîëåå èçâåñòíû ìåë, ìðàìîð è
èçâåñòíÿê, îñíîâíûì âåùåñòâîì êîòîðûõ ÿâëÿåòñÿ
êàðáîíàò êàëüöèÿ. Êàðáîíàòû êàëüöèÿ è ìàãíèÿ ïðè
íàãðåâàíèè ðàçëàãàþòñÿ íà ñîîòâåòñòâóþùèå
îêñèäû è óãëåêèñëûé ãàç. Ñ âîäîé, ñîäåðæàùåé
ðàñòâîðåííûé äèîêñèä óãëåðîäà, ýòè êàðáîíàòû
ðåàãèðóþò, îáðàçóÿ ðàñòâîðû ãèäðîêàðáîíàòîâ,
íàïðèìåð:
MCO3 + CO2 + H2O = M2 + 2HCO3.
Ïðè íàãðåâàíèè, è äàæå ïðè ïîïûòêå
âûäåëèòü ãèäðîêàðáîíàòû èç ðàñòâîðà, óäàëÿÿ âîäó
ïðè êîìíàòíîé òåìïåðàòóðå, îíè ðàçëàãàþòñÿ ïî
îáðàòíîé ðåàêöèè:
M2 + 2HCO3 = MCO3+ CO2+ H2O.
Ãèäðàòèðîâàííûé ñóëüôàò êàëüöèÿ CaSO4·2H2O
ïðåäñòàâëÿåò ñîáîé áåñöâåòíîå êðèñòàëëè÷åñêîå
âåùåñòâî ìàëîðàñòâîðèìîå â âîäå. Ïðè íàãðåâàíèè
îíî ÷àñòè÷íî îáåçâîæèâàåòñÿ, ïåðåõîäÿ â
êðèñòàëëîãèäðàò ñîñòàâà 2CaSO4·H2O.
Òðèâèàëüíîå íàçâàíèå äâóâîäíîãî ãèäðàòà ãèïñ,
à ïîëóâîäíîãî àëåáàñòð. Ïðè ñìåøèâàíèè
àëåáàñòðà ñ âîäîé îí ãèäðàòèðóåòñÿ, ïðè ýòîì
îáðàçóåòñÿ ïëîòíàÿ òâåðäàÿ ìàññà ãèïñà. Ýòî
ñâîéñòâî àëåáàñòðà èñïîëüçóåòñÿ â ìåäèöèíå
(ãèïñîâûå ïîâÿçêè) è ñòðîèòåëüñòâå (àðìèðîâàííûå
ãèïñîâûå ïåðåãîðîäêè, çàäåëêà äåôåêòîâ).
Ñêóëüïòîðû èñïîëüçóþò àëåáàñòð äëÿ èçãîòîâëåíèÿ
ãèïñîâûõ ìîäåëåé è ôîðì.
Êàðáèä (àöåòèëåíèä) êàëüöèÿ CaC2. Ñòðóêòóðíàÿ
ôîðìóëà (Ca2)(CC).
Ïîëó÷àþò ñïåêàíèåì íåãàøåíîé èçâåñòè ñ óãëåì:
CaO + 3C = CaC2 + CO
Ýòî èîííîå âåùåñòâî íå ÿâëÿåòñÿ ñîëüþ
è ïîëíîñòüþ ãèäðîëèçóåòñÿ âîäîé ñ îáðàçîâàíèåì
àöåòèëåíà, êîòîðûé äîëãîå âðåìÿ è ïîëó÷àëè òàêèì
ñïîñîáîì:
CaC2 + 2H2O = C2H2+ Ca(OH)2.
Ãèäðàòèðîâàííûé èîí ìàãíèÿ [Mg(H2O)6]2 êàòèîííàÿ êèñëîòà (ñì.
ïðèëîæåíèå 13), ïîýòîìó ðàñòâîðèìûå ñîëè ìàãíèÿ
ïîäâåðãàþòñÿ ãèäðîëèçó. Ïî ýòîé æå ïðè÷èíå
ìàãíèé ìîæåò îáðàçîâûâàòü îñíîâíûå ñîëè,
íàïðèìåð, Mg(OH)Cl. Ãèäðàòèðîâàííûé èîí êàëüöèÿ íå
ÿâëÿåòñÿ êàòèîííîé êèñëîòîé.
Êàëüöèé â ñîåäèíåíèè ìîæåò áûòü îáíàðóæåí ïî
îêðàøèâàíèþ ïëàìåíè. Öâåò ïëàìåíè
îðàíæåâî-êðàñíûé. Êà÷åñòâåííàÿ ðåàêöèÿ íà èîíû Ca2, Sr2 è Ba2, íå
ïîçâîëÿþùàÿ îäíàêî ðàçëè÷èòü ýòè èîíû ìåæäó
ñîáîé îñàæäåíèå ñîîòâåòñòâóþùèõ ñóëüôàòîâ
ðàçáàâëåííûì ðàñòâîðîì ñåðíîé êèñëîòû (èëè ëþáûì
ðàñòâîðîì ñóëüôàòà â êèñëîòíîé ñðåäå):
M2 + SO42 = MSO4.
1.Ïî÷åìó
ìàãíèé è êàëüöèé íå îáðàçóþò îäíîçàðÿäíûõ èîíîâ?
2.Ñîñòàâüòå óðàâíåíèÿ âñåõ ðåàêöèé, ïðèâåäåííûõ
ïàðàãðàôå îïèñàòåëüíî.
3.Ñîñòàâüòå óðàâíåíèÿ ðåàêöèé, õàðàêòåðèçóþùèõ
õèìè÷åñêèå ñâîéñòâà à) êàëüöèÿ, á) îêñèäà êàëüöèÿ,
â) ãèäðîêñèäà ìàãíèÿ, ã) êàðáîíàòà êàëüöèÿ, ä)
õëîðèäà ìàãíèÿ.
Èññëåäîâàíèå ñâîéñòâ ñîåäèíåíèé ìàãíèÿ è
êàëüöèÿ
14.4. Æåñòêîñòü âîäû è ìåòîäû åå
óñòðàíåíèÿ
Ïðèðîäíàÿ âîäà â òîé, èëè èíîé ñòåïåíè
ñîäåðæèò èîíû ðàñòâîðèìûõ ñîëåé. Åñëè â ïðåñíîé
âîäå ñóììàðíàÿ êîíöåíòðàöèÿ èîíîâ Mg2 è Ca2 ïðåâûøàåò 2 ììîëü/ë, òî òàêóþ âîäó
íàçûâàþò æåñòêîé (åñëè íå ïðåâûøàåò, òî ìÿãêîé).
 êà÷åñòâå àíèîíîâ â æåñòêîé âîäå ìîãóò
ñîäåðæàòüñÿ HCO3,
SO42, Cl è äðóãèå èîíû.
Ïðè íàãðåâàíèè æåñòêîé âîäû èç íåå âûäåëÿþòñÿ
êàðáîíàòû ìàãíèÿ è êàëüöèÿ, à ïðè êèïÿ÷åíèè åùå
è ñóëüôàòû. Îáðàçóþùèéñÿ ïëîòíûé îñàäîê ÷àñòî
íàçûâàþò «íàêèïüþ». Èìåííî îí ïîÿâëÿåòñÿ íà
âíóòðåííèõ ïîâåðõíîñòÿõ ÷àéíèêîâ. Â
ïðîìûøëåííîñòè ýòîò îñàäîê îáðàçóåòñÿ íà
ñòåíêàõ êîòëîâ, ñíèæàÿ èõ òåïëîïðîâîäíîñòü, è
òðóáîïðîâîäîâ, óìåíüøàÿ èõ âíóòðåííèé äèàìåòð.
Ïðè ñòèðêå â æåñòêîé âîäå ñ èñïîëüçîâàíèåì ìûëà
åãî ðàñõîä ñèëüíî âîçðàñòàåò, à êà÷åñòâî ñòèðêè
ñíèæàåòñÿ, òàê êàê èç ðàñòâîðà ìûëà (íàòðèåâûõ
ñîëåé íåêîòîðûõ îðãàíè÷åñêèõ êèñëîò) âûäåëÿþòñÿ
íåðàñòâîðèìûå êàëüöèåâûå è ìàãíèåâûå ñîëè. Ïðè
èñïîëüçîâàíèè ñèíòåòè÷åñêèõ ñòèðàëüíûõ
ïîðîøêîâ ýòîò ýôôåêò íå íàáëþäàåòñÿ.
Ðàçëè÷àþò âðåìåííóþ (êàðáîíàòíóþ)
æåñòêîñòü, óñòðàíÿåìóþ êèïÿ÷åíèåì, è ïîñòîÿííóþ
(íåêàðáîíàòíóþ), ñîõðàíÿþùóþñÿ ïîñëå
êèïÿ÷åíèÿ âîäû.
Óñòðàíåíèå æåñòêîñòè çàêëþ÷àåòñÿ â óäàëåíèè èç
íåå èîíîâ Mg2 è Ca2.
Âðåìåííàÿ æåñòêîñòü óñòðàíÿåòñÿ êèïÿ÷åíèåì.
Äëÿ óñòðàíåíèÿ îáùåé æåñòêîñòè â âîäó äîáàâëÿþò
ðàçëè÷íûå ðåàãåíòû:
1. Ãàøåíóþ èçâåñòü Ca(OH)2.
Ca2 + HCO2 +OH = CaCO3+ H2O
Mg2 + 2HCO3 + Ca2 + 2OH = MgCO3+ CaCO3+ 2H2O
Mg2 + 2OH = Mg(OH)2
2. Ñîäó Na2CO3.
M2 +CO32 = MCO3
3. Ôîñôàò íàòðèÿ Na2PO4.
3M2 + 2PO43 = M3(PO4)2
Ôîñôàòû êàëüöèÿ è ìàãíèÿ ìåíåå
ðàñòâîðèìû, ÷åì êàðáîíàòû. Ïîýòîìó ïðèìåíåíèå
ôîñôàòà íàòðèÿ ïðèâîäèò ê áîëåå ïîëíîìó
óñòðàíåíèþ æåñòêîñòè.
Ñîâðåìåííûé ñïîñîá óñòðàíåíèÿ æåñòêîñòè îñíîâàí
íà ïðèìåíåíèè èîíîîáìåííûõ ñìîë (èîíèòîâ).
Èîíèòû ïðåäñòàâëÿþò ñîáîé ïîëèìåðíûå êèñëîòû RHn
(êàòèîíèòû) è ïîëèìåðíûå îñíîâàíèÿ R(OH)n
(àíèîíèòû).
Ïðè ïðîïóñêàíèè ðàñòâîðîâ ñîëåé ÷åðåç òðóáêè (èîíîîáìåííèêè),
çàïîëíåííûå çåðíàìè èîíèòîâ, ïðîòåêàþò ðåàêöèè,
íàçûâàåìûå ðåàêöèÿìè èîííîãî îáìåíà:
êàòèîíèòû êàê áû îáìåíèâàþò ñâîè àòîìû âîäîðîäà
íà êàòèîíû (îòñþäà è èõ íàçâàíèå), à àíèîíèòû
ãèäðîêñèëüíûå ãðóïïû íà àíèîíû:
RHn + (n/2)M2 + nH2O = RMn/2 + nH3O,
R(OH)n + nA
= RAn + nOH.
Ïîñëåäîâàòåëüíî ïðîïóñêàÿ æåñòêóþ
âîäó ÷åðåç èîíîîáìåííèê, çàïîëíåííûé êàòèîíèòîì,
è èîíîîáìåííèê, çàïîëíåííûé àíèîíèòîì, æåñòêîñòü
ìîæíî óñòðàíèòü ïîëíîñòüþ.
Òàêèì ñïîñîáîì ìîæíî î÷èñòèòü íå òîëüêî æåñòêóþ,
íî è ìîðñêóþ âîäó, ÷òî èíîãäà è äåëàåòñÿ äëÿ åå
îïðåñíåíèÿ. Â ïðîìûøëåííîñòè èîíèòû èñïîëüçóþò
äëÿ ïîëó÷åíèÿ ÷èñòîé (äåèîíèçèðîâàííîé) âîäû
âìåñòî äèñòèëëèðîâàííîé.
ÆÅÑÒÊÎÑÒÜ
ÂÎÄÛ,ÆÅÑÒÊÀß ÂÎÄÀ,ÌßÃÊÀß ÂÎÄÀ, ÂÐÅÌÅÍÍÀß
ÆÅÑÒÊÎÑÒÜ, ÏÎÑÒÎßÍÍÀß ÆÅÑÒÊÎÑÒÜ, ÈÎÍÎÎÁÌÅÍÍÛÅ
ÑÌÎËÛ (ÈÎÍÈÒÛ), ÊÀÒÈÎÍÈÒ, ÀÍÈÎÍÈÒ, ÈÎÍÎÎÁÌÅÍÍÈÊ,
ÐÅÀÊÖÈß ÈÎÍÍÎÃÎ ÎÁÌÅÍÀ.
Ñîñòàâüòå ìîëåêóëÿðíûå óðàâíåíèÿ ðåàêöèé,
èîííûå óðàâíåíèÿ êîòîðûõ ïðèâåäåíû â òåêñòå
ïàðàãðàôà.
