Какие свойства проявляет со в реакциях

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 декабря 2017;
проверки требуют 30 правок.
Окисли́тельно-восстанови́тельные реа́кции (ОВР), также редокс (сокр. англ. redox, от reduction-oxidation — восстановление-окисление) — встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором) .
Историческая справка[править | править код]
Издавна учёные полагали, что окисление — потеря флогистона (особого невидимого горючего вещества, термин которого ввел Иоганн Бехер), а восстановление — его приобретение. Но, после создания А. Лавуазье в 1777 году кислородной теории горения, к началу XIX века химики стали считать окислением взаимодействие веществ с кислородом, а восстановлением их превращения под действием водорода. Тем не менее в качестве окислителя могут выступать и другие элементы, например
В этой реакции окислитель — ион водорода[1] — H+, а железо выступает в роли восстановителя.
В соответствии с электронно-ионной теорией окисления-восстановления, разработанной Л. В. Писаржевским в 1914 г., окисление — процесс отщепления электронов от атомов или ионов элемента, который окисляется; Восстановлением называется процесс присоединения электронов к атомам или ионам элемента, каковой восстанавливается. Например, в реакции
атом цинка теряет два электрона, то есть окисляется, а молекула хлора присоединяет их, то есть восстанавливается.
Описание[править | править код]
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление[править | править код]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окисле́нии у веществ в результате отдачи электронов увеличивается степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель (сам процесс называется окислением):
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Восстановление[править | править код]
Восстановле́ние — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель (сам процесс называют восстановлением):
окислитель + e− ↔ сопряжённый восстановитель.
Окислительно-восстановительная пара[править | править код]
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Виды окислительно-восстановительных реакций[править | править код]
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных
веществ, например:
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
Примеры[править | править код]
Окислительно-восстановительная реакция между водородом и фтором
Разделяется на две полу-реакции:
1) Окисление:
2) Восстановление:
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а атомы или ионы, которые отдают электроны — восстановителями.
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнениях из курса физической химии. Различают два методы уравнивания ОВР: метод полуреакций и метод электронного баланса. Метод электронного баланса более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений). Метод полуреакций более сложен и используется в случае протекания реакции в жидкой среде. Метод полуреакций оперирует не свободными атомами и одноатомными ионами, а реально существующими в растворе частицами, образовавшимися в результате процессов растворения и/или диссоциации реагирующих веществ. Оба метода занимают важное место в базовом курсе общей и неорганической химии, изучаемом студентами различных учебных заведений[3].
Примечания[править | править код]
- ↑ В этом, как и во многих других случаях водород рассматривают как помещённый в VII группе периодической системы химических элементов над галогенами-окислителями.
- ↑ Несущественно, переходят ли электроны с одного атома на другой вполне (ионная связь) или же только более или менее оттягиваются (полярная ковалентная связь). Поэтому в данном случае мы будем говорить об отдаче или присоединении электронов независимо от действительного типа валентной связи. В общем, окислительно-восстановительные процессы можно определить как реакции, связанные с переходом электронов от одних атомов к другим. То есть валентности [ковалентных молекулярных соединений] в этих реакциях выступают как степени окисления. Более строго, в узком смысле под степенью окисления имеется в виду в том числе и валентности.
- ↑ ОВР методом полуреакций (недоступная ссылка). Химия и химическая технология в жизни (10.07.2013). Дата обращения 19 января 2015. Архивировано 19 января 2015 года.
Литература[править | править код]
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углублённый курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.
См. также[править | править код]
- Кислотно-основные реакции
Кремний – твёрдый неметалл, входящий в состав горных пород. При обычных условиях инертен, но при нагревании проявляет окислительные и восстановительные свойства. Химические свойства кремния использует силикатная промышленность для изготовления стекла, зеркал, электроники, строительного материала.

Общее описание элемента
Кремний расположен в четвёртой группе и третьем периоде таблицы Менделеева. Ядро атома кремния имеет положительный заряд +14. Вокруг ядра движется 14 отрицательно заряженных электронов.
Атом может переходить в возбуждённое состояние за счёт свободного d-подуровня. Поэтому элемент проявляет две положительные степени окисления (+2 и +4) и одну отрицательную (-4). Электронная конфигурация – 1s22s22p63s23p2.

Рис. 1. Строение атома кремния.
Кремний – хрупкий полупроводник с высокими температурами правления и кипения. Относительно лёгкий неметалл: плотность составляет 2,33 г/см3.
В чистом виде кремний не встречается. Входит в состав песка, кварца, агата, аметиста и других пород.

Рис. 2. Агат.
Реакции с неметаллами
При взаимодействии с неметаллами кремний проявляет восстановительные свойства – отдаёт электроны. Реакции возможны только при сильном нагревании. При нормальных условиях кремний реагирует только с фтором. Реакции с основными неметаллами приведены в таблице.
Элемент | Описание | Реакция |
Фтор | При обычных условиях | Si + 2F2 → SiF4 |
Кислород | Взаимодействует при 600°C с образованием диоксида (песка) | Si + O2 → SiO2 |
Хлор | Реагирует при 400°C | Si + 2Cl2 → SiCl4 |
Углерод | Реагирует при 2000°C с образованием карборунда | Si + C → SiC |
Азот | Протекает при 1000°C | 3Si + 2N2 → Si3N4 |
Сера | Реагирует при 1000°C | Si + 2S → SiS2 |
Бор | Взаимодействует при 2000°C | Si + 3B → B3Si |
Гидрид кремния – силан (SiH4) – можно получить путём разложения силицидов кислотой. Например, Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Взаимодействие с металлами
Окислительные свойства кремний проявляет только в реакциях с металлами. При сплавлении образуются соли – силициды:
- Si + 2Mg → Mg2Si;
- Si + 2Ca → Ca2Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi2.
Силициды используются в промышленности для производства сплавов и материалов. В качестве сверхпроводника используется силицид ванадия (V3Si), полупроводника – силицид рения (ReSi).
Реакции со сложными веществами
Помимо простых веществ кремний реагирует со сложными соединениями – кислотами и щелочами. Основные реакции описаны в таблице.
Реакция | Описание | Уравнение |
С галогеноводородами | Реагирует с плавиковой кислотой при обычных условиях, с соляной кислотой – при 300°С, с бромоводородом – при 500°С | – Si + 4HF → SiF4 + 2H2; – Si + 4HCl → SiCl4 + 2H2; – Si + 4HBr → SiBr4 + 2H2 |
С кислотами | Является устойчивым по отношению к кислотам, покрываясь оксидной плёнкой. Реакция идёт только со смесью азотной и плавиковой кислот | 3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O |
Со щелочами | В водных растворах растворяется, образуя силикаты и водород | Si + 2KOH + H2O → K2SiO3 + H2 |
При 1200°C кремний реагирует с диоксидом, образуя монооксид: Si + SiO2 → SiO.

Рис. 3. Применение кремния.
Что мы узнали?
Кремний – хрупкий неметалл, взаимодействующий с металлами, неметаллами и сложными веществами. В реакциях с металлами проявляет свойства окислителя, с неметаллами – восстановителя. Реагирует при нормальных условиях только с фтором, плавиковой кислотой (в том числе вместе с азотной кислотой), со щелочами. Остальные реакции протекают при повышенных температурах.
Тест по теме
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 107.
Определение
Окислительно -восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления одного или нескольких элементов.
Окислительно-восстановительные реакции играют важную роль в природе и технике. Фотосинтез, дыхание, брожение, накопление энергии в клетках сопровождаются переносом электронов. Разделяя процессы окисления и восстановления, удается превращать энергию химических реакций в электрическую. Этот принцип лежит в основе работы гальванических элементов и аккумуляторов.
К числу ОВР принадлежат все реакции между простыми и сложными веществами, между двумя простыми веществами, а также некоторые случаи взаимодействия сложных веществ:
$overset{0}{Fe} + overset{+2}{Cu}overset{+6}{S} overset{-2}{O_4} = overset{+2}{Fe}overset{+6}{S} overset{-2}{O_4} +overset{0}{Cu}$
$2overset{0}{Mg} + overset{0}{O_2} = 2overset{+2}{Mg}overset{-2}{O}$
$2overset{+1}{K} overset{-1}{I} + 4overset{+1}{H}overset{+5}{N}overset{-2}{O_3} = overset{0}{I_2} + 2overset{+4}{N}overset{-2}{O_2} + 2overset{+1}{K} overset{+5}{N}overset{-2}{ O_3} + 2overset{+1}{H_2}overset{-2}{O}$
При окислительно-восстановительных реакциях происходит переход электронов от одних атомов к другим.
Определение

Атом, отдающий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается) – окислителем.
Часто термины окислитель и восстановитель переносят и на вещества, в состав которых входят соответствующие атомы. В результате реакции окислитель восстанавливается, а восстановитель окисляется.
Определение
Процесс отдачи атомом электронов называется окислением, а процесс принятия атомом электронов — восстановлением.
Запомни! Нельзя путать название процесса передачи электронов с функцией атома, которую он проявляет в этом процессе.
Восстановителем может быть атом элемента, а восстановление — это процесс принятия электронов.

| $underline{O}$кислитель | $underline{textrm{В}}$осстановитель |
|---|---|
| $underline{textrm{В}}$зял электроны | $underline{O}$тдал электроны |
| $underline{textrm{В}}$осстановился | $underline{O}$кислился |
| $S^{+6} + 2bar{e} rightarrow S^{+4}$ | $S^{-2} -2bar{e} rightarrow S^{0}$ |
| степень окисления $downarrow$ | степень окисления $uparrow$ |
| процесс восстановления | процесс окисления |
| Типичные окислители: | Типичные восстановители: |
|
|
Есть ряд мнемонических правил, которые позволяют лучше запомнить разницу между этими понятиями:
По первым буквам слов можно составить следующие сокращения:
ОВВ: окислитель — взял $bar{e}$ — восстановился
ВОО: восстановитель — отдал — окислился
 2. Или использовать словосочетание «окислитель-грабитель».
2. Или использовать словосочетание «окислитель-грабитель».3. Запомнить стихотворение:
Восстановитель — это тот, кто электроны отдает.
Сам отдает грабителю, злодею-окислителю.
Отдает — окисляется, сам восстановителем является.
КЛАССИФИКАЦИЯ ОВР
Определение
Окислительно-восстановительные реакции в которых окислитель и восстановитель входят в состав разных соединений называют межмолекулярными, а ОВР, в которых и окислитель, и восстановитель входят в состав одного и того же соединения — внутримолекулярными.
К числу внутримолекулярных принадлежат реакции термического разложения некоторых веществ, например, сульфата меди(II):
$2CuSO_4 stackrel{700^circ C}{=} 2CuO + 2SO_2 + O_2$
$mathrm{S^{+6} + 2e^– rightarrow S^{+4}}$ |2 2 окислитель, процесс восстановления
$mathrm{2O^{–2} – 4e^– rightarrow O_2^0}$ |4 1 восстановитель, процесс окисления
__________________________________________________________________________________________
$mathrm{2S^{+6} + 2O^{–2} rightarrow 2S^{+4} + O_2^0}$
Внутримолекулярные ОВР, в свою очередь, также делятся на два типа: реакции диспропорционирования и сопропорционирования.
Определение
Внутримолекулярные окислительно-восстановительные реакции, в которых окислителем и восстановителем является один и тот же элемент, который в начале реакции находится в одной степени окисления, называют диспропорционированием.
К числу таких реакций принадлежит, например, разложение пероксида водорода на воду и кислород.
$2H_2overset{-1}{O_2} rightarrow 2H_2overset{-2}{O} + overset{0}{O_2}$.
Определение
Внутримолекулярные окислительно-восстановительные реакции, в результате которых атомы одного и того же элемента, находящиеся в разных степенях окисления, приобретают одну промежуточную, называют сопропорционированием.
Примером служит взаимодействие сернистого газа с сероводородом, приводящее к образованию серы:
$2H_2overset{-2}{S} + overset{+4}{S}O_2 = 3overset{0}{S} + 2H_2O$.
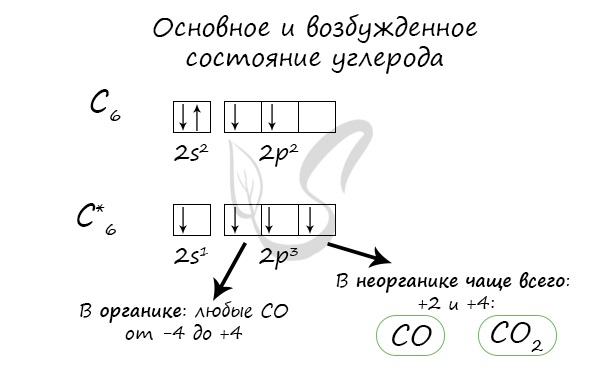
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
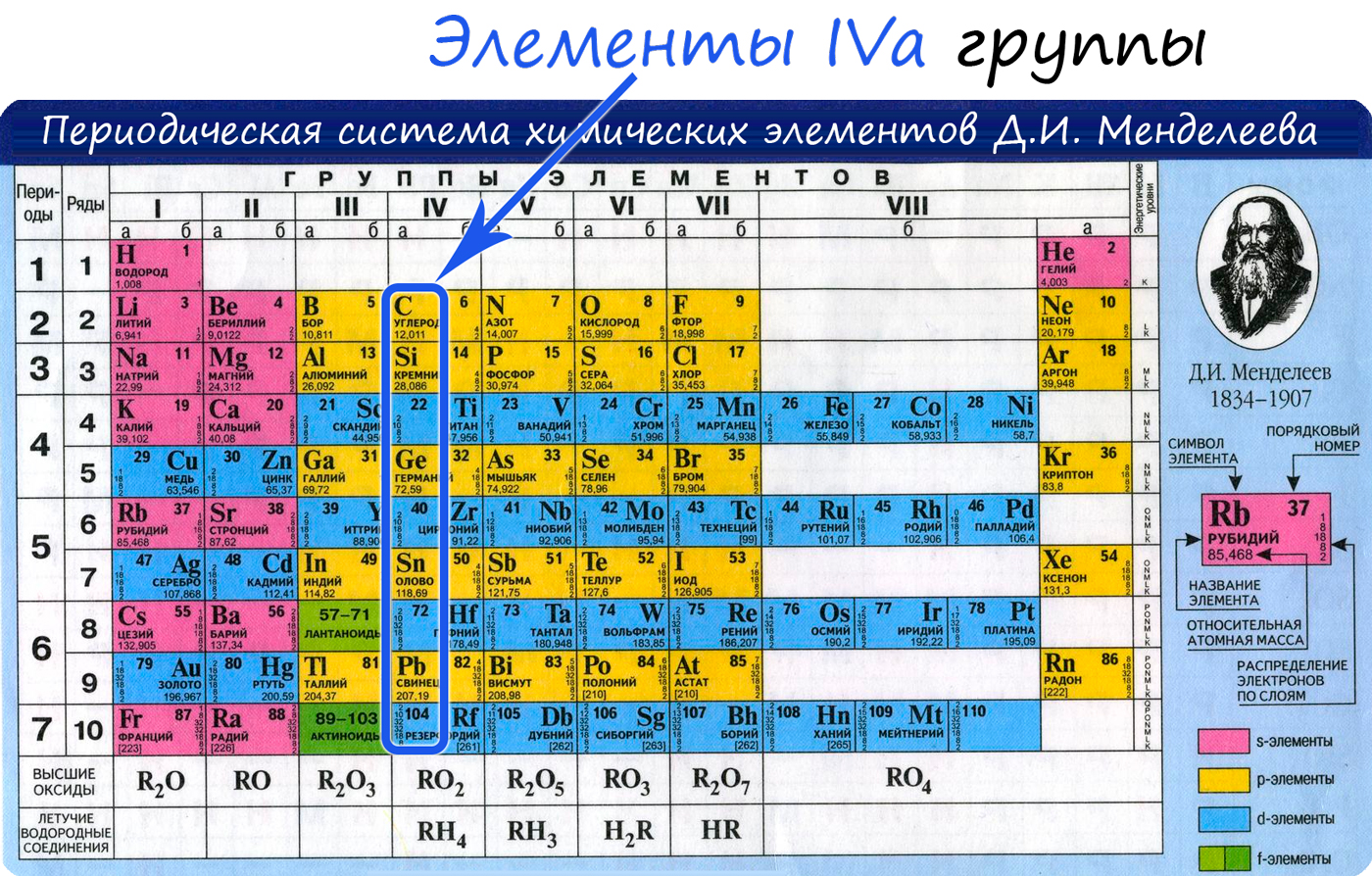
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

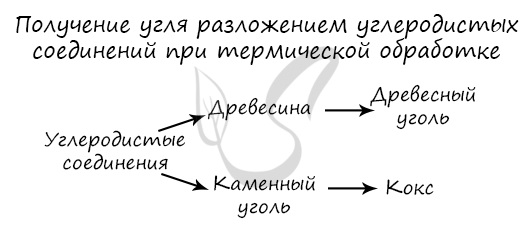
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO 3(конц.) → (t) CO2 + NO2 + H2
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на соответствующий оксид
металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
