Какие свойства проявляет хлор в реакциях с простыми веществами
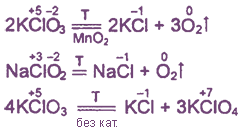
Основаны на процессе окисления анионов Cl-
2Cl— 2e- = Cl20
Электролиз водных растворов хлоридов, чаще — NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl— 2e- = Cl20
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:

Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.

гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
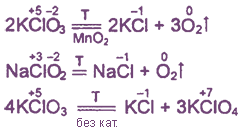
Хлорная известь
Хлорная (белильная) известь — смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Õëîð – ýëåìåíò VII ïîäãðóïïû Ïåðèîäè÷åñêîé òàáëèöû Ä.È.Ìåíäåëååâà. Íà âíåøíåì óðîâíå – 7 ýëåêòðîíîâ, ïîýòîìó ïðè âçàèìîäåéñòâèè ñ âîññòàíîâèòåëÿìè, õëîð ïîêàçûâàåò ñâîè îêèñëèòåëüíûå ñâîéñòâà, ïðèòÿãèâàÿ ê ñåáå ýëåêòðîí ìåòàëëà.
Ôèçè÷åñêèå ñâîéñòâà õëîðà.
Õëîð ïðåäñòàâëÿåò ñîáîé æåëòûé ãàç. Èìååò ðåçêèé çàïàõ.
Õèìè÷åñêèå ñâîéñòâà õëîðà.
Ñâîáîäíûé õëîð î÷åíü àêòèâåí. Îí ðåàãèðóåò ñî âñåìè ïðîñòûìè âåùåñòâàìè, êðîìå êèñëîðîäà, àçîòà è áëàãîðîäíûõ ãàçîâ:
Si + 2Cl2 = SiCl4 + Q.
Ïðè âçàèìîäåéñòâèè ñ âîäîðîäîì ïðè êîìíàòíîé òåìïåðàòóðå ðåàêöèè ïðàêòè÷åñêè íåò, íî êàê òîëüêî îñâåùåíèå âûñòóïàåò â êà÷åñòâå âíåøíåãî âîçäåéñòâèÿ, âîçíèêàåò öåïíàÿ ðåàêöèÿ, êîòîðàÿ íàøëà ñâîå ïðèìåíåíèå â îðãàíè÷åñêîé õèìèè.
Ïðè íàãðåâå õëîð ñïîñîáåí âûòåñíèòü éîä èëè áðîì èç èõ êèñëîò:
Cl2 + 2HBr = 2HCl + Br2.
Ñ âîäîé õëîð ðåàãèðóåò, ÷àñòè÷íî ðàñòâîðÿÿñü â íåé. Ýòó ñìåñü íàçûâàþò õëîðíîé âîäîé.
Ðåàãèðóåò ñ ùåëî÷àìè:
Cl2 + 2NaOH = NaCl + NaClO + H2O (õîëîä),
Cl2 + 6KOH = 5KCl + KClO3 + 3 H2O (íàãðåâ).
Ïîëó÷åíèå õëîðà.
1. Ýëåêòðîëèç ðàñïëàâà õëîðèäà íàòðèÿ, êîòîðûé ïðîòåêàåò ïî ñëåäóþùåé ñõåìå:
2. Ëàáîðàòîðíûé ñïîñîá ïîëó÷åíèÿ õëîðà:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå ýëåìåíòû | |
| Õèìè÷åñêèå ýëåìåíòû Ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà, ñâîéñòâà, âàëåíòíîñòü õèìè÷åñêèõ ýëåìåíòîâ | |
| Õèìè÷åñêèå ýëåìåíòû | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õëîðèäû ìåòàëëîâ. | |
| Õëîðèä ìåòàëëîâ ýòî ïðîèçâîäíîå îò õëîðîâîäîðîäíîé êèñëîòû è àòîìîì ìåòàëëà. | |
| Õëîðèäû ìåòàëëîâ. | |
Таблица
^
=>>
v
Хлор в сферической ампуле
(фото сайта periodictable.ru)

При добавлении капли серной кислоты к смеси бертоллетовой соли с сахаром происходит яркая вспышка |
| Поделиться в |
История открытия:
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты.
Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Название элемента происходит от греческого clwroz — «зелёный».
Нахождение в природе, получение:
Природный хлор представляет собой смесь двух изотопов 35Cl и 37Cl. В земной коре хлор — самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2·6H2O, карналлита KCl·MgCl2·6Н2O, каинита KCl·MgSO4·3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В промышленных масштабах хлор получают вместе с гидроксидом натрия и водородом при электролизе раствора поваренной соли:
2NaCl + 2H2О => H2 + Cl2 + 2NaOH
Для рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений используется процесс Дикона (каталитическое окисление хлороводорода кислородом воздуха):
4HCl + O2 = 2H2O + 2Cl2
В лабораториях обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
Физические свойства:
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Хлор заметно растворяется в воде («хлорная вода»). При 20°C в одном объеме воды растворяется 2,3 объема хлора.
Температура кипения = -34°C;
температура плавления = -101°C,
плотность (газ, н.у.) = 3,214 г/л.
Химические свойства:
Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы, металлами и неметаллами (кроме углерода, азота, кислорода и инертных газов). Хлор очень сильный окислитель, вытесняет менее активные неметаллы (бром, иод) из их соединений с водородом и металлами:
Cl2 + 2HBr = Br2 + 2HCl; Cl2 + 2NaI = I2 + 2NaCl
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли.
Cl2 + H2O HClO + HCl;
Хлор взаимодействует со многими органическими соединениями, вступая в реакции замещения или присоединения:
CH3-CH3 + xCl2 => C2H6-xClx + xHCl
CH2=CH2 + Cl2 => Cl-CH2-CH2-Cl
C6H6 + Cl2 => C6H6Cl + HCl
Хлор имеет семь степеней окисления: -1, 0, +1, +3, +4, +5, +7.
Важнейшие соединения:
Хлороводород HCl — бесцветный газ, на воздухе дымит вследствие образования с парами воды капелек тумана. Обладает резким запахом, сильно раздражает дыхательные пути. Содержится в вулканических газах и водах, в желудочном соке. Химические свойства зависят от того, в каком состоянии он находится (может быть в газообразном, жидком состоянии или в растворе). Раствор HCl называется соляной (хлороводородной) кислотой. Это сильная кислота, вытесняет более слабые кислоты из их солей. Соли — хлориды — твёрдые кристаллические вещества с высокими температурами плавления.
Ковалентные хлориды — соединения хлора с неметаллами, газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства, как правило легко гидролизующиеся водой с образованием соляной кислоты:
PCl5 + 4H2O = H3PO4 + 5HCl;
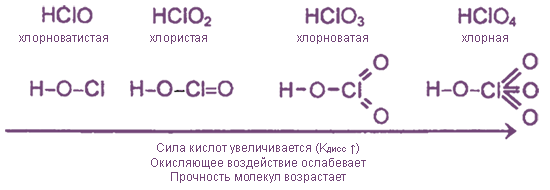
Оксид хлора(I) Cl2O., газ буровато-желтого цвета с резким запахом. Поражает дыхательные органы. Легко растворяется в воде, образуя хлорноватистую кислоту.
Хлорноватистая кислота HClO. Существует только в растворах. Это слабая и неустойчивая кислота. Легко разлагается на соляную кислоту и кислород. Сильный окислитель. Образуется при растворении хлора в воде. Соли — гипохлориты, малоустойчивы (NaClO*H2O при 70 °C разлагается со взрывом), сильные окислители. Широко используется для отбеливания и дезинфекции хлорная известь, смешанная соль Ca(Cl)OCl
Хлористая кислота HClO2, в свободном виде неустойчива, даже в разбавленном водном растворе она быстро разлагается. Кислота средней силы, соли — хлориты, как правило, бесцветны и хорошо растворимы в воде. В отличие от гипохлоритов, хлориты проявляют выраженные окислительные свойства только в кислой среде. Наибольшее применение (для отбелки тканей и бумажной массы) имеет хлорит натрия NaClO2.
Оксид хлора(IV) ClO2, — зеленовато-желтый газ с неприятным (резким) запахом, …
Хлорноватая кислота , HClO3 — в свободном виде нестабильна: диспропорционирует на ClO2 и HClO4. Соли — хлораты; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния. Это сильные окислители, в смеси с восстановителями взрывоопасны. Хлорат калия (бертолетова соль) — KClO3, использовалась для получения кислорода в лаборатории, но из-за высокой опасности её перестали применять. Растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Хлорная кислота HClO4, в водных растворах хлорная кислота — самая устойчивая из всех кислородсодержащих кислот хлора. Безводная хлорная кислота, которую получают при помощи концентрированной серной кислоты из 72%-ной HСlO4 мало устойчива. Это самая сильная одноосновная кислота (в водном растворе). Соли — перхлораты, применяются как окислители (твердотопливные ракетные двигатели).
Применение:
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
— В производстве поливинилхлорида, пластикатов, синтетического каучука;
— Для отбеливания ткани и бумаги;
— Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений;
— Для обеззараживания воды — «хлорирования»;
— В пищевой промышленности зарегистрирован в качестве пищевой добавки E925;
— В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений;
— В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
Биологическая роль и токсичность:
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Ионы хлора жизненно необходимы растениям, участвуя в энергетическом обмене у растений, активируя окислительное фосфорилирование.
Хлор в виде простого вещества ядовит, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую Мировую войну.
Короткова Ю., Швецова И.
ХФ ТюмГУ, 571 группа.
Источники: Википедия: https://ru.wikipedia.org/wiki/Cl и др.,
Сайт РХТУ им. Д.И.Менделеева: https://www.onx.distant.ru/elements/17-Cl_soed.html
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЯ ЭЛЕМЕНТОВ
ГАЛОГЕНЫ
Простые вещества
Химические
свойства простых веществ
Простые
вещества галогенов представляют собой двухатомные молекулы. В молекуле атомы соединены
одинарным ковалентным неполярным связью.
Химические
свойства Фтора
Фтор
— сильнейший окислитель в природе. Непосредственно он не реагирует только с гелием,
неоном и аргоном.
Под
время реакции с металлами образуются фториды, соединения ионного типа:

Фтор
энергично реагирует со многими неметаллами, даже с некоторыми инертными газами:

Фтор реагирует даже с многими химически стойкими соединениями,
например со стеклом (в виде стекловаты):
![]()
Очень много органических соединений в
атмосфере фтора занимаются, то есть начинают гореть. Например, древесина сгорает,
не оставляя после себя даже угля:
![]()
Вода тоже горит во фторе:
![]()
Физические
свойства простых веществ
Свойства | Фтор | Хлор | Бром | Йод |
Формула соединения | F2 | Cl2 | Вr2 | I2 |
Внешний вид в обычных условиях | Газ | Газ | Жидкость | Твердая |
Цвет | Ярко-желтый с оранжевым | Желто-зеленый | Цвет брома между темно-красным и | Твердый йод — серое кристаллическое вещество |
Запах и вкус | Резкий удушливый запах | Характерный удушливый запах (предоставляет | Очень неприятный запах | Характерный запах «настойки йода» |
Температура плавления | -220 | -102 | -7 °С | +114 (сублимируется) |
Температура кипения | -188 | -34 °С | +59 | +185 |
Плотность при н. у. | 1,7 | 3,214 | 3,18 | 4,94 |
Растворимость в воде | В атмосфере фтора вода занимается | 2,3 объема хлора растворяется в 1 | 36 | 0,3 |
Химические
свойства Хлора. Взаимодействие с металлами и неметаллами
В
большинства соединений, образованных атомом Хлора, он проявляет степень окисления-1.
Положительный степень окисления проявляется только в соединениях с такими атомами,
как Фтора и Кислород.
Простая
вещество хлор взаимодействует со всеми металлами. Во время этого взаимодействия металлы
окисляются до высших степеней. При этом образуются хлориды, соединения Хлора с
элементами, в которых атом Хлора проявляет степень окисления -1:

Хлор
также активно реагирует со всеми неметаллами, за исключением азота, кислорода и инертных
газов. В этом случае так же образуются хлориды:

Химические
свойства Хлора. Взаимодействие со сложными веществами
Хлор
является более сильным окисником, чем бром или йод, поэтому хлор вытесняет тяжелые галогены
из их солей:
![]()
Растворяясь
в воде, хлор частично реагирует с ней, в результате чего образуются две кислоты:
хлоридная и гіпохлоритна. При этом один атом Хлора повышает степень окисления,
а другой атом — снижает. Такие реакции называют реакциями диспропорціонування.
Реакции диспропорціонування — это реакции самовосстановления-самоокиснення, т.е.
реакции, при которых один элемент проявляет свойства и окисника, и
восстановителя. При диспропорціонуванні одновременно образуются соединения, в которых
элемент находится в более окисленном и восстановленном состоянии по сравнению с
первобытным. Степень окисления атома Хлора в молекуле гипохлоритной кислоты
равен +1:
![]()
Аналогично
протекает взаимодействие хлора с растворами щелочей. При этом образуются две соли: хлорид
и гипохлорит.
![]()
Хлор
вступает во взаимодействие с различными оксидами:
![]()
Хлор
окисляет некоторые соли, в которых металл находится не в максимальной степени
окисления:
![]()
Молекулярный
хлор реагирует со многими органическими соединениями. В присутствии феррум(III) хлорида
как катализатора хлор реагирует с бензолом с образованием хлорбензола, а при
облучении светом в результате этой же реакции образуется
гексахлорциклогексан:

Химические свойства брома и йода
Обе
вещества реагируют с водородом, фтором и щелочами:

Йод
окисляют различные сильные окислители:
![]()
Методы
добыча простых веществ
Извлечения фтора
Поскольку
фтор является сильнейшим химическим окисником, то выделить его с помощью химических
реакций из соединений в свободном виде невозможно, а потому фтор добывают
физико-химическим методом — электролизом.
Для
извлечения фтора используют расплав калий фторида и никелевые электроды.
Никель используют благодаря тому, что поверхность металла пассивируется фтором
вследствие образования нерастворимого NiF2, следовательно,
сами электроды не разрушаются под действием вещества, которое на них выделяется:
![]()
Добывания хлора
Хлор
в промышленных масштабах добывают электролизом раствора натрий хлорида. В результате
этого процесса добывают также натрий гидроксид:
![]()
В
небольших количествах хлор добывают окисненням раствора хлороводорода различными
методами:

Хлор
— очень важный продукт химической промышленности.
Его
мировое производство составляет миллионы тонн.
Извлечения брома и йода
Для
промышленного использования бром и йод добывают при окислении бромидов и
йодидов, соответственно. Для окисления чаще всего используют молекулярный хлор,
концентрированную сульфатную кислоту или манган диоксид:

Применение
галогенов
Фтор
и некоторые его соединения используют как окислитель ракетного топлива. Большие
количества фтора используют для добывания различных хладагентов (фреонов) и
некоторых полимеров, которым свойственна химическая и термическая стойкость (тефлон и некоторые
другие). Фтор применяют в ядерной технике для разделения изотопов урана.
Большое
часть хлора используют для получения соляной кислоты, а также как
окислитель для добывания других галогенов. В промышленности его используют для
отбеливания тканей и бумаги. В больших количествах, чем фтор, его
применяют для производства полимеров (ПВХ и других) и хладагентов. По
помощью хлора дезинфицируют питьевую воду. Он также нужен для добывания
некоторых растворителей, таких как хлороформ, хлористый метилен, тетрахлорметан. А еще
его используют для производства многих веществ, например хлората калия
(бертолетовой соли), хлорной извести и многих других соединений, содержащих атомы
Хлора.
Бром
и йод применяют в промышленности не в таких масштабах, как хлор или фтор, однако
с каждым годом использование этих веществ увеличивается. Бром используют в
производстве различных медицинских препаратов успокаивающего действия. Йод используют
при изготовлении антисептических препаратов. Соединения Брома и Йода широко
применяют при количественном анализе веществ. С помощью йода очищают некоторые
металлы (этот процесс называют йодным рафинированием), например титан, ванадий и
другие.

