Какие свойства относятся к сложным
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
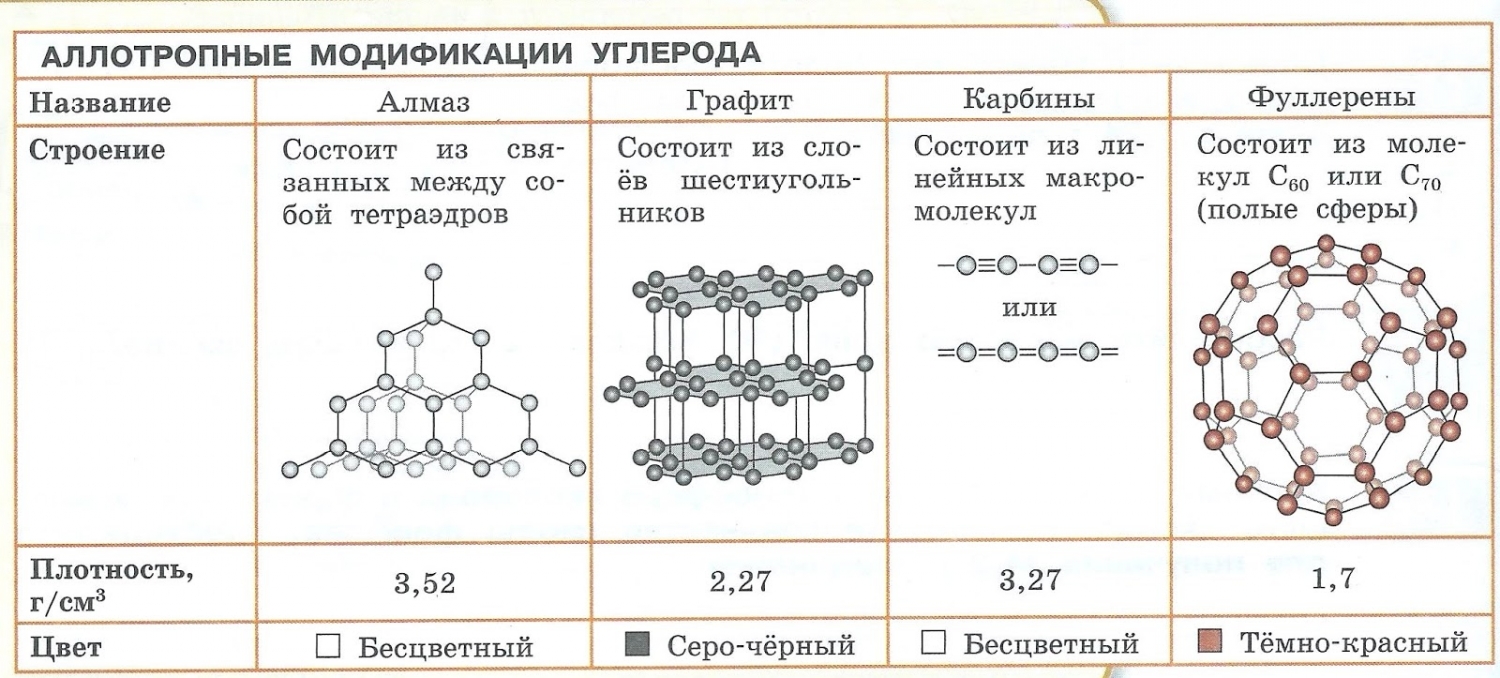
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.

Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
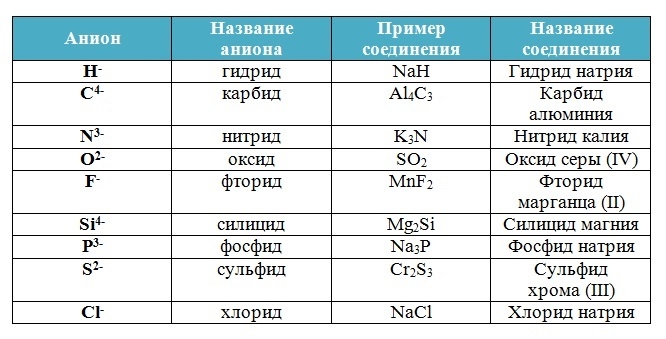
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
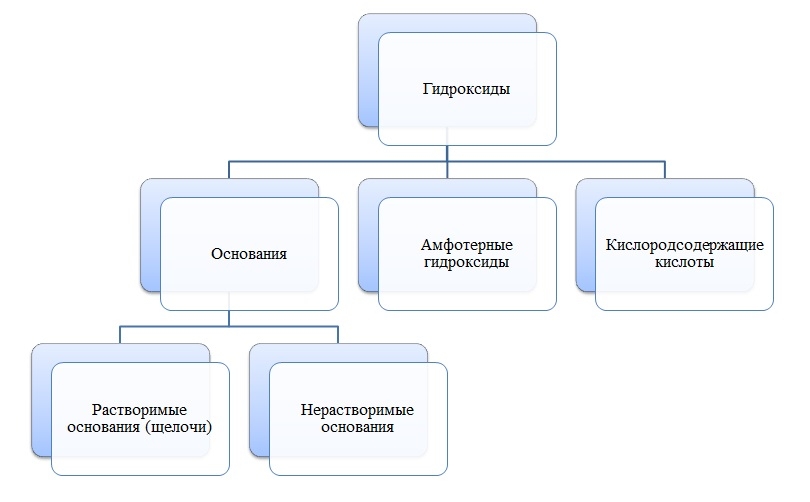
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В химии кроме терминов “атом” и “молекула”
часто употребляется понятие “элемент”. Что общего и чем эти понятия
различаются?
Химический элемент – это атомы одного
и того же вида. Так,
например, все атомы водорода – это элемент водород; все атомы кислорода и ртути
– соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то
есть более 107 химических элементов. Нужно различать понятия “химический
элемент”, “атом” и “простое вещество”
Простые и
сложные вещества
По
элементному составу различают простые вещества, состоящие из атомов
одного элемента (H2, O2,Cl2, P4,
Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3,
OF2, H2SO4, MgCl2,K2SO4).
В настоящее
время известно 115 химических элементов, которые образуют около 500простых
веществ.

Самородное золото — простое
вещество.
Способность
одного элемента существовать в виде различных простых веществ, отличающихся по
свойствам, называется аллотропией.Например, элемент кислород O имеет две
аллотропные формы — дикислород O2 и озон O3с различным
числом атомов в молекулах.
Аллотропные
формы элемента углерод C — алмаз и графит — отличаются строение их
кристаллов.Существуют и другие причины аллотропии.
Название | Аллотропные формы |
Углерод С | Графит
|
Алмаз
|
Сложные
вещества часто называют химическими соединениями, например оксид
ртути(II) HgO (получается путем соединения атомов простых веществ — ртути Hg и
кислорода O2), бромид натрия(получается путем соединения атомов
простых веществ — натрия Na и брома Br2).
Итак,
подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые
– молекулы таких веществ состоят из атомов одного вида. В химических
реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные
– молекулы таких веществ состоят из атомов разного вида. В химических
реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и
“простое вещество”
Отличить понятия “химический элемент” и “простое
вещество” можно при сравнении свойств простых и сложных веществ. Например,
простое вещество – кислород – бесцветный газ, необходимый для дыхания,
поддерживающий горение. Мельчайшая частица простого вещества кислорода –
молекула, которая состоит из двух атомов. Кислород входит также всостав оксида
углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит
химически связанный кислород, который не обладает свойствами простого вещества,
в частности он не может быть использован для дыхания. Рыбы, например, дышат не
химически связанным кислородом, входящим в состав молекулы воды, а свободным,
растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических
соединений, следует понимать, что в эти соединения входят не простые вещества,
а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться
в свободном состоянии и соединяясь, образовывать простые вещества. Простые
вещества состоят из атомов одного элемента. Различие понятий «химический
элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент
может образовывать несколько простых веществ. Например, атомы элемента
кислорода могут образовать двухатомные молекулы кислорода и трехатомные –
озона. Кислород и озон – совершенно различные простые вещества. Этим
объясняется тот факт, что простых веществ известно гораздо больше, чем
химических элементов.
Пользуясь понятием «химический элемент», можно дать
такое определение простым и сложным веществам:
Простыми называют такие вещества, которые
состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые
состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое
соединение»
Сложные
вещества часто называют химическими соединениями.
Осуществите
переход по ссылке и просмотрите опыт
взаимодействия простых веществ железа и серы.
Попробуйте ответить
на вопросы:
1.Чем отличаются по
составу смеси от химических соединений?
2. Сопоставьте
свойства смесей и химических соединений?
3. Какими
способами можно разделить на составляющие компоненты смеси и химического
соединения?
4. Можно
ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная
характеристика смесей и химических
Вопросы для сопоставления смесей с | Сопоставление | |
Смеси | Химические соединения | |
Чем отличаются по составу смеси от | Вещества можно смешивать в любых соотношениях, т.е. | Состав химических соединений постоянный. |
Сопоставьте свойства смесей и | Вещества в составе смесей сохраняют свои свойства | Вещества, образующие соединения, свои свойства не |
Какими способами можно разделить | Вещества можно разделить физическими способами | Химические соединения можно разложить только с |
Можно ли судить по внешним | Механическое смешивание не сопровождается выделением | Об образовании химического соединения можно судить |
Задания для закрепления
I. Поработайте с тренажёрами
Тренажёр №1
Тренажёр №2
Тренажёр №3
Тренажёр №4
Тренажёр №5
II. Решите задание
Из предложенного списка веществ выпишите отдельно простые и сложные вещества:
NaCl, H2SO4, K, S8, CO2, O3, H3PO4, N2, Fe.
Объясните ваш выбор, в каждом из случаев.
III. Ответьте на вопросы
№1
Сколько
простых веществ записано в ряду формул:
H2O, N2, O3, HNO3, P2O5,
S, Fe, CO2, KOH.
№2
К
сложным относятся оба вещества:
А) С (уголь) и S (сера);
Б) CO2 (углекислый газ)и H2O (вода);
В) Fe (железо) и CH4 (метан);
Г) H2SO4 (серная кислота) и H2 (водород).
№3
Выберите
правильное утверждение:
Простые вещества состоят из атомов одного вида.
А) Верно
Б)
Неверно
№4
Для
смесей характерно то, что
А) Они имеют постоянный состав;
Б) Вещества в составе «смеси» не сохраняют свои индивидуальные
свойства;
В) Вещества в «смесях» можно разделить физическими свойствами;
Г) Вещества в «смесях» можно разделить при помощи химической реакции.
№5
Для
«химических соединений» характерно следующее:
А) Переменный состав;
Б) Вещества, в составе «химического соединения»можно разделить
физическими способами;
В) Об образовании химического соединения можно судить по признакам химических
реакций;
Г) Постоянный состав.
№6
В каком
случае идёт речь о железе как о химическом элементе?
А) Железо — это металл, который притягивается магнитом;
Б) Железо входит с состав ржавчины;
В) Для железа характерен металлический блеск;
Г) В состав сульфида железа входит один атом железа.
№7
В каком
случае идёт речь о кислороде как о простом веществе?
А) Кислород — это газ, поддерживает дыхание и горение;
Б) Рыбы дышат кислородом, растворённым в воде;
В) Атом кислород входит в состав молекулы воды;
Г) Кислород входит в состав воздуха.
Классификация строительных материалов
Номенклатура материалов, применяемых в современном строительстве огромна. Чтобы легче ориентироваться в многообразии строительных материалов и изделий, чаще всего их классифицируют по назначению, исходя из условий работы материалов в сооружениях и по технологическому признаку, учитывая вид сырья, из которого получают материал, и способ изготовления (керамические, древесные, каменные, бетонные и железобетонные и т.д.).
Для архитектурного и строительного материаловедения наиболее удобна классификация по назначению: материалы условно делят на две группы: конструкционные и материалы специального назначения.
Иногда встречается разделение материалов на конструкционные, конструкционно-отделочные и отделочные, однако не совсем верно, т.к. классификация не включает огромную группу материалов, например, герметики.
Конструкционные материалы, применяемые главным образом для несущих конструкций, различают следующие:
1) природные каменные;
2) вяжущие[1];
3) искусственные каменные, получаемые:
а) омоноличиванием с помощью вяжущих веществ (бетон, железобетон, растворы);
б) спеканием (керамические материалы и огнеупоры);
в) плавлением (стекло и ситаллы);
4) металлы (сталь, чугун, алюминий, сплавы);
5) полимеры;
6) древесные;
7) композиционные материалы (асбестоцемент, железобетон, полимербетон, фибробетон, стеклопластик и др.).
Строительные материалы специального назначения, необходимые для защиты конструкций от вредных воздействий среды или повышения эксплуатационных свойств и создания комфорта, следующие:
1) теплоизоляционные;
2) акустические;
3) гидроизоляционные, кровельные и герметизирующие;
4) отделочные;
5) антикоррозионные;
6) огнеупорные;
7) материалы для защиты от радиационных воздействий и др.
Понятие свойство материала. Классификация свойств
Важным слагаемым, определяющим качество современной архитектуры, является качество применяемых в строительстве конструкционных и отделочных материалов и изделий. Борьба за повышение качества промышленной продукции неразрывно связана с его оценкой, управлением, контролем и аттестацией. Чтобы управлять качеством, необходимо, прежде всего, научиться его измерять.
Область науки, занимающаяся методами количественной оценки качества продукции, называется квалиметрией (от лат. gualis-какая по качеству и греч. metreo — измеряю). Количественная оценка качества продукции, т.е. определение численных значений показателей качества, применяется в различных областях для выбора оптимального варианта (из некоторого числа сравниваемых), для изучения динамики совершенствования качества, планирования, контроля и аттестации качества продукции и т.п.
Каждый материал обладает комплексом разнообразных свойств, определяющих область его рационального применения и возможность сочетания с другими материалами.
Свойство — способность материала определенным образом реагировать на отдельный или чаще всего действующий в совокупности с другими внешний или внутренний фактор. Действие того или другого фактора обусловлено как составом и строением материала, так и эксплуатационными условиями материала в конструкции зданий и сооружений.
Свойство —характеристика материала (изделия), проявляющееся в процессе его переработки, применения или эксплуатации.
Например, термопластичность жесткого поливиннлхлорадного листа проявляется при изготовлении из него рельефных вакуумформованных облицовочных материалов, удобоукладываемость бетонной смеси — при применении (укладке), а износостойкость керамических плиток для полов — при эксплуатации покрытия.
Простое свойство— свойство материала (изделий), которое нельзя подразделить на другие. Например, масса материала» или «длина изделия» не могут быть представлены другими, более простыми свойствами.
Сложное свойство — такое свойство материала (изделия), которое может быть подразделено на два или большее количество менее сложных или простых свойств. Например, сложное свойство функциональность материала (изделия) определяется совокупностью эксплуатационно-технических и технологических свойств, характеризующих его функцию, назначение, утилитарную способность, т. е. то, для чего он разработан и изготовлен.
Качество— сложное свойство, совокупность всех функциональных и эстетических свойств материала (изделия), обусловливающих его способность удовлетворять определенным требованиям в соответствии с его назначением.
Интегральное качество (соотношение цена/качество)— наиболее сложное свойство материала (изделия), определяемое совокупностью его качества и экономичности.
Общие свойства строительных материалов и изделий можно классифицировать на три основные группы: функциональные, эстетические и экономические. Каждая группа представляет собой сложное свойство, которое, в свою очередь, является совокупностью менее сложных свойств.
Свойства строительных материалов и изделий по их природе классифицируют на три основные группы: — физические, механические и химические.Такое деление широко применяется для изучения методов оценки свойств, для выявления закономерных связей между строением и свойствами веществ и других исследовательских и прикладных целей.
К физическим свойствамматериалов относятся:
· характеристики структур и массы (плотность, пористость, пустотность и др.);
· свойства, определяющие отношение материалов к действию воды, пара, газов (гигроскопичность, водопоглощение, водопроницаемость, влагостойкость, водостойкость, паропроницаемость, газопроницаемость и др.);
· отношение материалов к действию тепла, огня, холода, электрического тока, звуковых волн, излучений (теплопроводность, термостойкость, огнестойкость, огнеупорность, хладостойкость, электропроводность, звукоизолирующая и звукопоглощающая способность, радиационная стойкость и др.);
· отношение к комплексному действию внешней среды, например, одновременного действия воды и холода (морозостойкость) и т.п.
Одни физические свойства материалов проявляются в процессе их производства и переработки (плавкость, ковкость, свариваемость, спекаемость, формуемость, растворимость и др.) их называют технологическими, другие – непосредственно в процессе эксплуатации или через характеристики тех свойств материала, которые определяют его функциональность и эстетичность. Свойства материалов обычно взаимосвязаны. Так, плотность и пористость материала влияют на его весовые и теплотехнические характеристики, поверхностное водопоглощение — на морозостойкость и загрязняемость, воздухопроницаемость — на звукопоглощение материалов и т.п.
Некоторые физические свойства строительных материалов и изделий определяют их важное функциональное свойство — технологичность в применении, характеризующее удобство работы с материалом (изделием) в процессе строительства (его укладки «в дело»). Таковы, например, удобоукладываемость (подвижность и жесткость) бетонной смеси, вязкость, укрывистость и скорость высыхания (пленкообразование) красок, эластичность и гибкость рулонных отделочных и кровельных материалов, сроки схватывания гипсового теста и др.
Для архитектора не менее важны физические свойства материалов, характеризующие их цвет, блеск, фактуру, текстуру и др.
Под механическими свойствами материалов понимают их способность сопротивляться деформированию и разрушению (в сочетании с упругим и пластическим поведением) под действием внешних сил.
К этим свойствам относятся: прочность (при сжатии, растяжении, изгибе, ударе, срезе, кручений и т.д.), твердость, упругость, деформативность, хрупкость, ударная вязкость, пластичность, текучесть, ползучесть, выносливость (усталость), истираемость и др.
Химические свойства материалов характеризуют их способность сопротивляться действию химически агрессивной среды, вызывающей в них обменные реакции и приводящие к разрешению материалов. Это -кислотостойкость, щелочестойкость, стойкость к одновременному действию комплекса химически активных агентов и др.
Кроме этих основных групп свойств можно выделить биологические свойства строительных материалов и изделий, характеризующих их стойкость к действию грибков, микроорганизмов, насекомых и их личинок, и др. Однако все биологические процессы могут быть сведены к химическим.
Следует отметить, что в эксплуатационных условиях строительные материалы и изделия подвергаются, как правило, одновременному действию физических, механических, химических, биологических, физико-химических, химико-биологических и других факторов. Так, например, материалы для наружных ограждающих конструкций здания подвергаются действию различных механических нагрузок, воды, тепла, холода, ультрафиолетового облучения и других факторов внешней среды. Свойства материалов, характеризующие их стойкость к такому одновременному или циклическому действию различных агрессивных (разрушающих) факторов, являются комплексными.Это — долговечность, надежность, совместимость, длительная прочность, износостойкость, теплостойкость, жаропрочность и жаростойкость, кавитационная стойкость, сопротивление коррозии и эрозии.
Санитарно-гигиеническиехарактеристики материалов, в основном, зависят от их химического состава и оцениваются методами санитарно-химического анализа. Исключение составляет характеристика загрязняемости, которая определяется, главным образом, наличием на поверхности материала открытых пор. Санитарно-гигиенические свойства правомерно выделить в отдельную группу, однако обычно они рассматриваются в группе химических свойств.



