Какие свойства может проявлять пероксид водорода
ПЕРОКСИД ВОДОРОДА
Пероксид водорода (тривиальное название — перекись водорода) — соединение состава $H_2O_2$, в котором присутствует пероксидная группа $(-O-O-)^{-2}$. Формально у каждого атома кислорода в этом соединении степень окисления -1, поэтому обычно степени окисления в молекуле расставляют следующим образом: $H_2^{+1}O_2^{-1}$.
Строение молекулы следующее:

Вследствие своей несимметричности молекула является полярной, неограниченно растворяется в воде, спирте и эфире. Имеет высокую вязкость, так как способна образовывать развитую систему водородных связей.
ФИЗИЧЕСКИЕ СВОЙСТВА пероксида водорода
Пероксид водорода представляет собой почти бесцветную (бледно-голубую) вязкую жидкость. Чистый пероксид водорода крайне неустойчив, он обладает способностью к самопроизвольному разложению со взрывом. Неограниченно смешивается с водой, в продажу поступает в виде 30-40%-ного раствора, который называется «пергидроль». Для медицинского применения реализуется раствор с массовой долей пероксида водорода 3%.
В таблице представлены некоторые характеристики пероксида водорода:
| $T_{плав}$ | −0,432 °C |
| $T_{кип}$ | 150,2 °C |
| Плотность | 1,448 г/см$^3$ |
| Цвет | нет |
| Запах | специфический |
| Вкус | «металлический» |
ПОЛУЧЕНИЕ пероксида водорода
В промышленности пероксид водорода изначально получали электролизом серной кислоты или раствора сульфата аммония в серной кислоте. В результате этого процесса образуется надсерная кислота $H_2S_2O_8$, гидролиз которой приводит к образованию пероксида и серной кислоты:
$H_2S_2O_8 + 2H_2O rightarrow H_2O_2 + 2H_2SO_4$
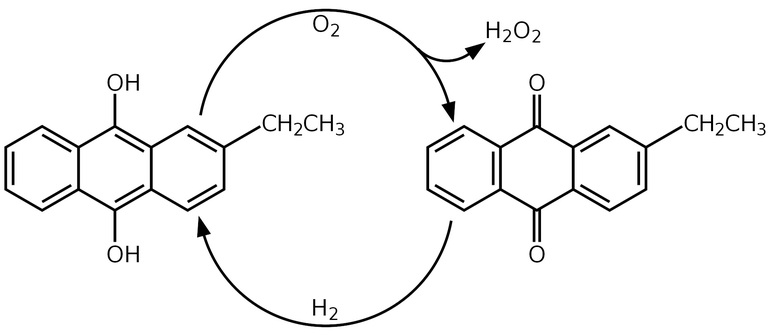
Впоследствии был разработан так называемый «антрахиноновый процесс»; в этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона.
2-этилантрахинон растворяют в смеси эфира и углеводорода (или спирта и углеводорода) и восстанавливают водородом на катализаторе (никеле Ренея или палладии). В результате происходит образование хинола, массовое содержание пероксида водорода в смеси продуктов достигает порядка 1%. По окончании процесса катализатор отделяют, производят разделение продуктов. Хинол снова окисляют до 2-этилантрахинона, а $H_2O_2$ концентрируют перегонкой при пониженном давлении.
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта:
$(CH_3)_2CH-OH + O_2 rightarrow (CH_3)C=O + H_2O_2$
В лаборатории для получения пероксида водорода используют реакцию взаимодействия пероксида бария с соляной кислотой:
$BaO_2 + 2HCl rightarrow BaCl_2 + H_2O_2$
Образующийся хлорид бария осаждают в виде сульфата:
$Ba^{2+} + SO_4^{2-} rightarrow BaSO_4downarrow$
Часто в различных источниках можно обнаружить информацию о том, что получение пероксида водорода в лаборатории проводят путём обработки пероксида бария серной кислотой:
$BaO_2 + H_2SO_4 rightarrow BaSO_4downarrow + H_2O_2$
Однако на практике данный метод не используется. Причина состоит в том, что осадок сульфата бария образуется прямо на зёрнах пероксида бария, в результате реагент как бы покрывается «коркой» из нерастворимого продукта, что сильно замедляет реакцию и существенно снижает выход продукта.
ХИМИЧЕСКИЕ СВОЙСТВА ПЕРОКСИДА ВОДОРОДА
а) Кислотно-основные свойства
Пероксид водорода проявляет слабые кислотные свойства ($K_a = 1.78 cdot 10^{-12}$) и диссоциирует по двум ступеням:
$H_2O_2 leftrightarrow H^+ + OOH^-$
$ OOH^- leftrightarrow H^+ + O_2^{2-}$
Пероксид водорода является чуть более сильной кислотой, чем вода. Пероксиды металлов и аммония можно рассматривать как «соли» этой слабой кислоты. В присутствии щёлочи кислотно-основное равновесие в растворе смещается в сторону образования гидропероксид-ионов $OOH^-$.
Так как в водных растворах $H_2O_2$ ведет себя как очень слабая кислота, реакцию взаимодействия, например, гидроксида бария с пероксидом водорода, приводящую к образованию пероксида бария $BaO_2$, можно рассматривать как реакцию нейтрализации:
$Ba(OH)_2 + H_2O_2 = BaO_2 + 2H_2O$
б) Окислительно-восстановительные свойства
В окислительно-восстановительных реакциях пероксид водорода может проявлять как окислительные, так и восстановительные свойства, в зависимости от условий. Это связано с тем, что оба атома кислорода в молекуле $H_2O_2$ находятся в промежуточной степени окисления -1. Стоит отметить, однако, что наиболее характерными для пероксида водорода являются окислительные свойства. Восстановителем пероксид водорода может быть только в реакциях с сильными окислителями.
Принимая электрон на внешний уровень (выступая в качестве окислителя), кислород переходит в степень окисления -2:
$H_2O_2 + 2KI + H_2SO_4 = I_2 downarrow + K_2SO_4 + 2H_2O$
$H_2O_2 + Na_2SO_3 = Na_2SO_4 + H_2O$
$Mn(OH)_2 + H_2O_2 = MnO_2 + 2H_2O$
$PbS + 4H_2O_2 = PbSO_4 + 4H_2O$
$H_2O_2 + SO_2 = H_2SO_4$
$H_2O_2 + KNO_2 = KNO_3 + H_2O$
$H_2O_2 + 2HCl + 2FeCl_2 = 2H_2O + 2FeCl_3$
$H_2O_2 + 2HI = 2H_2O + I_2downarrow$
$3H_2O_2 + 10NaOH + 2CrCl_3 = 8H_2O + 6NaCl + 2Na_2CrO_4$
$5H_2O_2 + I_2 = 4H_2O + 2HIO_3$
$H_2O_2 + H_2SO_4 + 2FeSO_4 = 2H_2O + Fe_2(SO_4)_3$
$3H_2O_2 + 2KOH + 2K[Cr(OH)_4] = 8H_2O + 2K_2CrO_4$
$4H_2O_2 + H_2S = H_2SO_4 + 4H_2O$
$H_2O_2 + H_2SO_4 + Cu = CuSO_4 + 2H_2O$
$4H_2O_2 + ZnS = 4H_2O + ZnSO_4$
$3H_2O_2 + 2NH_3 = 6H_2O + N_2uparrow$
Отдавая электрон, $O^{-1}$ переходит в степень окисления 0, превращаясь в молекулярный кислород $O_2$ и проявляя восстановительные свойства, например:
$2KMnO_4 + 5H_2O_2 + 3H_2SO_4 = 5O_2 uparrow + 2MnSO_4 + K_2SO_4 + 8H_2O $
$Cl_2 + H_2O_2 + 2NaOH = 2NaCl + 2H_2O + O_2uparrow$
$2AgNO_3 + H_2O_2 = 2Ag + O_2uparrow + 2HNO_3$
$KIO_4 + H_2O_2 = KIO_3 + H_2O + O_2uparrow$
$3H_2O_2 + 6NaOH + 2AuCl_3 = 6H_2O + 3O_2uparrow + 6NaCl$
$5H_2O_2 + 2HIO_3 = 6H_2O + 5O_2uparrow + I_2downarrow$
$H_2O_2 + Fe = O_2uparrow + H_2Fe$
$3H_2O_2 + K_2Cr_2O_7 + 4H_2O_2 = Cr_2(SO_4)_3 + K_2SO_4 + 3O_2uparrow + 7H_2O$
$H_2O_2 + Ag_2O = 2Agdownarrow + O_2uparrow + H_2O$
$2H_2O_2 +Ca(ClO)_2 = CaCl_2 + 2O_2uparrow + 2H_2O$
$H_2O_2 + 2KMnO_4 = 2MnO_2downarrow + 2O_2uparrow + 2KOH$
$H_2O_2 + 2AgNO_3 + 2NaOH = 2 NaNO_3 + 2Agdownarrow + O_2uparrow + 2H_2O$
$H_2O_2 + HClO = H_2O + HCl + O_2uparrow$
$H_2O_2 + Cl_2 = 2HCl + O_2uparrow$
Полезно сравнить потенциалы полуреакций с участием пероксида водорода в кислой и щелочной среде:
| Окислитель | Восстановитель | ||
| Полуреакция | $E^circ$, В | Полуреакция | $E^circ$, В |
| $H_2O_2 + 2H^+ + 2 bar{e} = 2H_2O$ | +1,776 | $O_2+ 2H^+ + 2bar{e} = H_2O_2$ | +0,695 |
| $H_2O_2 + 2 bar{e} = 2OH^-$ | +0,88 | $O_2 + 2H_2O + 2bar{e} = H_2O_2 + 2OH^-$ | -0,146 |
Из приведённых в таблице данных можно сделать вывод о том, что как окислитель пероксид водорода сильнее в кислой среде, а как восстановитель — в щелочной.
УСЛОВИЯ ХРАНЕНИЯ
Пероксид водорода хранят вдали от солнечного света в закрытой тёмной посуде (преимущественно пластиковой) с добавлением ингибиторов разложения, при транспортировке избегают встряхиваний и других механических воздействий, поскольку все эти факторы приводят к разложению перекиси водорода.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Работая в лаборатории с концентрированным раствором пероксида водорода, соблюдайте меры предосторожности по работе с сильными окислителями. Перекись водорода при попадании на кожу и слизистые вызывает сильные ожоги. В высоких концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Реакция разложения пероксида водорода:
$2H_2O_2 xrightarrow []{kat} 2H_2O + O_2uparrow$
катализируется некоторыми металлами ($Pt, Ag$), диоксидом марганца $MnO_2$, добавлением следовых количеств щёлочи или пыли. Особую осторожность следует проявлять при работе с очень концентрированными растворами пероксида водорода или с чистым $H_2O_2$: все операции проводят в «беспылевых» условиях и в отсутствие ионов металлов.
ПРИМЕНЕНИЕ ПЕРОКСИДА ВОДОРОДА
Пероксид водорода находит широкое применение во многих областях.
В промышленности его используют в качестве отбеливателя в текстильном и кожевенном производстве и при изготовлении бумаги, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. Благодаря окислительным свойствам перекись водорода используется как ракетное топливо.
Применяется в аналитической химии и в катализе, а также для синтеза высокоэффективных отбеливающих агентов (пероксоборатов, пероксокарбонатов). В органическом синтезе пероксид водорода применяют для получения эпоксидов, пропиленоксида и капролактонов для стабилизаторов поливинилхлорида и полиуретанов. Органические пероксосоединения, применяемые в качестве вулканизаторов, отвердителей, инициаторов процессов полимеризации, также получают с использованием пероксида водорода. В качестве эффективного окислителя $H_2O_2$ выступает в синтезе особо чистых реактивов — гидрохинона, фармацевтических препаратов и пищевых продуктов.
Разбавленные растворы пероксида водорода применяются в медицине для обеззараживания небольших поверхностных ран, поскольку он обеспечивает очищение и обладает антисептическими свойствами. В пищевой промышленности он используется для дезинфекции технологических поверхностей оборудования и упаковки. Кроме того, его применяют для обесцвечивания волос, отбеливания зубов. 3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшихся рыб, очистки аквариумов от нежелательной флоры.
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ничто не красит женщину так, как перекись водорода (Народная мудрость)
Мальчики и девочки, папы и мамы, бабушки и дедушки, химички и химичи, составители и эксперты ЕГЭ (особенно!) читайте внимательно серию статей об участии пероксида водорода в ОВР. Иначе, на ЕГЭ может случиться конфуз, когда вы не сможете написать реакции в 30-м и 32-м заданиях, не решится 34-я задача, будут непонятны многие реакции в тестовых заданиях типа 8, 9, 10, 14, 17, 21.
Химический портрет пероксида водорода
Пероксид водорода H2O2 — химическое соединение водорода с кислородом. Структурная формула Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна и обусловливает неустойчивость молекулы. Чистый пероксид водорода разлагается (со взрывом) на воду и кислород. В разбавленных водных растворах пероксид водорода более устойчив.
► Впервые пероксид водорода получил в 1818 г. французский химик Л.Ж. Тенар, действуя охлажденной соляной кислотой на пероксид бария
BaO2 + 2HCl → BaCl2 + H2O2
Пероксид бария получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария
BaCl2 + Ag2SO4 → 2AgCl↓ + BaSO4↓
Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту, поскольку при этом сульфат бария остается в осадке, поскольку карбонат бария также нерастворим
BaO2 + H2SO4 → BaSO4↓ + H2O2
Атом кислорода в пероксиде водорода имеет степень окисления (-1), поэтому в окислительно-восстановительных реакциях пероксид может выполнять функцию как окислителя, так и восстановителя
► Пероксид водорода — сильный окислитель, легко отдает атом кислорода. При действии безводной и концентрированной Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются.
Обратите внимание! Если пероксид — окислитель, то продуктом восстановления кислорода будет вода (Н2О). На шкале степеней окисления окислитель «падает вниз»
► H2O2 обладает свойствами слабого восстановителя.
Обратите внимание! Если пероксид — восстановитель, то продуктом его окисления будет свободный кислород (О2). На шкале степеней окисления восстановитель «поднимается вверх»
В следующих статьях вас ожидает много ОВР с пероксидом водорода. Это будут не только классические, но и нестандартные, очень сложные реакции, вызывающие дрожь даже у мудрых экспертов ЕГЭ. Я проведу анализ каждой реакции и обязательно научу вас писать все уравнения ОВР. Со мной не пропадете! Если будете внимательно читать статьи, работать над заданиями и выполнять все рекомендации — высокий балл на ЕГЭ будет вам заслуженной наградой!
Вы не умеете писать ОВР методом полуреакций?! Спокойствие, только спокойствие! Самый лучший в мире репетитор в полном расцвете сил поможет вам! Заходите ко мне на сайт, посетите страницу «Окислительно-восстановительные реакции». И будет вам счастье!
А пока — пока! Успехов и удачи! До встречи на полях Яндекс Дзен! Не забывайте подписаться на канал и поставить лайк!
Вы хотите сдавать ЕГЭ по химии и биологии? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции. Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Пишите мне в WhatsApp +7(903)186-74-55, я отвечу вам обязательно.
Репетитор по химии и биологии кбн В.Богунова

Строение молекулы и физические свойства
Перекись водорода относится к простейшим представителям группы пероксидов. Её получают в промышленности и лаборатории несколькими способами. Структурная формула перекиси водорода обозначается H2O2. Степень окисления у атомов кислорода -1.

Молекула вещества представлена двумя OH-группами, которые связаны пероксидным -О-О-мостиком и лежат в разных плоскостях. Угол между ними меняется в зависимости от температуры, концентрации раствора и других условий.
Пероксид представлен в виде бесцветной жидкости с «металлическим» вкусом и специфическим запахом. Вязкая консистенция обусловлена развитой системой водородных связей в молекулярной структуре.
Основные физические свойства перекиси водорода:
- Температура кипения: 150,2°C.
- Температура замерзания: -0,432°C.
- Плотность: 1,46 г/см3.
Молекула вещества является полярной, поскольку её строение несимметричное. Соединение может неограниченно растворяться в воде, эфире и спирте. Чистое вещество неустойчиво и способно самопроизвольно разлагаться со взрывом.
Химические особенности
Поскольку оба атома кислорода находятся в промежуточной степени окисления -1, антисептическое средство может проявлять как окислительные, так и восстановительные свойства. Оно участвует в реакциях окисления нитритов до нитратов и выделении иодов из иодидов металлов. Также вещество может расщеплять ненасыщенные соединения.
Перекись обладает слабыми кислотными свойствами, поэтому она диссоциирует по двум ступеням:
- H2O2↔H++OOH−
- OOH−↔H++O22−
Вещество по степени кислотности немного сильнее H2O. Некоторые пероксиды металлов можно рассматривать как его соли. В кислой среде перекись служит окислителем, а в щелочной — восстановителем.

Реагируя с более сильными окислителями, например, с солями серебра и золота, водород служит восстановителем и окисляется до атомарного кислорода. В реакции с нитритом калия вещество выступает окислителем. Если молекула принимает электрон на внешний уровень, тогда степень окисления кислорода меняется на -2; если она его отдаёт, тогда соединение становится восстановителем. Окисление органических веществ пероксидом обычно проводят в уксусной кислоте.
Способы получения вещества
Сначала пероксид водорода получали в промышленности с помощью электролиза серной кислоты или раствора сульфата аммония в H2SO4. В результате реакции получалась надсерная кислота. После гидролиза вещества образовывались пероксид и серная кислота.
В середине XX века открыли новый способ получения перекиси водорода. Антрахиноновый процесс был разработан компанией BASF. При этом методе водород окисляется кислородом воздуха, после чего образуются антрахиноны и пероксид водорода. Реакцию проводят в растворе алкилантрагидрохинонов в бензоле, который служит катализатором. В него также добавляют вторичные спирты. На завершительной стадии процесса катализатор убирают, а из получившейся смеси продуктов выделяют пероксид водорода путём перегонки при сниженном давлении.

В лабораторных условиях вещество получают с помощью пероксида бария и соляной кислоты. Уравнение взаимодействия соединений: BaO2+2HCl → BaCl2+H2O2. Получившийся хлорид бария осаждают в виде сульфата. Пероксид водорода также можно извлечь при помощи каталитического окисления изопропилового спирта.
В некоторых источниках есть информация, что нужное вещество может образоваться при взаимодействии пероксида бария с серной кислотой, однако такую технологию обычно не используют. Поскольку осадок сульфата бария формируется на зёрнах его пероксида, реагент покрывается нерастворимой оболочкой, которая замедляет реакцию и выход нужного продукта.
Меры предосторожности
Во время работы с концентрированным раствором перекиси необходимо соблюдать меры безопасности. Хотя вещество нетоксично, при попадании в дыхательные пути или на кожный покров и слизистые оно вызывает сильные ожоги. Недостаточно чистый пероксид высокой концентрации может быть взрывоопасен. Всю работу с веществом нужно проводить в «беспылевых» условиях и при отсутствии ионов металлов.
Растворы перекиси водорода относятся к 3-му классу опасности. Вещество может вызывать деструктивные изменения, которые схожи с действием щелочей. Летальная доза пергидроля (название раствора концентрации 30%) составляет 50−100 мл.
Упаковку с аптечным средством необходимо хранить в тёмном месте. При транспортировке нужно избегать встряхивания вещества и других механических воздействий, которые могут привести к его разложению.
Сферы использования
Пероксид водорода может быть разной концентрации. Поскольку растворы обладают различными свойствами, их часто используют в промышленности и быту:
- Вещество применяется при создании бумаги, дезинфицирующих средств и в текстильном производстве в качестве отбеливателя.
- За окислительные свойства пероксид водорода используют как ракетное топливо.
- В аналитической химии при изготовлении пористых материалов средство применяют в качестве пенообразователя.
- В промышленности простейший представитель пероксидов зарекомендовал себя как катализатор и гидрирующий агент.
- В аквариумистике 3%-й раствор помогает очистить резервуары для воды, бороться с паразитами, а также способен оживить задохнувшихся рыб.
- В пищевой промышленности пероксид используется для дезинфекции упаковок для различных напитков и поверхностей оборудования, с которым контактируют продукты.
- В сфере быта средство помогает вывести пятна марганцовки на предметах мебели и текстиле, а также в качестве домашнего антисептика.
Перекись широко используется в области косметологии. Ею обесцвечивают волосы и отбеливают зубы. Поскольку процесс основан на окислении, локоны часто портятся, поэтому вещество не советуют применять обладателям тонких и повреждённых прядей. С зубами не наблюдается дефектов, поскольку с прозрачной эмалью эффект отбеливания достигается за счёт разницы в отражении света дентином.
Применение в области медицины
Широкое применение перекиси водорода нашли в медицине. Средство с бактерицидным механизмом действия предназначено для внешнего использования. Перед применением необходимо тщательно изучить инструкцию к лекарству.
Формы выпуска пероксида водорода:

- Раствор разведённый 1−3%. Применяется для полоскания полости рта и в качестве препарата местного действия.
- Раствор концентрированный 27−31%. Это средство используется редко и только по назначению специалиста. Обычно для обработок его разводят до 3%-го раствора. Лекарство предназначено для лечения заболеваний кожного покрова.
- Гидроперит. Лекарство представлено соединением 35%-го раствора пероксида с карбамидом. Выпускается в форме таблеток. В таком виде препарат легче перевозить и хранить. Чтобы сделать раствор, необходимо растворить в воде 2 таблетки на 100 мл жидкости.
Препаратом лечат гнойные раны и воспалённые слизистые оболочки. Средство используется при носовых и капиллярных кровотечениях, а также для промывки и глубокой очистки ран. Медицинским раствором обрабатывают ротовую полость и горло при ангине, стоматите или тонзиллите. Средство также избавляет кожный покров от пигментных пятен. С помощью лекарства убирают серные пробки при чистке ушей. Препарат применяется в гинекологии для лечения различных женских патологий.
При лёгкой механической очистке ватный тампон смачивают в 3%-м растворе и обрабатывают им поражённые участки кожи. Для компрессов применяют перекись с концентрацией 1 процент. Продолжительность процедуры не должна превышать 30 мин. Для обработки участков кожи с пигментными пятнами используют пергидроль. Ротовую полость или органы половой системы обрабатывают 0,25%-м раствором.
Применение перекиси водорода противопоказано при индивидуальной непереносимости вещества. В редких случаях негативные последствия могут проявиться в жжении во время процедуры и аллергии в виде красных пятен на коже. При длительной терапии после обработок ротовой полости может возникнуть гипертрофия сосочков языка. Если соблюдать дозировку и схему применения перекиси водорода в соответствии с инструкцией, тогда получится избежать побочных действий.
