Какие свойства молекул воды характеризуют воду как растворитель

Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
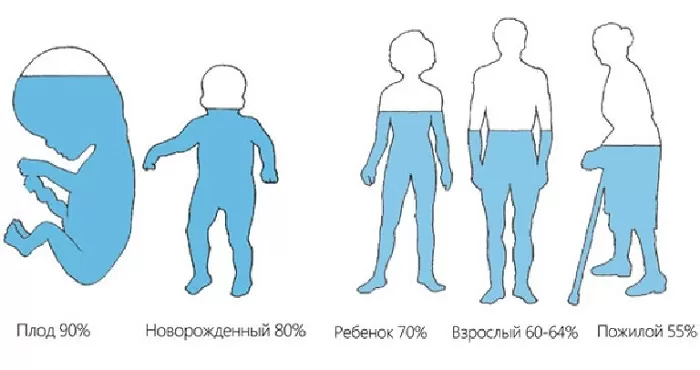
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
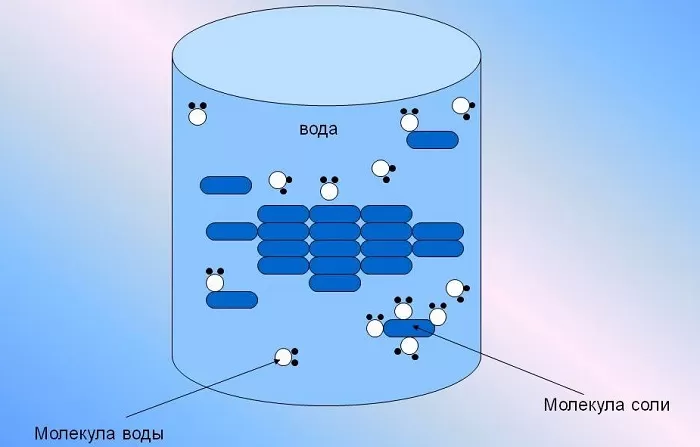
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.

Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.

Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.

В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.

Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
вода – растворитель, самый распространенный в природе
свойства воды как растворителя:
— высокая диэлектрическая проницаемость — вода активно растворяет вещества с полярными молекулами
— образование водородных связей между частицами в-ва и молекулами воды
— низкая вязкость воды
свойства воды как растворителя определяются строением молекул воды
строение молекулы воды
формула молекулы воды H2O
H —
О(II)-2 хим.связь одинарная полярная ковалентная, Ð105°
/ молекула имеет угловую форму _ —
H+ —
молекула в виде диполя: 2 неподеленные е-пары атома кислорода образуют (-)полюс +
2 катиона водорода образуют (+)полюс +
диполи воды активно растворяют вещества с полярными молекулами:
полярные — молекулы неорганических веществ, имеющие или ионные связи, или полярные ковалентные связи
полярные — молекулы органических веществ, имеющие полярные функциональные группы
полярные молекулы имеют свойства диполей
электрический диполь — два точечных заряда, одинаковые по величине и противоположные по знаку,
находящиеся на расстоянии l друг от друга, которое называется плечом диполя
Р = q × l — электрический момент диполя
различают молекулы с постоянной полярностью – жесткие диполи, и
молекулы с непостоянной полярностью – индуцированные диполи
диполи воды вызывают электролитическую диссоциацию растворяемых в-в или распад в-в на ионы:
растворяемые в-ва должны иметь ионные или полярные ковалентные связи
вокруг частиц растворяемого в-ва диполи воды образуют гидратные оболочки
гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва
ПР: HCl полярная ковалентная связь
в-во находится в растворенном виде,
в электрическом поле диполя H+Сl- диполи Н2О располагаются упорядоченно,
взаимодействие диполей Н+Cl- и упорядоченно расположенных диполей Н2О поляризует связь Н+-Cl- до ионной
взаимодействие диполей Н+-Сl- и упорядоченно расположенных диполей Н2О ослабляет связи Н+-Cl-,
образуются ионы Cl-_и Н+ (свободно не существуют)
физическая фаза ®химическая фаза:
в электрическом поле ионов Н+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Сl- и ионы гидроксония Н3О+ (донорно-акцепторная связь)
NaCl ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и Cl- и диполей Н2О ослабляет связи Na+-Cl-,
образуются ионы Na+ и Cl- (одновременно идет растворение и диссоциация)
физическая фаза ®химическая фаза:
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и Сl-
NaОН ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и ОН- и диполей Н2О ослабляет связи Na+-ОН-,
образуются ионы Na+ и ОН- (одновременно идет растворение и диссоциация)
физическая фаза ®химическая фаза:
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и гидроксид-ионы ОН-
гидрофильное и гидрофобное взаимодействие веществ с водой
вещества по растворимости в воде делятся на гидрофильные и гидрофобные
— гидрофильные хорошо растворяются в воде
состоят из ионов и полярных молекул или молекул с полярными функциональными группами
варианты гидрофильного взаимодействия – ионно-дипольное ПР: растворение NaCl
диполь-дипольное ПР: растворение HCl
образование водородных связей ПР: растворение С2Н5ОН
— гидрофобные плохо растворяются в воде
состоят из неполярных молекул
гидрофобное взаимодействие – «отталкивание» молекул воды от молекулы в-ва
— дифильные, у которых молекулы имеют и гидрофильные, и гидрофобные группы
дифильные молекулы при растворении в воде деформируются так,
чтобы контакт с водой гидрофобных групп уменьшился, а контакт с водой гидрофильных групп увеличился
ПР: в воде белковые молекулы приобретают форму глобул
внутри глобул гидрофобные группы, снаружи глобул гидрофильные группы
влияние на растворимость природы компонентов, температуры и давления
факторы, влияющие на растворимость в-в:
— природа растворителя
одно в-во в разных растворителях растворяется по-разному
289) природа в-ва.полярные растворители и неполярные растворители.
различают полярные растворители и неполярные растворители
ПР: вода, спирт – полярные растворители
у полярных растворителей полярные молекулы
полярные растворители сильно поляризуются и имеют высокую диэлектрическую проницаемость e
в полярных растворителях хорошо растворяются в-ва ионной структуры с ионными связями и
молекулярной структуры с полярными ковалентными связями
в неполярных растворителях хорошо растворяются в-ва молекулярной структуры с неполярными ковалентными..
— природа в-ва
в одном растворителе разные в-ва растворяются по-разному
некоторые в-ва имеют низкую растворимость
ПР: твердые в-ва с прочной атомной кристаллической решеткой практически нерастворимы
в-ва с ионной и полярной ковалентной связью хорошо растворяются в полярных растворителях
в-ва с неполярной ковалентной связью плохо растворяются в полярных растворителях
ПР:
одна из причин высокой растворимости в-в – образование связей между частицами в-ва и растворителя
ПР: при растворении спирта в воде образуются водородные связи между молекулами воды и спирта
ПР: при растворении AgCl в водном растворе NH3 образуются комплексы [Ag(NH3)4]+
— температура и давление, присутствие в растворе других в-в..
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
внешние факторы – температура, давление, присутствие других в-в..
график зависимости растворимости от температуры – кривая растворимости..
растворимость твердых в-в в жидкостях
факторы, влияющие на растворимость твердых в-в в жидкостях:
— природа растворителя..
— природа твердого в-ва..
— температура и давление
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
если растворение эндотермический процесс –
при нагревании растворимость твердых в-в в жидкостях увеличивается
если растворение экзотермический процесс –
при нагревании растворимость твердых в-в в жидкостях уменьшается
объем системы при растворении твердых тел в жидкостях не меняется –
повышение давления не влияет на растворимость твердых в-в в жидкостях
— присутствие в растворе других в-в..
Дата добавления: 2016-11-18; просмотров: 2615 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Содержание:Необходимо различать, с одной стороны, воду и, с другой растворенные в ней вещества, обусловливающие химический, состав и минерализацию воды. Геологические судьбы растворителя и растворенного вещества могут идти своими, обособленными путями. Вода чаще всего попадает в земную кору и из атмосферы, а растворенное вещество заимствуется в основном из горных пород и почв. Возьмем воду в чистом виде, без солей, и рассмотрим те ее особенности строения и свойства, от которых зависит растворяющая способность, воды.
Состав воды. Вода — химическое соединение кислорода и водорода, которое принято обозначать формулой Н2О. На самом деле вода имеет более сложный состав. Обычный молекулярный вес воды 18, но встречаются молекулы с молекулярным весом 19, 20, 21, 22. Эти молекулы состоят из более тяжелых атомов водорода и кислорода, имеющих атомные веса соответственно более 1 и 16, У водорода два стабильных изотопа: протий (Н) и дейтерий (D); отношение Н: D =6800. Кроме того, известен тритий (Т) — радиоактивный изотоп с периодом полураспада 12,5 лет. У кислорода три стабильных изотопа: О16, О17, О18. Молекулы воды могут состоять из различных устойчивых изотопов Н2О16, НDO16, D2О16, Н2О18, НDO18, D2О18, Н2О17, НDO18, D2О17.
Изотопная разновидность воды, в которой протий замещен дейтерием, называется тяжелой водой. Однако в природе до сих пор не открыта ни собственно легкая, ни тяжелая вода. Тяжелую воду в настоящее время приготовляют искусственно в больших количествах для различных технических целей Тяжелая вода отличается от обычной не только физическими свойствами, но и физиологическим воздействием на организм.
Особый геохимический и практический интерес представляет дейтерии (D). Электронная оболочка атома дейтерия, так же как и протия, состоит из одного электрона, но ею ядро — дейтон— примерно вдвое тяжелее и состоит из двух частиц — протона и нейтрона. Дейтерий применяется в современной ядерной технике как взрывчатое вещество. В будущем он будет использоваться как горючее в термоядерных энергетических установках. Запасы термоядерной энергии дейтерия, имеющиеся в воде земных океанов, примерно в сто миллионов превосходят запасы энергии ископаемого топлива (угля, нефти, газа, торфа).
Различные по генезису природные воды имеют неодинаковый изотопный состав. Одной из главных причин, создающих дифференциацию изотопов в природных водах, является процесс испарения Упругость паров тяжелой воды несколько ниже упругости паров обычной, а так как процесс испарения является основным фактором круговорота воды, то обогащение вод тяжелыми изотопами в местах испарения и обеднение ими в местах кон денсации может вызвать заметную разницу в плотности воды.
Установлена следующая закономерность распределения изотопов водорода в поверхностных и атмосферных водах:
1. Пресные поверхностные воды рек, озер и других водоемов, наполняющихся главным образом за счет атмосферных осадков, содержат дейтерия меньше, чем океанические воды.
2 Изотопный состав пресных поверхностных вод определяется физико-географическими условиями их нахождения.
Строение воды.Еще в двадцатых годах нашего века на основе учения о полярной структуре молекул воды были разработаны простейшие представления об ассоциации молекул в жидкой воде как результате взаимодействия диполей. Эти представления заключаются в следующем.
Одной из особенностей строения молекулы воды является несимметричное расположение атомов водорода вокруг атома кислорода они расположены не по прямой, проведенной через центр атома кислорода, а под некоторым углом (рис 1). Центры ядер атомов водорода расположены на расстояние 0,95 А от центра атома кислорода. Угол между линиями, соединяющими центры атомов кислорода и водорода, равен 1050. Связь между атомами кислорода и водорода в молекуле воды осуществляется электронами. Вследствие несимметричности распределения электрических зарядов молекула воды обладает полярностью, т.е. имеет два полюса — положительный и отрицательный, которые так же, как и магнит, создают вокруг нее силовые ноля.
Таким образом, для молекул воды характерно дипольных: строение (диполи). Их изображают в виде овалов, полюса которых имеют противоположные по знаку электрические заряды. При достаточном сближении молекулы воды начинают действовать друг на друга своими силовыми нолями. При этом положительно заряженный полюс одной молекулы притягивает отрицательно заряженный полюс другой. В результате могут получиться агрегаты из двух, трех и, по-видимому, более молекул (рис. 2).
Такие группировки молекул воды называются дигидролями (Н2О)2 и тригидролями (Н2О) . Следовательно, в воде одновременно присутствуют одиночные (моногидроли), двойные я тройные молекулы. Содержание их меняется в зависимость от температуры. Во льдe доминируют тройные молекулы, обладающие наибольшим объемом. При повышении температуры скорость молекул возрастает, и силы притяжения между молекулами оказываются недостаточными для удержания их друг около друга. В жидком состоянии вода представляет смесь дигидролей, тригдролей и моногпдролей. По мере увеличения температуры тройные и двойные молекулы распадаются, и при 10О°С вода состоит главным образом из моногидролей.
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел.
1. При нагревании воды от 0 до 4°С объем воды не увеличивается, а уменьшается, и максимальная плотность ее достигается не в точке замерзания (00С), а при 40С (точнее 3,980).
2. Вода при замерзании расширяется, а не сжимается, как все другие тела, плотность ее уменьшается.
3. Температура замерзания воды с увеличением давления понижается, а не повышается, как этого следовало бы ожидать.
4. Удельная теплоемкость воды чрезвычайно велика по сравнению с теплоемкостью других тел.
5. Вследствие высокой диэлектрической постоянной вода обладает большей растворяющей и диссоциирующей способностью, чем другие жидкости.
6. Вода обладает самым большим поверхностным натяжением из всех жидкостей — 75 эрг/см2 (глицерин — 65, аммиак — 42, а все остальные ниже 30 эрг/см2), за исключением ртути — 436 эрг/см2.
Поверхностное натяжение и плотность определяют высоту, на которую может подняться жидкость в капиллярной системе при фильтровании через пористые среды.
Причина перечисленных аномальных свойств воды заключается в особенностях строения ее молекул.
Вода как растворитель. Если поместить воду во внешнее электрическое поле, то молекулы ее иод действием поля стремятся расположиться в пространстве так, как показано на
Это явление называется ориентационной поляризацией, которой обладают вещества с полярными молекулами. Высокая полярность молекул воды является одной из важнейших причин ее высокой активности при многих химических взаимодействиях. Она же служит причиной и электролитической диссоциации в воде, солей, кислот и основании. С нею связана также и растворимость электролитов в воде.
Растворение есть не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Вода обладает способностью растворять многие вещества, т. е. давать с ними однородные физико-химические системы переменного состава (растворы). Растворенные в природных водах, соли находятся: преимущественно в диссоциированном состоянии, в виде ионов. В твердом кристаллическом состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют. Так, например, в галите, как эта определено рентгеновским структурным анализом, каждый ион Na+ окружен шестью ионами С1-, а каждый нон С1- окружен шестью ионами натрия. Ионы взаимодействуют между собой, они притягивают друг друга (ионная связь).
В чем состоит механизм растворения? Молекулы воды в силу особенностей своего строения и возникающего из-за этого вокруг них силового поля обладают способностью притягивать молекулы других веществ. Процесс растворения заключается как раз во взаимодействии частиц растворяющегося вещества с частицами воды. При соприкосновении с водой какой-нибудь соли ноны, образующие ее кристаллическую решетку, будут притягиваться противоположно заряженными частицами молекул воды. Например, при погружении в воду кристаллов галита ион натрия (катион) будет притягиваться, отрицательным полюсом, а ион хлора (анион) — положительным полюсом молекулы воды (рис. 4). Чтобы ионы кристаллической решетки оторвались друг от друга и перешли в раствор, необходимо преодолеть силу притяжения этой решетки. При растворении солей такой силой является притяжение ионов решетки молекулами воды, характеризумое так называемой энергией гидратации. Если при этом энергия гидратации будет по сравнению с энергией кристаллической решетки достаточно велика, ионы будут оторваны от последней и перейдут в раствор.
В зависимости от природы вещества при его растворении обычно происходит выделение или поглощение тепла. Ионы растворенного вещества притягивают и удерживают вокруг себя определенное число молекул воды, которые образуют оболочку, называемую гпдратной. Таким образом, в водном растворе ионы являются гидратированными, т. е. химически связанными с молекулами воды
.
При кристаллизации многих солей часть гидратной воды захватывается кристаллическими решетками. Подобную кристаллизационную воду содержит гипс СаSO4*2H2O, мирабилит Na2SO4* 10H2O, бишофит MgCl2*6H2O, астраханит Na2SO4*MgSO4*4H2O, сода Na2СO3*10H2O. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами.
Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся почти все соли, многие минеральные кислоты, основания щелочных и щелочноземельных металлов. Диссоциация сильного электролита, например NаС1, изображается уравнением
NаС1 Nа++С1-
В кристалле галита нет молекул NаС1. При растворении кристаллическая структура разрушается, гидратированные ионы переходят в раствор. Молекулы в растворе отсутствуют. Поэтому лишь условно можно говорить о недиссоциированных молекулах растворов сильных электролитов. Это скорее будут ионные пары (Nа++С1-), т.е.
находящиеся близко друг около друга противоположно заряженные ионы (сблизившиеся до расстояния, равного сумме радиусов ионов). Это якобы недиссоциированные молекулы, или, как их называют, квазимолекулы.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы. К ним относятся почти все органические кислоты, некоторые минеральные кислоты, например Н2СО, Н2S, Н2SіО3, многие основания металлов. К слабым электролитам относится вода.
Кроме электролитов в растворе находятся и неэлектролиты, молекулы которых хотя и имеют гидратную оболочку, но ‘настолько прочны, что не распадаются на ионы (О2, N2).
В зависимости от величины частиц растворенного всщества различают истинные и коллоидные растворы. Растворы называют истынними, когда растворенное вещество находится в них в ионизированном состоянии. В ионном растворе по принципу элктронейтральности всегда содержатся равные количества эквивалентов катионов и анионов. В природных условиях ионные растворы образуются при растворении простых солей.
Коллоидными называются такие растворы, в которых вещество находится не в ионизированном состоянии, а в виде групп молекул, так называемых «коллоидных частиц». Размеры частиц в коллоидных растворах лежат, примерно, в пределах от 10 до 2000 А В устойчивых коллоидных растворах частицы в большинстве случаев несут электрические заряды различные по величине, но одинаковые по знаку для всех частиц данной коллоидной системы. Коллоидные растворы называются золями. Золи способны переходить в гели, т.е. превращаться в студнеобразные массы в результате укрупнения коллоидных частиц (процесс коагуляции).
В природе коллоидные растворы могут быть органическими и неорганическими. Последние образуются преимущественно при гидролитическом расщеплении различных силикатов. Силикаты при гидролизе выделяют заключающиеся в них основания (щелочные и щелочноземельные металлы), дающие начало истинным растворам. Но, кроме того, при гидролизе в раствор переходят кремнй, железо, алюминий и другие металлы, образующие , большей частью, коллоидные растворы.
Многие вещества вступают с водой в реакцию обменного разложения, называемую гидролизом. При гидролизе имеет место сдвиг равновесия диссоциации воды Н О Н + ОН за счет связывания одного из ее ионов ионами растворенного вещества с образованием малодиссоциированного или труднорастворимого продукта. Следовательно, гидролиз – это химическое взаимодействие ионов растворенной соли с водой, сопровождающиеся изменением реакции среды. Ввиду обратимости гидролизаравновесие этого процесса зависит от всех тех фактров, которые вообще влияют на равновесие ионного обмена. В частности, оно сильно (иногда – практически нацело) сдвигается в сторону разложения соли, если продукты последнего (чаще всего в виде основных солей) труднорастворимые.
В природе явление гидролиза играют большую роль. Например, основной химической формой выветривания минералов магматических породявляется гидролиз.
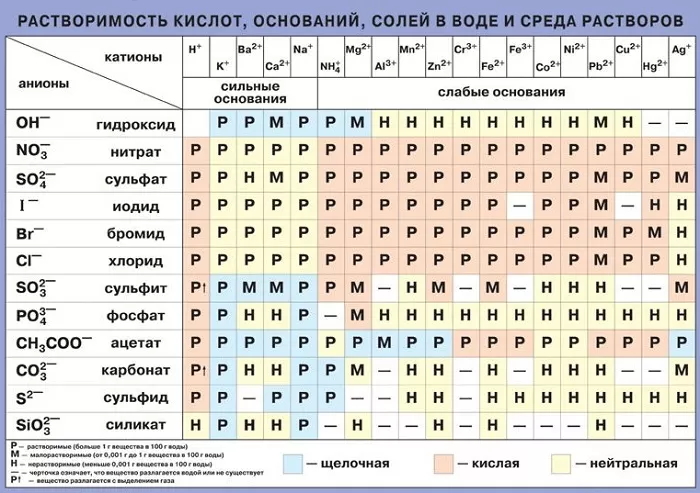
Растворимость солей.В воде могут растворятся твердые, жидкие и газообразные вещества. По растворимости в воде все вещества делятся на три группы: 1) хорошо растворимые, 2) плохо растворимые и 3) практически не растворимые. Необходимо подчеркнуть, что абсолютно нерастворимых веществ нет.
Минерализацию природных вод создают обычно немногие простые соли: хлориды, сульфиды, гидрокарбонаты натрия, магния, кальция.
В кристале галита нет молекул NaCl. При растворении кристаллическая структура разрушается, гидратированные ионы переходят в раствор. Молекулы в растворе отсутствуют. Поэтому лишь условно можно говорить о недиссоциированных молекулах растворов сильных электролитов. Это скоее ионные пары (Na + Cl ), т.е. находящиеся близко друг около друга противоположно заряженные ионы. Это недиссоциированные молекулы, а квазимолекулы.
Слабые электролиты при растворении в воде лиш частично диссоциируют на ионы. К ним относятся почти все органические кристаллы, некоторые минеральные кислоты, например Н СО, Н S, Н SiO , многие основания металлов. К слабым электролитам относится вода.
Кроме электролитов в растворе находятся и неэлектролиты, молекулы которых хотя и имеютгидратную оболочку, но настолько прочны, что не распадаются на ионы (О , N ).
В зависимости от величины частиц растворенного вещества различают истинные и коллоидные растворы. Растворы называют истинными, когда растворенное вещество находится в них ионизированном состоянии.
Растворимость твердых веществ в воде зависит не только от их химической природы, но и от температуры, давления и от наличия в ней газов и примесей.
Растворимость хлористого натрия мало меняется при повышении температуры от до 60°С (изменение растворимости дано в г на 100 мг воды). Растворимость же карбоната и сульфата натрия сильно возрастает.
На растворимость кремнекислоты температура оказывает большое влияние. В системе кремнекислота — вода, изученной в интервале от 0 до 200°, зависимость растворимости от температуры носит линейный характер. В обычных условиях растворимость кремнекислоты очень низкая.
К числу солей, понижающих свою растворимость с ростом температуры, относится Са SO4.
Как известно, растворимость данной соли уменьшается в присутствии другой соли, имеющей с ней одноименный ион, и, наоборот, повышается, если в растворе находятся неодноименные ионы. Например, пределы растворимости СаSO4 в присутствии различных солеи сильно меняются. При наличии в растворе большого количества хлористого натрия (порядка 100 г/л) растворимость СаSO4, достигает 5—6 г/л
Из главнейших солей наинизшая растворимость у карбонатов щелочных земель, но она увеличивается в несколько раз, если вода содержит двуокись углерода (СО2) Растворение идет по схеме:
СаСО3 + Н2О + СО2 Са(НСО3)2 Са+++2НСО3;
MgСО3 + Н2О + СО2 Mg(НСО3)2 Mg+++2НСО3.
Реакции эти носят обратимый характер и протекают до наступления определенного равновесия. В результате указанных реакции в воде появляются гидрокарбонаты кальция и магния. Следует отметить, что ни гидрокарбонатов кальция, ни гидрокарбонатов магния в твердом виде не существует. Минерализация широко распространенных в природе гидрокарбонатных магниево-кальциевых вод обычно достигает 500-600 мг/л. В присутствии больших количеств СО2 растворимость Са(НСО3)2 и Mg(НСО3)2 может превосходить 1 г/л (углекислые минеральные воды).
При увеличении температуры растворимость гидрокарбонатов кальция н магния сильно уменьшается и при 100° падает до 0. При высокой температуре эти соли разлагаются с выделением СО2и выпадением карбонатов в осадок
Са(НСО3)2 →СаСО3+Н2О+СО2↑;
↓
Mg(НСО3)2 →MgСО3+Н2О+СО2↑;
↓
Отсюда следует, что гидрокарбонатные кальциевые и магниевые воды в глубинных условиях существовать не могут, а, стало быть, и не существуют такого состава термальные воды.
Обогащение вод солями совершается не только путем простого растворения. Природные растворы образуются так же при гидролитическом расщеплении некоторых минералов. К числу минералов, непосредственно в воде нерастворимых, но способных гидролитически расщепляться, относятся различные силикаты—алюмосиликаты, ферросиликаты и пр., — составляющие 75% всех минералов земной коры. Под влиянием воды и углекислоты при выветривании силикаты отдают в раствор основания Na+, K+, Ca++, Mg++. Указанные основания образуют, соединяясь с СО2, углекислые и двууглекислые соли или, при соответствующих условиях, сульфатные н хлоридные соли.
Основная литература:ОЛ 1 [11-22].
Дополнительная литература: ДЛ 5,7.
Контрольные вопросы:
1. Назовите природные основные изотопы?
2. Какие особые качества воды?
3. Как происходит процесс растворения галита?
4.Вещества по растворимости как подразделяются и называются?
