Какие свойства кислорода позволяют собирать его

Цель работы
Получить кислород (методом
вытеснения воздуха) и изучить его свойства.
Необходимое оборудование и реактивы
Оборудование:
- штатив лабораторный с лапкой или пробиркодержатель;
- спиртовка;
- два химических стакана;
- стеклянная пластинка;
- пробирка;
- пробка с газоотводной трубкой;
- ложка для сжигания веществ;
- спички;
- лучинка;
- вата.
Вещества:
- перманганат калия (твердый) KMnO4;
- уголь С;
- известковая вода — Са(ОН)2.
Меры предосторожности
Работа со спиртовкой:
- Не переносите горящую спиртовку с места на место.
- Гасите спиртовку только с помощью колпачка.
- При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
- Дно пробирки должно находиться в верхней части пламени.
- Дно пробирки не должно касаться фитиля.
Работа со стеклом:
- Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке.Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть
Проверка прибора на герметичность:
- Закройте пробирку пробкой с газоотводной трубкой, опустите конец трубки в стакан с водой. Плотно обхватите ладонью пробирку и внимательно следите за появлением пузырьков воздуха.
ВЫПОЛНЕНИЕ РАБОТЫ
Загрузите по очереди два следующих видео — опыта и внимательно наблюдайте за
экспериментом:
1. Получение
кислорода (нажмите «Посмотреть опыт»)
Кислород(
O 2 ) в лаборатории получают разложением перманганата калия KMnO 4
(марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку
насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим
колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся
кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха,
поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает
в колбе: значит нам удалось собрать кислород.
2
KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
↑
Чистый кислород впервые получили независимо друг отдруга
шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли
(при разложении оксидов ртути и свинца). До их открытия ученые считали, что
воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал
теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород.
Кислород — необходим для поддержания жизни. Человек может выдержать без
кислорода всего несколько минут.
2. Обнаружение кислорода
Кислород поддерживает горение — это свойство кислорода используется для его
обнаружения
3. Горение угля в кислороде
Кислород
активно взаимодействует со многими веществами. Посмотрим, как реагирует
кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На
воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати
процентов по объему. В колбе с кислородом уголь раскаляется. Горение углерода
становится интенсивным. При сгорании углерода образуется углекислый газ:
С+О2= СО2
Добавим в колбу с газом известковую воду – она мутнеет.
Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий
костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить
подачу кислорода в зону горения.
Оформите и сдайте отчёт о проделанной работе
Практическая работа №3
Получение
и свойства кислорода
Цель работы:
Получить кислород (методом
вытеснения воздуха) и изучить его свойства.
Приборы и оборудование: KMnO4 – перманганат калия (марганцовка), С – древесный
уголь , известковая вода, пробка с газоотводной трубкой, лучинка, спиртовка,
спички, колба, вата, пробирка.
Ход работы:
Название | Наблюдения, Уравнение |
1. Получение и собирание | KMnO4t = K2MnO4 |
2. Обнаружение кислорода | |
3. Сжигание древесного угля | C + O2 t = .?. (назовите продукты) |
Вывод: __________________________________________
Лекция «Кислород –
химический элемент и простое вещество»
План
лекции:
1. Кислород – химический элемент:
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ
б)
Валентные возможности атома кислорода
в)
Распространённость химического элемента в природе
2. Кислород – простое вещество
а)
Получение кислорода
б)
Химические свойства кислорода
в)
Круговорот кислорода в природе
г)
Применение кислорода
«Dum spiro spero» (Пока дышу, надеюсь…), — гласит
латынь
Дыхание – это синоним
жизни, а источник жизни на Земле – кислород.

Подчёркивая важность кислорода для земных
процессов, Яков Берцелиус сказал: « Кислород – это вещество, вокруг которого
вращается земная химия»
Материал данной лекции обобщает
ранее полученные знания по теме «Кислород».
1.
Кислород – химический элемент
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ

Кислород — элемент главной подгруппы шестой группы,
второго периода периодической системы химических элементов
Д. И. Менделеева, с атомным порядковым номером 8. Обозначается
символом O (лат. Oxygenium). Относительная
атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
б)
Валентные возможности атома кислорода
В соединениях кислород
обычно двухвалентен (в оксидах), валентность VI
не существует. В свободном виде
встречается в виде двух простых веществ: О2 («обычный» кислород) и О3
(озон). О2 — газ без цвета и запаха, с относительной молекулярной
массой =32. О3 – газ без цвета с резким запахом, с относительной
молекулярной массой =48.
Внимание! H2O2 (перекись водорода) – O (валентность II)
СО
(угарный газ) – О (валентность III)
в)
Распространённость химического элемента кислорода в природе

Кислород — самый
распространенный на Земле элемент, на его долю (в составе различных соединений,
главным образом силикатов), приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное количество связанного кислорода —
85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по
объёму и 23% по массе. Более 1500 соединений земной коры в своем составе
содержат кислород.
Кислород входит в
состав многих органических веществ и присутствует во всех живых клетках. По
числу атомов в живых клетках он составляет около 20 %, по массовой
доле — около 65 %.
2.Кислород
– простое вещество
а) Получение кислорода
Получение в лаборатории
1) Разложение перманганата калия (марганцовка):
2KMnO4 t˚C=K2MnO4+MnO2+O2↑
2) Разложение перекиси водорода:
2H2O2 MnO2=2H2O + O2↑
3) Разложение бертолетовой соли:
2KClO3 t˚C , MnO2=2KCl + 3O2↑
Получение в промышленности
1) Электролиз воды
2H2O эл. ток=2H2 + O2↑
2) Из воздуха
ВОЗДУХ давление, -183˚C=O2 (голубая жидкость)
В
настоящее время в промышленности кислород получают из воздуха. В лабораториях
небольшие количества кислорода можно получать нагреванием перманганата калия
(марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее
воздуха, поэтому его можно получать двумя способами:
·
вытеснением воды;
·
вытеснением воздуха (кислород будет собираться на
дне сосуда).
Существуют и другие способы получения
кислорода.
Посмотрите видео-сюжет
получение кислорода при разложении марганцовки (перманганата калия). Полученный
кислород можно обнаружить на дне сосуда тлеющей лучинкой – она вспыхнет.
б)
Химические свойства кислорода
Взаимодействие веществ с кислородом называется окислением.
В результате образуются оксиды –
сложные вещества, состоящие из двух элементов, одним из которых является
двухвалентный атом кислорода.
Реакции окисления, протекающие с выделением тепла и
света, называют реакциями горения. Кислород взаимодействует с простыми
веществами – металлами и неметаллами; а так же со сложными веществами.
Изучите алгоритм составления уравнений реакций
окисления на примере алюминия и метана CH4.

в)
Круговорот кислорода в природе
В природе кислород
образуется в процессе фотосинтеза, который происходит в зелёных растениях на
свету. В целях сохранения кислорода в воздухе вокруг городов и крупных
промышленных центров создаются зоны зелёных насаждений.

г)
Применение кислорода
Применение кислорода
основано на его свойствах: кислород поддерживает горение и дыхание.
В заключении ещё раз отметим важность
кислорода для всего живого на нашей планете такими поэтическими строками:
«
Он всюду и везде:
В
камне, в воздухе, в воде,
Он
и в утренней росе
И небес голубизне…»
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
1. Прочитайте §18. Заполните таблицу сведениями о кислороде:

2. Дополните схему, отражающую распространенность кислорода в природе:
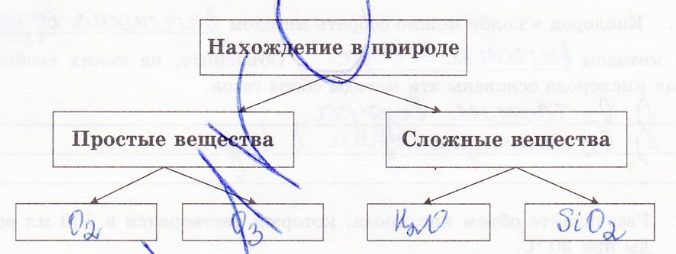
3. Вычислите массовую долю кислорода в некоторых веществах:
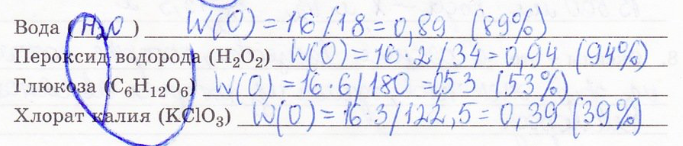
4. Отметьте, в каких случаях речь идет о химическом элементе кислороде, а в каких — о простом веществе кислороде. Обведите цифру правильного ответа: красным — элемент, синим — вещество.
1) Кислород входит в состав воды.
2) Кислород — газ, плохо растворимый в воде.
3) В воздухе содержится приблизительно 21% кислорода.
4) В земной коре содержится приблизительно 47% кислорода.
5) Валентность кислорода равна двум.
6) Рыбы дышат кислородом, растворенным в воде.
7) В промышленности кислород получают из воздуха.
5. Прочитайте §20 и занесите в таблицу сведения о физических свойствах кислорода.

6. Кислород в колбу можно собрать методом вытеснения воздуха и методом вытеснения воды. Объясните, на каких свойствах кислорода основаны эти методы свора газов.
1) О2 тяжелее воздуха.
2) О2 мало растворим в воде.
7. Рассчитайте объем кислорода, который растворится в 500 мл воды при 20 градусах Цельсия.
В 100 мл воды — 3,1 л кислорода
В 500 мл воды — х л кислорода
х = 15,5 л кислорода.
8. Оксиды — это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Из предложенного ряда веществ выпишите оксиды и дайте им названия:
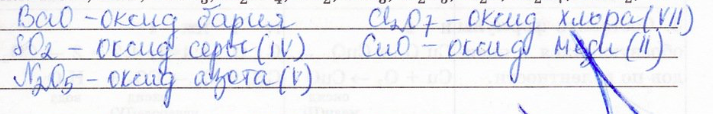
9. Составьте формулы оксидов по следующим данным:

10. Поясните термин «химические свойства веществ».
Свойства, характерные для данного вещества при взаимодействии с другими веществами.
11. Какая реакция называется горением?
Горение — химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
12. Заполните пропуски в схемах реакций:

13. Составьте уравнения реакций горения следующих простых веществ (в скобках указана валентность данного элемента в получаемом оксиде):

14. Составьте уравнения взаимодействия кислорода со сложными веществами:
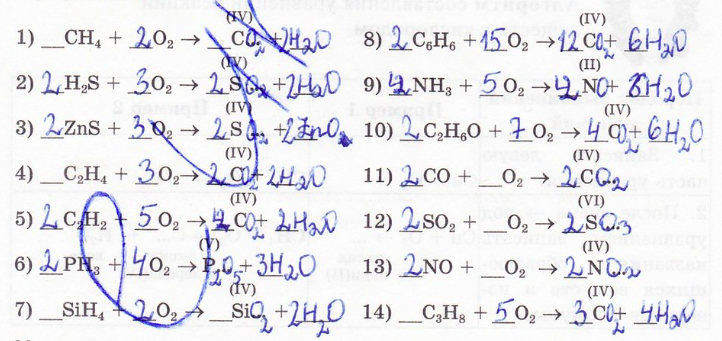
15. Какие вещества были взяты для реакции, если в результате образовались следующие вещества (в схемах стехиометрические коэффициенты не указаны):

16. Составьте уравнения реакций по следующим данным:
1) При оксилении алюминия кислородом образовался оксид.
4Al+3O2 -> 2Al2O3
2) При взаимодействии меди с кислородом получился оксид меди (II).
2Cu+O2 -> 2CuO
3) При горении этилена образовался углекислый газ.
C2H4+3O2 -> 2CO2+2H2O
4) Бензол сожгли в кислороде. Получился углекислый газ.
2C6H6+15O2 -> 12CO2+6H2O
5) Из железа получили оксид железа (III).
4Fe+3O2 -> 2Fe2O3
6) Уголь сожжен на воздухе.
C+O2 -> CO2
7) Кислород можно получить при разложении перекиси водорода.
2H2O ->t O2+2H2O
8) При сжигании серы получился оксид серы (IV).
S+O2 -> SO2
9) Пирит подвергли обжигу. При этом образовался оксид железа (III) и оксид серы (IV) (с примером и заданием для самостоятельной работы).
4FeS2+11O2 -> 2Fe2O3+8SO2
17. Составьте уравнения реакций, с помощью которых можно осуществить превращения:
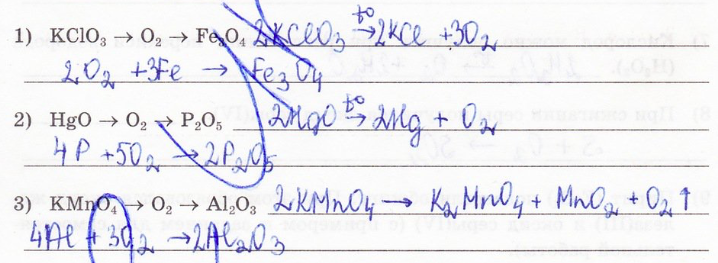
18. Задача. Какое количество вещества кислорода понадобится для полного сгорания 160 г метана? Вычислите массу образующейся при этом воды.

19. Задача. Вычислить массу оксида алюминия, образующегося при окислении 2,7 г алюминия.

20. Задача. Вычислить массу кислорода, требуемого для получения 16 г оксида железа (III) из железа.

21. Задача. Хватит ли 3,2 г кислорода, чтобы полностью окислить железо массой 2,8 г?

Сохраните или поделитесь с одноклассниками:
При газовой сварке и резке нагрев металла осуществляется высокотемпературным газовым пламенем, получаемым при сжигании горючего газа или паров жидкости в смеси с технически чистым кислородом.
Кислород является самым распространенным элементом на земле, встречающимся в виде химических соединений с различными веществами: в земле — до 50% по массе, в соединении с водородом в воде — около 86% по массе и в воздухе — до 21% по объему и 23% по массе.
Кислород
при нормальных условиях (температура 20°С, давление 0,1 МПа) — это бесцветный, негорючий газ, немного тяжелее воздуха, не имеющий запаха, но активно поддерживающий горение. При нормальном атмосферном давлении и температуре 0°С масса 1 м3 кислорода равна 1,43 кг, а при температуре 20°С и нормальном атмосферном давлении — 1,33 кг.
Кислород имеет высокую химическую активность, образуя соединения со всеми химическими элементами, кроме инертных газов (аргона, гелия, ксенона, криптона и неона). Реакции соединения с кислородом протекают с выделением большого количества теплоты, т. е. носят экзотермический характер.
При соприкосновении сжатого газообразного кислорода с органическими веществами, маслами, жирами, угольной пылью, горючими пластмассами может произойти их самовоспламенение в результате выделения теплоты при быстром сжатии кислорода, трении и ударе твердых частиц о металл, а также электростатического искрового разряда. Поэтому при использовании кислорода необходимо тщательно следить за тем, чтобы он не находился в контакте с легковоспламеняющимися и горючими веществами.
Всю кислородную аппаратуру, кислородопроводы и баллоны необходимо тщательно обезжиривать. Кислород способен образовывать в широких пределах взрывчатые смеси с горючими газами или парами жидких горючих, что также может привести к взрывам при наличии открытого огня или даже искры.
Отмеченные особенности кислорода следует всегда иметь в виду при использовании его в процессах газопламенной обработки.
Атмосферный воздух в основном представляет собой механическую смесь трех газов при следующем их объемном содержании: азота — 78,08%, кислорода — 20,95%, аргона-0,94%, остальное — углекислый газ, водород, закись азота и др. Кислород получают разделением воздуха на кислород и азот методом глубокого охлаждения (сжижения), попутно идет отделение аргона, применение которого при аргонодуговой сварке непрерывно возрастает. Азот применяют как защитный газ при сварке меди.
Кислород можно получать химическим способом или электролизом воды. Химические способы малопроизводительны и неэкономичны. При электролизе воды постоянным током кислород получают как побочный продукт при производстве чистого водорода.
В промышленности кислород получают из атмосферного воздуха методом глубокого охлаждения и ректификации. В установках для получения кислорода и азота из воздуха последний очищают от вредных примесей, сжимают в компрессоре до соответствующего давления холодильного цикла 0,6-20 МПа и охлаждают в теплообменниках до температуры сжижения, разница в температурах сжижения кислорода и азота составляет 13°С, что достаточно для их полного разделения в жидкой фазе.
Жидкий чистый кислород накапливается в воздухоразделительном аппарате, испаряется и собирается в газгольдере, откуда компрессором его накачивают в баллоны под давлением до 20 МПа.
Технический кислород транспортируют также по трубопроводу. Давление кислорода, транспортируемого по трубопроводу, должно быть согласовано между изготовителем и потребителем. К месту сварки кислород доставляется в кислородных баллонах, и в жидком виде — в специальных сосудах с хорошей теплоизоляцией.
Для превращения жидкого кислорода в газ используют газификаторы или насосы с испарителями для жидкого кислорода. При нормальном атмосферном давлении и температуре 20°С 1 дм3 жидкого кислорода при испарении дает 860 дм3 газообразного. Поэтому доставлять кислород к месту сварки целесообразно в жидком состоянии, так как при этом в 10 раз уменьшается масса тары, что позволяет экономить металл на изготовление баллонов, уменьшать расходы на транспортировку и хранение баллонов.
Для сварки и резки по ГОСТ 5583-78 технический кислород выпускается трех сортов:
- 1-й — чистотой не менее 99,7%
- 2-й — не менее 99,5%
- 3-й — не менее 99,2% по объему
Чистота кислорода имеет большое значение для кислородной резки. Чем меньше содержится в нем газовых примесей, тем выше скорость реза, чище кромки и меньше расход кислорода.
