Какие свойства имеют неорганические вещества

Ежедневно человек взаимодействует с большим количеством предметов. Они изготовлены из разных материалов, имеют свою структуру и состав. Все, что окружает человека можно разделить на органическое и неорганическое. В статье рассмотрим, что представляют собой такие вещества, приведем примеры. Также определим, какие встречаются неорганические вещества в биологии.
Описание
Неорганическими называются такие вещества, в составе которых нет углерода. Они противоположны органическим. Также к этой группе относят несколько углеродосодержащих соединений, например:
- цианиды;
- оксиды углерода;
- карбонаты;
- карбиды и другие.
Примеры неорганических веществ:
- вода;
- разные кислоты (соляная, азотная, серная);
- соль;
- аммиак;
- углекислый газ;
- металлы и неметаллы.
Неорганическая группа отличается отсутствием углеродного скелета, который характерен для органических веществ. Неорганические вещества по составу принято делить на простые и сложные. Простые вещества составляют немногочисленную группу. Всего их насчитывается примерно 400.

Простые неорганические соединения: металлы
Металлы – простые вещества, соединение атомов которых основывается на металлической связи. Эти элементы имеют характерные металлические свойства: теплопроводность, электропроводность, пластичность, блеск и другие. Всего в этой группе выделяют 96 элементов. К ним относятся:
- щелочные металлы: литий, натрий, калий;
- щелочноземельные металлы: магний, стронций, кальций;
- переходные металлы: медь, серебро, золото;
- легкие металлы: алюминий, олово, свинец;
- полуметаллы: полоний, московий, нихоний;
- лантаноиды и лантан: скандий, иттрий;
- актиноиды и актиний: уран, нептуний, плутоний.
В основном в природе металлы встречаются в виде руды и соединений. Чтобы получить чистый металл без примесей, проводится его очистка. При необходимости возможно проведение легирования или другой обработки. Этим занимается специальная наука – металлургия. Она подразделяется на черную и цветную.

Простые неорганические соединения: неметаллы
Неметаллы – химические элементы, которые не обладают металлическими свойствами. Примеры неорганических веществ:
- вода;
- азот;
- сера;
- кислород и другие.
Неметаллы отличаются большим числом электронов на внешнем энергетическом уровне их атома. Это обуславливает некоторые свойства: повышается способность присоединять дополнительные электроны, проявляется более высокая окислительная активность.
В природе можно встретить неметаллы в свободном состоянии: кислород, хлор, фтор, водород. А также твердые формы: йод, фосфор, кремний, селен.
Некоторые неметаллы имеют отличительное свойство – аллотропию. То есть они могут существовать в различных модификациях и формах. Например:
- газообразный кислород имеет модификации: кислород и озон;
- твердый углерод может существовать в таких формах: алмаз, графит, стеклоуглерод и другие.

Сложные неорганические соединения
Эта группа веществ более многочисленна. Сложные соединения отличаются наличием в составе вещества нескольких химических элементов.
Рассмотрим подробнее сложные неорганические вещества. Примеры и классификация их представлены ниже в статье.
1. Оксиды – соединения, одним их элементов которых является кислород. В группу входят:
- несолеобразующие (например, монооксид углерода, оксид азота);
- солеобразующие оксиды (например, оксид натрия, оксид цинка).
2. Кислоты – вещества, в состав которых входят ионы водорода и кислотные остатки. Например, азотная кислота, серная кислота, сероводород.
3. Гидроксиды – соединения, в составе которых присутствует группа –ОН. Классификация:
- основания – растворимые и нерастворимые щелочи – гидроксид меди, гидроксид натрия;
- кислородосодержащие кислоты – диводород триоксокарбонат, водород триоксонитрат;
- амфотерные – гидроксид хрома, гидроксид меди.
4. Соли – вещества, в составе которых есть ионы металла и кислотные остатки. Классификация:
- средние: хлорид натрия, сульфид железа;
- кислые: гидрокарбонат натрия, гидросульфаты;
- основные: нитрат дигидроксохрома, нитрат гидроксохрома;
- комплексные: тетрагидроксоцинкат натрия, тетрахлороплатинат калия;
- двойные: алюмокалиевые квасцы;
- смешанные: сульфат алюминия калия, хлорид меди калия.
5. Бинарные соединения – вещества, состоящие из двух химических элементов:
- бескислородные кислоты;
- бескислородные соли и другие.

Неорганические соединения, содержащие углерод
Такие вещества традиционно относятся к группе неорганических. Примеры веществ:
- Карбонаты — эфиры и соли угольной кислоты – кальцит, доломит.
- Карбиды – соединения неметаллов и металлов с углеродом – карбид бериллия, карбид кальция.
- Цианиды – соли цианистоводородной кислоты – цианид натрия.
- Оксиды углерода – бинарное соединение углерода и кислорода – угарный и углекислый газы.
- Цианаты – являются производными от циановой кислоты – фульминовая кислота, изоциановая кислота.
- Карбонильные металлы – комплекс металла и монооксида углерода – карбонил никеля.

Свойства неорганических веществ
Все рассмотренные вещества отличаются индивидуальными химическими и физическими свойствами. В общем виде можно выделить отличительные черты каждого класса неорганических веществ:
1. Простые металлы:
- высокая тепло- и электропроводность;
- металлический блеск;
- отсутствие прозрачности;
- прочность и пластичность;
- при комнатной температуре сохраняют твердость и форму (кроме ртути).
2. Простые неметаллы:
- простые неметаллы могут быть в газообразном состоянии: водород, кислород, хлор;
- в жидком состоянии встречается бром;
- твердые неметаллы имеют немолекулярное состояние и могут образовывать кристаллы: алмаз, кремний, графит.
3. Сложные вещества:
- оксиды: вступают в реакцию с водой, кислотами и кислотными оксидами;
- кислоты: вступают в реакцию с водой, основными оксидами и щелочами;
- амфотерные оксиды: могут вступать в реакции с кислотными оксидами и основаниями;
- гидроксиды: растворяются в воде, имеют широкий диапазон температур плавления, могут менять цвет при взаимодействии с щелочами.
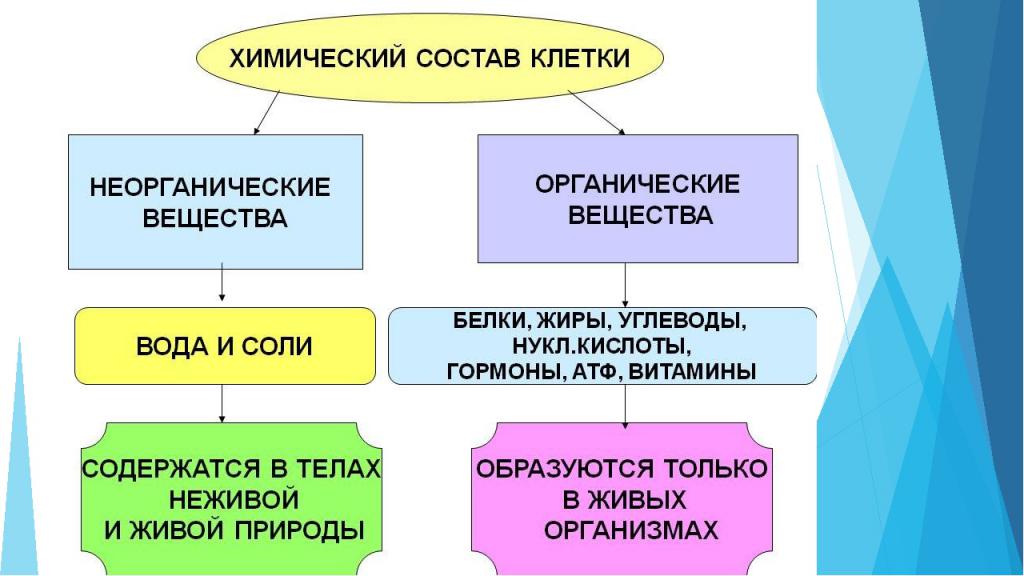
Органические и неорганические вещества клетки
Клетка любого живого организма состоит из множества компонентов. Некоторыми из них являются неорганические соединения:
- Вода. Например, количество воды в клетке составляет от 65 до 95%. Она необходима для осуществления химических реакций, перемещения компонентов, процесса терморегуляции. Также именно вода определяет объем клетки и степень ее упругости.
- Минеральные соли. Могут присутствовать в организме как в растворенном виде, так и в нерастворенном. Важную роль в процессах клетки играют катионы: калий, натрий, кальций, магний — и анионы: хлор, гидрокарбонаты, суперфосфат. Минералы необходимы для поддержания осмотического равновесия, регуляции биохимических и физических процессов, образования нервных импульсов, поддержания уровня свертываемости крови и многих других реакций.
Для поддержания жизнедеятельности важны не только неорганические вещества клетки. Органические компоненты занимают 20-30 % ее объема.
Классификация:
- простые органические вещества: глюкоза, аминокислоты, жирные кислоты;
- сложные органические вещества: белки, нуклеиновые кислоты, липиды, полисахариды.
Органические компоненты необходимы для выполнения защитной, энергетической функции клетки, они служат источником энергии для клеточной активности и запасают питательные вещества, проводят синтез белков, передают наследственную информацию.
В статье были рассмотрены сущность и примеры неорганических веществ, их роль в составе клетки. Можно сказать, что существование живых организмов было бы невозможным без групп органических и неорганических соединений. Они важны в каждой сфере человеческой жизни, а также в существовании каждого организма.
11 октября 2018
Автор КакПросто!
Неорганические вещества — это простые и сложные вещества, кроме органических соединений углерода. Из них состоят объекты неживой природы: почва, воздух, Солнце. Некоторые входят в состав живых клеток. Известно несколько сотен неорганических веществ. В соответствии со своими свойствами, они делятся на ряд классов.
Во-первых, неорганическими являются простые вещества: они состоят из атомов одного химического элемента. Например, это кислород, золото, кремний и сера. Впрочем, сюда относится вся таблица Менделеева.
Во-вторых, к числу неорганических принадлежат многие сложные вещества (или соединения), в состав которых входят атомы нескольких элементов. Исключением являются углеродные органические соединения, которые образуют отдельный обширный класс веществ. Они обладают особой структурой, в основе которой лежит так называемый углеродный скелет. Некоторые соединения углерода, впрочем, относятся к неорганическим.
Особенности неорганических веществ:
- Молекулы обычно связаны ионной связью. То есть, атомы элементов с низкой электроотрицательностью «отдают» электроны атомам другого простого вещества. В итоге образуются разнозаряженные частицы — ионы («с плюсом» — катион и «с минусом» — анион), которые притягиваются между собой.
- Молекулярная масса небольшая, если сравнивать с большинством органических соединений.
- Химические реакции между неорганическими веществами протекают быстро, иногда моментально.
- Большинство неорганических веществ в той или иной степени растворяются в воде. При этом они распадаются (диссоциируют) на ионы, благодаря чему проводят электрический ток.
- Чаще всего, это твердые вещества (хотя встречаются газы и жидкости). При этом они обладают высокой температурой плавления, а при плавлении не разрушаются.
- Как правило, не окисляются на воздухе и не горючи. Так, после сгорания топлива (например, дров или угля) минеральные примеси остаются в виде золы.
Некоторые неорганические вещества входят в состав клеток живых организмов. Это, в первую очередь, вода. Также важную роль играют минеральные соли.
Простые и сложные неорганические вещества подразделяются на несколько классов, каждый из которых обладает различными свойствами.
- Металлы: литий (Li), натрий (Na), медь (Cu) и другие. С физической точки зрения обычно это твердые (кроме жидкой ртути) вещества с характерным блеском, высокой тепло- и электропроводностью. Как правило, в химических реакциях они являются восстановителями, то есть отдают свои электроны.
- Неметаллы. Это, например, газы фтор (F2), хлор (Cl2) и кислород (O2). Твердые неметаллические простые вещества — сера (S) фосфор (P) и другие. В химических реакциях обычно выступают окислителями, то есть притягивают электроны восстановителей.
- Амфотерные простые вещества. Имеют двойственную природу: могут проявлять и металлические, и неметаллические свойства. К таким веществам относят, в частности, цинк (Zn), алюминий (Al) и марганец (Mn).
- Благородные, или инертные, газы. Это гелий (He), неон (Ne), аргон (Ar) и другие. Их молекулы состоит из одного атома. Химически неактивны, способны образовывать соединения только в специальных условиях. Это связано с тем, что внешние электронные оболочки атомов инертных газов заполнены: они и не отдают своих, и не забирают электроны других элементов.
Самый распространенный в природе класс сложных органических соединений — это оксиды. К их числу относится одно из важнейших веществ – вода, или оксид водорода (Н2О).
Оксиды возникают при взаимодействии различных химических элементов с кислородом. При этом атом кислорода присоединяет к себе два «чужих» электрона.
Поскольку кислород — один из самых сильных окислителей, то почти все бинарные (содержащие два элемента) соединения с ним являются оксидами. Сам кислород окисляется только фтором. Получаемое вещество — OF2 — относится к фторидам.
Выделяют несколько групп оксидов:
- основные (с ударением на второй слог) оксиды — соединения кислорода с металлами. Вступают в реакцию с кислотами, при этом образуются соль и вода. К основным относят, в частности, оксид натрия (Na2O), оксид меди (II) CuO;
- кислотные оксиды — соединения с кислородом неметаллов или переходных металлов в степени окисления от +5 до +8. Взаимодействуют с основаниями, при этом возникают соль и вода. Пример: оксид азота (IV) NO2;
- амфотерные оксиды. Вступают в реакцию и с кислотами, и с основаниями. Это, в частности, оксид цинка (ZnO), входящий в состав дерматологических мазей и присыпок;
- несолеобразующие оксиды, которые не реагируют с кислотами и с основаниями. Например, таковым являются оксиды углерода CO2 и CO, хорошо всем известные как углекислый и угарный газы.
Гидроксиды в своем составе содержат так называемую гидроксильную группу (-OH). Она включает в себя по атому кислорода и водорода. Гидроксиды разделяются на несколько групп:
- основания — гидроксиды металлов с низкой степенью окисления. Растворимые в воде основания называют щелочами. Примеры: каустическая сода, или гидроксид натрия (NaOH); гашеная известь, он же гидроксид кальция (Ca(OH)2).
- кислоты — гидроксиды неметаллов и металлов с высокой степенью окисления. Большинство из них представляют из себя жидкости, реже – твердые вещества. Почти все растворимы в воде. Обычно кислоты очень едкие, ядовитые. В производстве, медицине и других сферах активно используют серную кислоту (H2SO4), азотную (HNO3) и некоторые другие;
- амфотерные гидроксиды. Проявляют то основные, то кислотные свойства. Например, сюда относится гидроксид цинка (Zn(OH)2).
Соли состоят из катионов металла, связанных с отрицательно заряженными молекулами кислотного остатка. Также существуют соли аммония — катиона NH4+.
Соли возникают при взаимодействии кислот с металлами, оксидами, основаниями или другими солями. Водород в составе кислоты при этом частично или полностью вытесняется атомами металла, поэтому в ходе реакции также выделяется водород или вода.
Краткое описание некоторых групп солей:
- средние соли — в них водород полностью замещается на атомы металла. Например, это ортофосфат калия (K3PO4), применяемый в производстве пищевая добавки Е340;
- кислые соли, в составе которых остается водород. Широко известен гидрокарбонат натрия (NaHCO3) — пищевая сода;
- основные соли — содержат гидроксогруппы.
Среди неорганических веществ отдельно выделяют бинарные соединения. В их состав входят атомы двух веществ. Это могут быть:
- бескислородные кислоты. Например, соляная кислота (HCl), которая входит в состав желудочного сока человека;
- бескислородные соли, которые возникают при взаимодействии бескислородных кислот с металлами или двух простых веществ между собой. К таким солям относится обычная поваренная соль, или хлорид натрия (NaCl);
- другие бинарные соединения. Это, в частности, широко применяемый в химической промышленности и других отраслях сероуглерод (CS2).
Как уже отмечено, некоторые соединения углерода относятся к неорганическим веществам. Это:
- угольная (H2CO3) и синильная кислоты (HCN);
- карбонаты и гидрокарбонаты — соли угольной кислоты. Самый простой образец — та же пищевая сода;
- оксиды углерода — угарный и углекислый газ;
- карбиды — соединение углерода с металлами и некоторыми неметаллами. Представляют из себя твердые вещества. Из-за своей тугоплавкости широко применяются в металлургии для получения высококачественных сплавов, а также в других отраслях;
- цианиды — соли синильной кислоты. К числу относится печально известный цианистый калий, сильнейший яд.
Углерод также содержится в природе в чистом виде, причем в нескольких непохожих формах. Порошкообразная сажа, слоистый графит и самый твердый минерал на Земле, алмаз, — все они имеют химическую формулу С. Естественно, они тоже являются неорганическими веществами.
Источники:
- Основные классы неорганических соединений
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь 🙂
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2)
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
