Какие свойства имеет пламя

В процессе горения образуется пламя, строение которого обусловлено реагирующими веществами. Его структура поделена на области в зависимости от температурных показателей.
Определение
Пламенем называют газы в раскаленном виде, в которых присутствуют составляющие плазмы или вещества в твердой дисперсной форме. В них осуществляются преобразования физического и химического типа, сопровождающиеся свечением, выделением тепловой энергии и разогревом.
Наличие же в газообразной среде ионных и радикальных частичек характеризует его электрическую проводимость и особое поведение в электромагнитном поле.

Что такое языки пламени
Обычно так называют процессы, связанные с горением. По сравнению с воздухом, газовая плотность меньше, но высокие температурные показатели обуславливают поднятие газа. Так и образуются языки пламени, которые бывают длинными и короткими. Часто происходит и плавный переход одних форм в другие.
Пламя: строение и структура
Для определения внешнего вида описываемого явления достаточно зажечь газовую горелку. Появившееся несветящееся пламя нельзя назвать однородным. Визуально можно выделить три его основные области. Кстати, изучение строения пламени показывает, что различные вещества горят с образованием различного типа факела.
При горении смеси из газа и воздуха вначале происходит формирование короткого факела, цвет которого имеет голубые и фиолетовые оттенки. В нем просматривается ядро — зелено-голубое, напоминающее конус. Рассмотрим это пламя. Строение его разделяется на три зоны:
- Выделяют подготовительную область, в которой происходит нагревание смеси из газа и воздуха при выходе из отверстия горелки.
- За ней следует зона, в которой происходит горение. Она занимает верхушку конуса.
- Когда имеется недостаток воздушного потока, газ сгорает не полностью. Выделяется углерода двухвалентный оксид и водородные остатки. Их догорание протекает в третьей области, где есть кислородный доступ.
Теперь отдельно рассмотрим разные процессы горения.
Горение свечи
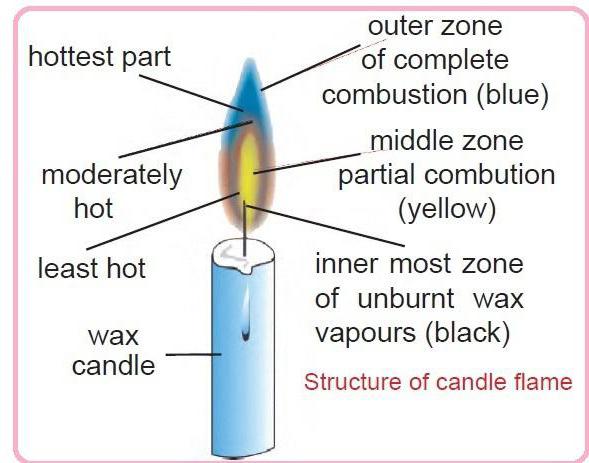
Горение свечи подобно горению спички или зажигалки. А строение пламени свечи напоминает раскаленный газовый поток, который вытягивается вверх за счет выталкивающих сил. Процесс начинается с нагревания фитиля, за которым следует испарение парафина.
Самую нижнюю зону, находящуюся внутри и прилегающую к нити, называют первой областью. Она обладает небольшим свечением синего цвета из-за большого количества топлива, но малого объема кислородной смеси. Здесь осуществляется процесс неполного сгорания веществ с выделением угарного газа, который в дальнейшем окисляется.

Первую зону окружает светящаяся вторая оболочка, характеризующая строение пламени свечи. В нее поступает больший кислородный объем, что обуславливает продолжение окислительной реакции с участием топливных молекул. Температурные показатели здесь будут выше, чем в темной зоне, но недостаточные для конечного разложения. Именно в первых двух областях при сильном нагревании капелек несгоревшего топлива и угольных частичек появляется светящийся эффект.
Вторая зона окружена слабозаметной оболочкой с высокими температурными значениями. В нее заходит много кислородных молекул, что способствует полному догоранию топливных частичек. После окисления веществ, в третьей зоне светящийся эффект не наблюдается.
Схематическое изображение
Для наглядности представляем вашему вниманию изображение горения свечи. Схема пламени включает:
- Первую или темную область.
- Вторую светящуюся зону.
- Третью прозрачную оболочку.
Нить свечи не подвергается горению, а только происходит обугливание загнутого конца.
Горение спиртовки
Для химических экспериментов часто используют небольшие резервуары со спиртом. Их называют спиртовками. Фитиль горелки пропитывается залитым через отверстие жидким топливом. Этому способствует давление капиллярное. При достижении свободной верхушки фитиля, спирт начинает испаряться. В парообразном состоянии он поджигается и горит при температуре не более 900 °C.
Пламя спиртовки имеет обычную форму, оно практически бесцветное, с небольшим оттенком голубого. Его зоны не так четко видны, как у свечки.
У спиртовой горелки, названной в честь ученого Бартеля, начало огня располагается над калильной сеткой горелки. Такое заглубление пламени приводит к уменьшению внутреннего темного конуса, а из отверстия выходит средний участок, который считается самым горячим.

Цветовая характеристика
Излучения различных цветов пламени, вызывается электронными переходами. Их еще называют тепловыми. Так, в результате горения углеводородного компонента в воздушной среде, синее пламя обусловлено выделением соединения H-C. А при излучении частичек C-C, факел окрашивается в оранжево-красный цвет.
Трудно рассмотреть строение пламени, химия которого включает соединения воды, углекислого и угарного газа, связь OH. Его языки практически бесцветны, так как вышеуказанные частички при горении выделяют излучения ультрафиолетового и инфракрасного спектра.
Окраска пламени взаимосвязана с температурными показателями, с наличием в нем ионных частиц, которые относятся к определенному эмиссионному или оптическому спектру. Так, горение некоторых элементов приводит к изменению цвета огня в горелке. Отличия в окрашивании факела связаны с расположением элементов в разных группах системы периодической.
Огонь на наличие излучений, относящихся к видимому спектру, изучают спектроскопом. При этом было установлено, что простые вещества из общей подгруппы оказывают и подобное окрашивание пламени. Для наглядности используют горение натрия в качестве теста на данный металл. При внесении его в пламя, языки становятся ярко-желтыми. На основании цветовых характеристик выделяют натриевую линию в эмиссионном спектре.
Для щелочных металлов характерно свойство быстрого возбуждения светового излучения атомарных частиц. При внесении труднолетучих соединений таких элементов в огонь горелки Бунзена происходит его окрашивание.
Спектроскопическое исследование показывает характерные линии в области, видимой для глаза человека. Быстрота возбуждения светового излучения и простое спектральное строение тесно взаимосвязаны с высокой электроположительной характеристикой данных металлов.
Характеристика
В основе классификации пламени лежат следующие характеристики:
- состояние агрегатное сгорающих соединений. Они бывают газообразной, аэродисперсной, твердой и жидкой формы;
- тип излучения, которое может быть бесцветным, светящимся и окрашенным;
- распределительная скорость. Существует быстрое и медленное распространение;
- высота пламени. Строение может быть коротким и длинным;
- характер передвижения реагирующих смесей. Выделяют пульсирующее, ламинарное, турбулентное перемещение;
- визуальное восприятие. Вещества горят с выделением коптящего, цветного или прозрачного пламени;
- температурный показатель. Пламя может быть низкотемпературным, холодным и высокотемпературным.
- состояние фазы топливо – окисляющий реагент.
Возгорание происходит в результате диффузии или при предварительном перемешивании активных компонентов.

Окислительная и восстановительная область
Процесс окисления протекает в слабозаметной зоне. Она самая горячая и располагается вверху. В ней топливные частицы подвергаются полному сгоранию. А наличие в кислородного избытка и горючего недостатка приводит к интенсивному процессу окисления. Этой особенностью следует пользоваться при нагревании предметов над горелкой. Именно поэтому вещество погружают в верхнюю часть пламени. Такое горение протекает намного быстрее.
Восстановительные реакции проходят в центральной и нижней части пламени. Здесь содержится большой запас горючих веществ и малое количество O2 молекул, осуществляющих горение. При внесении в эти области кислородсодержащих соединений осуществляется отщепление O элемента.
В качестве примера восстановительного пламени используют процесс расщепления железа двухвалентного сульфата. При попадании FeSO4 в центральную часть факела горелки, происходит вначале его нагревание, а затем разложение на оксид трехвалентного железа, ангидрид и двуокись серы. В данной реакции наблюдается восстановление S с зарядом от +6 до +4.
Сварочное пламя
Данный вид огня образуется в результате сгорания смеси из газа или пара жидкости с кислородом чистого воздуха.

Примером служит формирование пламени кислородно-ацетиленового. В нем выделяют:
- зону ядра;
- среднюю область восстановления;
- факельную крайнюю зону.
Так горят многие газокислородные смеси. Различия в соотношении ацетилена и окислителя приводят к разному типу пламени. Оно может быть нормального, науглероживающего (ацетиленистого) и окислительного строения.
Теоретически процесс неполного сгорания ацетилена в чистом кислороде можно охарактеризовать следующим уравнением: HCCH + O2 → H2 + CO +CO (для реакции необходима одна моль O2).
Полученный же молекулярный водород и угарный газ реагируют с воздушным кислородом. Конечными продуктами является вода и оксид четырехвалентного углерода. Уравнение выглядит так: CO + CO + H2 + 1½O2 → CO2 + CO2 +H2O. Для этой реакции необходимо 1,5 моля кислорода. При суммировании O2 получается, что 2,5 моль затрачивается на 1 моль HCCH. А так как на практике трудно найти идеально чистый кислород (часто он имеет небольшое загрязнение примесями), то соотношение O2 к HCCH будет 1,10 к 1,20.
Когда значение пропорции кислорода к ацетилену меньше 1,10, возникает науглероживающее пламя. Строение его имеет увеличенное ядро, очертания его становятся расплывчатыми. Из такого огня выделяется копоть, вследствие недостатка кислородных молекул.
Если же соотношение газов больше 1,20, то получается окислительное пламя с кислородным избытком. Лишние его молекулы разрушают атомы железа и другие компоненты стальной горелки. В таком пламени ядерная часть становится короткой и имеет заострения.
Температурные показатели
Каждая зона огня свечи или горелки имеет свои значения, обусловленные поступлением кислородным молекул. Температура открытого пламени в разных его частях колеблется от 300 °C до 1600 °C.
Примером служит пламя диффузионное и ламинарное, которое образовано тремя оболочками. Конус его состоит из темного участка с температурой до 360 °C и недостатком окисляющего вещества. Над ним располагается зона свечения. Ее температурный показатель колеблется от 550 до 850 °C, что способствует разложению термическому горючей смеси и ее горению.
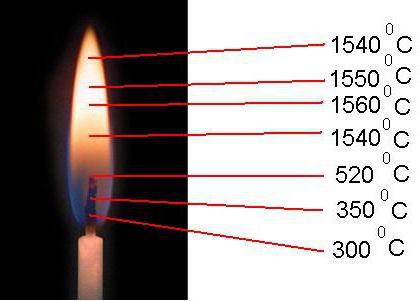
Внешняя область едва заметная. В ней температура пламени доходит до 1560 °C, что обусловлено природными характеристиками топливных молекул и быстротой поступления окисляющего вещества. Здесь горение наиболее энергичное.
Вещества воспламеняются при разных температурных условиях. Так, металлический магний горит только при 2210 °С. Для многих твердых веществ температура пламени около 350 °С. Возгорание спичек и керосина возможно при 800 °С, тогда как древесины – от 850 °С до 950 °С.
Сигарета горит пламенем, температура которого варьируется от 690 до 790 °С, а в пропан-бутановой смеси – от 790 °С до 1960 °С. Бензин воспламеняется при 1350 °С. Пламя горения спирта имеет температуру не более 900 °С.
Илья Абрамович Леенсон
«Химия и жизнь» №2, 2011
Чем проклинать тьму,
лучше зажечь хотя бы
одну маленькую свечу.
Конфуций

В начале
Первые попытки понять механизм горения связаны с именами англичанина Роберта Бойля, француза Антуана Лорана Лавуазье и русского Михаила Васильевича Ломоносова. Оказалось, что при горении вещество никуда не «исчезает», как наивно полагали когда-то, а превращается в другие вещества, в основном газообразные и потому невидимые. Лавуазье в 1774 году впервые показал, что при горении из воздуха уходит примерно пятая его часть. В течение XIX века ученые подробно исследовали физические и химические процессы, сопровождающие горение. Необходимость таких работ была вызвана прежде всего пожарами и взрывами в шахтах.
Но только в последней четверти ХХ века были выявлены основные химические реакции, сопровождающие горение, и по сей день в химии пламени осталось немало темных пятен. Их исследуют самыми современными методами во многих лабораториях. У этих исследований несколько целей. С одной стороны, надо оптимизировать процессы горения в топках ТЭЦ и в цилиндрах двигателей внутреннего сгорания, предотвратить взрывное горение (детонацию) при сжатии в цилиндре автомобиля воздушно-бензиновой смеси. С другой стороны, необходимо уменьшить количество вредных веществ, образующихся в процессе горения, и одновременно — искать более эффективные средства тушения огня.
Существуют два вида пламени. Топливо и окислитель (чаще всего кислород) могут принудительно или самопроизвольно подводиться к зоне горения порознь и смешиваться уже в пламени. А могут смешиваться заранее — такие смеси способны гореть или даже взрываться в отсутствие воздуха, как, например, пороха, пиротехнические смеси для фейерверков, ракетные топлива. Горение может происходить как с участием кислорода, поступающего в зону горения с воздухом, так и при помощи кислорода, заключенного в веществе-окислителе. Одно из таких веществ — бертолетова соль (хлорат калия KClO3); это вещество легко отдает кислород. Сильный окислитель — азотная кислота HNO3: в чистом виде она воспламеняет многие органические вещества. Нитраты, соли азотной кислоты (например, в виде удобрения — калийной или аммиачной селитры), легко воспламеняются, если смешаны с горючими веществами. Еще один мощный окислитель, тетраоксид азота N2O4 — компонент ракетных топлив. Кислород могут заменить и такие сильные окислители, как, например, хлор, в котором горят многие вещества, или фтор. Чистый фтор — один из самых сильных окислителей, в его струе горит вода.
Цепные реакции
Основы теории горения и распространения пламени были заложены в конце 20-х годов прошлого столетия. В результате этих исследований были открыты разветвленные цепные реакции. За это открытие отечественный физикохимик Николай Николаевич Семенов и английский исследователь Сирил Хиншельвуд были в 1956 году удостоены Нобелевской премии по химии. Более простые неразветвленные цепные реакции открыл еще в 1913 году немецкий химик Макс Боденштейн на примере реакции водорода с хлором. Суммарно реакция выражается простым уравнением H2 + Cl2 = 2HCl. На самом деле она идет с участием очень активных осколков молекул — так называемых свободных радикалов. Под действием света в ультрафиолетовой и синей областях спектра или при высокой температуре молекулы хлора распадаются на атомы, которые и начинают длинную (иногда до миллиона звеньев) цепочку превращений; каждое из этих превращений называется элементарной реакцией:
Cl + H2 → HCl + H,
H + Cl2 → HCl + Cl и т. д.
На каждой стадии (звене реакции) происходит исчезновение одного активного центра (атома водорода или хлора) и одновременно появляется новый активный центр, продолжающий цепь. Цепи обрываются, когда встречаются две активные частицы, например Cl + Cl → Cl2. Каждая цепь распространяется очень быстро, поэтому, если генерировать «первоначальные» активные частицы с высокой скоростью, реакция пойдет так быстро, что может привести к взрыву.
Н. Н. Семенов и Хиншельвуд обнаружили, что реакции горения паров фосфора и водорода идут иначе: малейшая искра или открытое пламя могут вызвать взрыв даже при комнатной температуре. Эти реакции — разветвленно-цепные: активные частицы в ходе реакции «размножаются», то есть при исчезновении одной активной частицы появляются две или три. Например, в смеси водорода и кислорода, которая может спокойно храниться сотни лет, если нет внешних воздействий, появление по той или иной причине активных атомов водорода запускает такой процесс:
H + O2 → OH + O,
O + H2 → OH + H.
Таким образом, за ничтожный промежуток времени одна активная частица (атом H) превращается в три (атом водорода и два гидроксильных радикала OH), которые запускают уже три цепи вместо одной. В результате число цепей лавинообразно растет, что моментально приводит к взрыву смеси водорода и кислорода, поскольку в этой реакции выделяется много тепловой энергии. Атомы кислорода присутствуют в пламени и при горении других веществ. Их можно обнаружить, если направить струю сжатого воздуха поперек верхней части пламени горелки. При этом в воздухе обнаружится характерный запах озона — это атомы кислорода «прилипли» к молекулам кислорода с образованием молекул озона: О + О2 = О3, которые и были вынесены из пламени холодным воздухом.

Возможность взрыва смеси кислорода (или воздуха) со многими горючими газами — водородом, угарным газом, метаном, ацетиленом — зависит от условий, в основном от температуры, состава и давления смеси. Так, если в результате утечки бытового газа на кухне (он состоит в основном из метана) его содержание в воздухе превысит 5%, то смесь взорвется от пламени спички или зажигалки и даже от маленькой искры, проскочившей в выключателе при зажигании света. Взрыва не будет, если цепи обрываются быстрее, чем успевают разветвляться. Именно поэтому была безопасной лампа для шахтеров, которую английский химик Хэмфри Дэви разработал в 1816 году, ничего не зная о химии пламени. В этой лампе открытый огонь был отгорожен от внешней атмосферы (которая могла оказаться взрывоопасной) частой металлической сеткой. На поверхности металла активные частицы эффективно исчезают, превращаясь в стабильные молекулы, и потому не могут проникнуть во внешнюю среду.
Полный механизм разветвленно-цепных реакций очень сложен и может включать более сотни элементарных реакций. К разветвленно-цепным относятся многие реакции окисления и горения неорганических и органических соединений. Таковой же будет и реакция деления ядер тяжелых элементов, например плутония или урана, под воздействием нейтронов, которые выступают аналогами активных частиц в химических реакциях. Проникая в ядро тяжелого элемента, нейтроны вызывают его деление, что сопровождается выделением очень большой энергии; одновременно из ядра вылетают новые нейтроны, которые вызывают деление соседних ядер. Химические и ядерные разветвленно-цепные процессы описываются сходными математическими моделями.
Что надо для начала
Чтобы началось горение, нужно выполнить ряд условий. Прежде всего, температура горючего вещества должна превышать некое предельное значение, которое называется температурой воспламенения. Знаменитый роман Рэя Брэдбери «451 градус по Фаренгейту» назван так потому, что примерно при этой температуре (233°C) загорается бумага. Это «температура воспламенения», выше которой твердое топливо выделяет горючие пары или газообразные продукты разложения в количестве, достаточном для их устойчивого горения. Примерно такая же температура воспламенения и у сухой сосновой древесины.

Температура пламени зависит от природы горючего вещества и от условий горения. Так, температура в пламени метана на воздухе достигает 1900°C, а при горении в кислороде — 2700°C. Еще более горячее пламя дают при сгорании в чистом кислороде водород (2800°C) и ацетилен (3000°C). Недаром пламя ацетиленовой горелки легко режет почти любой металл. Самую же высокую температуру, около 5000°C (она зафиксирована в Книге рекордов Гиннесса), дает при сгорании в кислороде легкокипящая жидкость — субнитрид углерода С4N2 (это вещество имеет строение дицианоацетилена NC–C=C–CN). А по некоторым сведениям, при горении его в атмосфере озона температура может доходить до 5700°C. Если же эту жидкость поджечь на воздухе, она сгорит красным коптящим пламенем с зелено-фиолетовой каймой. С другой стороны, известны и холодные пламена. Так, например, горят при низких давлениях пары фосфора. Сравнительно холодное пламя получается и при окислении в определенных условиях сероуглерода и легких углеводородов; например, пропан дает холодное пламя при пониженном давлении и температуре от 260–320°C.
Только в последней четверти ХХ века стал проясняться механизм процессов, происходящих в пламени многих горючих веществ. Механизм этот очень сложен. Исходные молекулы обычно слишком велики, чтобы, реагируя с кислородом, непосредственно превратиться в продукты реакции. Так, например, горение октана, одного из компонентов бензина, выражается уравнением 2С8Н18 + 25О2 = 16СО2 + 18Н2О. Однако все 8 атомов углерода и 18 атомов водорода в молекуле октана никак не могут одновременно соединиться с 50 атомами кислорода: для этого должно разорваться множество химических связей и образоваться множество новых. Реакция горения происходит многостадийно — так, чтобы на каждой стадии разрывалось и образовывалось лишь небольшое число химических связей, и процесс состоит из множества последовательно протекающих элементарных реакций, совокупность которых и представляется наблюдателю как пламя. Изучать элементарные реакции сложно прежде всего потому, что концентрации реакционно-способных промежуточных частиц в пламени крайне малы.
Внутри пламени
Оптическое зондирование разных участков пламени с помощью лазеров позволило установить качественный и количественный состав присутствующих там активных частиц — осколков молекул горючего вещества. Оказалось, что даже в простой с виду реакции горения водорода в кислороде 2Н2 + О2 = 2Н2О происходит более 20 элементарных реакций с участием молекул О2, Н2, О3, Н2О2, Н2О, активных частиц Н, О, ОН, НО2. Вот, например, что написал об этой реакции английский химик Кеннет Бэйли в 1937 году: «Уравнение реакции соединения водорода с кислородом — первое уравнение, с которым знакомится большинство начинающих изучать химию. Реакция эта кажется им очень простой. Но даже профессиональные химики бывают несколько поражены, увидев книгу в сотню страниц под названием «Реакция кислорода с водородом», опубликованную Хиншельвудом и Уильямсоном в 1934 году». К этому можно добавить, что в 1948 году была опубликована значительно большая по объему монография А. Б. Налбандяна и В. В. Воеводского под названием «Механизм окисления и горения водорода».
Современные методы исследования позволили изучить отдельные стадии подобных процессов, измерить скорость, с которой различные активные частицы реагируют друг с другом и со стабильными молекулами при разных температурах. Зная механизм отдельных стадий процесса, можно «собрать» и весь процесс, то есть смоделировать пламя. Сложность такого моделирования заключается не только в изучении всего комплекса элементарных химических реакций, но и в необходимости учитывать процессы диффузии частиц, теплопереноса и конвекционных потоков в пламени (именно последние устраивают завораживающую игру языков горящего костра).
Откуда все берется
Основное топливо современной промышленности — углеводороды, начиная от простейшего, метана, и кончая тяжелыми углеводородами, которые содержатся в мазуте. Пламя даже простейшего углеводорода — метана может включать до ста элементарных реакций. При этом далеко не все из них изучены достаточно подробно. Когда горят тяжелые углеводороды, например те, что содержатся в парафине, их молекулы не могут достичь зоны горения, оставаясь целыми. Еще на подходе к пламени они из-за высокой температуры расщепляются на осколки. При этом от молекул обычно отщепляются группы, содержащие два атома углерода, например С8Н18 → С2Н5 + С6Н13. Активные частицы с нечетным числом атомов углерода могут отщеплять атомы водорода, образуя соединения с двойными С=С и тройными С≡С связями. Было обнаружено, что в пламени такие соединения могут вступать в реакции, которые не были ранее известны химикам, поскольку вне пламени они не идут, например С2Н2 + О → СН2 + СО, СН2 + О2 → СО2 + Н + Н.
Постепенная потеря водорода исходными молекулами приводит к увеличению в них доли углерода, пока не образуются частицы С2Н2, С2Н, С2. Зона сине-голубого пламени обусловлена свечением в этой зоне возбужденных частиц С2 и СН. Если доступ кислорода в зону горения ограничен, то эти частицы не окисляются, а собираются в агрегаты — полимеризуются по схеме С2Н + С2Н2 → С4Н2 + Н, С2Н + С4Н2 → С6Н2 + Н и т. д.
В результате образуются частицы сажи, состоящие почти исключительно из атомов углерода. Они имеют форму крошечных шариков диаметром до 0,1 микрометра, которые содержат примерно миллион атомов углерода. Такие частицы при высокой температуре дают хорошо светящееся пламя желтого цвета. В верхней части пламени свечи эти частицы сгорают, поэтому свеча не дымит. Если же происходит дальнейшее слипание этих аэрозольных частиц, то образуются более крупные частицы сажи. В результате пламя (например, горящей резины) дает черный дым. Такой дым появляется, если в исходном топливе повышена доля углерода относительно водорода. Примером могут служить скипидар — смесь углеводородов состава С10Н16 (CnH2n–4), бензол С6Н6 (CnH2n–6), другие горючие жидкости с недостатком водорода — все они при горении коптят. Коптящее и ярко светящее пламя дает горящий на воздухе ацетилен С2Н2 (CnH2n–2); когда-то такое пламя использовали в ацетиленовых фонарях, установленных на велосипедах и автомобилях, в шахтерских лампах. И наоборот: углеводороды с высоким содержанием водорода — метан СН4, этан С2Н6, пропан С3Н8, бутан С4Н10 (общая формула CnH2n+2) — горят при достаточном доступе воздуха почти бесцветным пламенем. Смесь пропана и бутана в виде жидкости под небольшим давлением находится в зажигалках, а также в баллонах, которые используют дачники и туристы; такие же баллоны установлены в автомобилях, работающих на газе. Сравнительно недавно было обнаружено, что в копоти часто присутствуют шарообразные молекулы, состоящие из 60 атомов углерода; их назвали фуллеренами, а открытие этой новой формы углерода было ознаменовано присуждением в 1996 году Нобелевской премии по химии.
