Какие свойства характерны только для аморфных тел перечислить
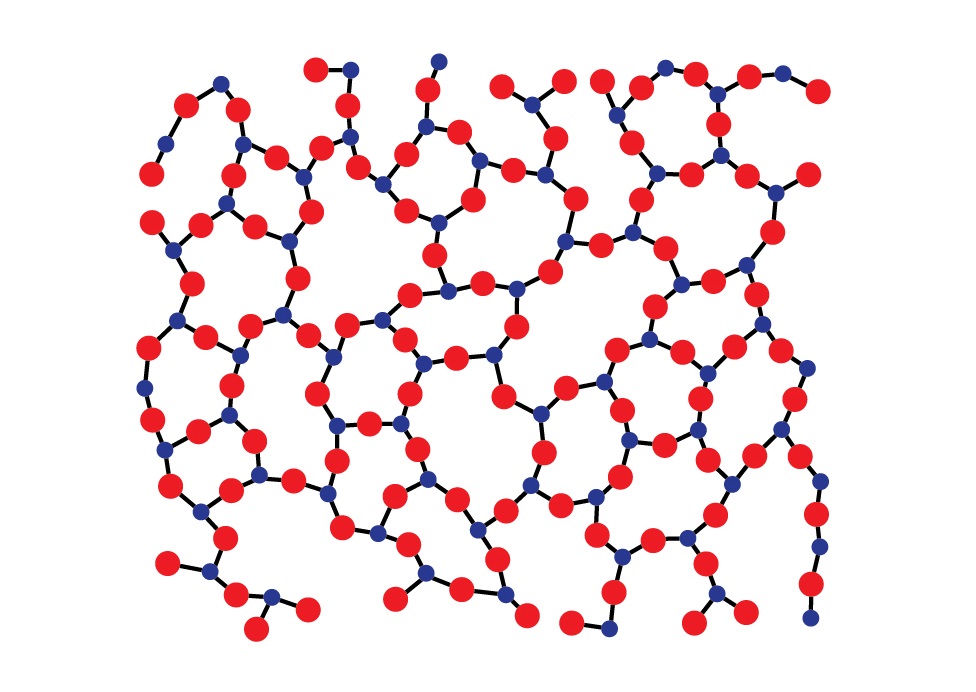
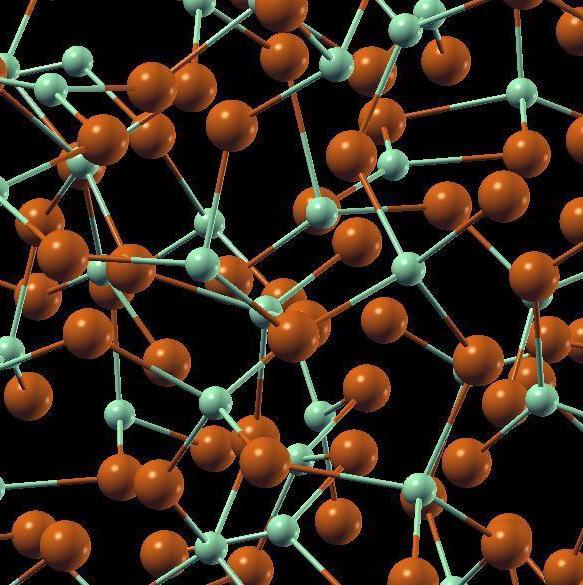
Аморфные тела (структура диоксида кремния)
Твердые тела разделяют на аморфные и кристаллические, в зависимости от их молекулярной структуры и физических свойств.
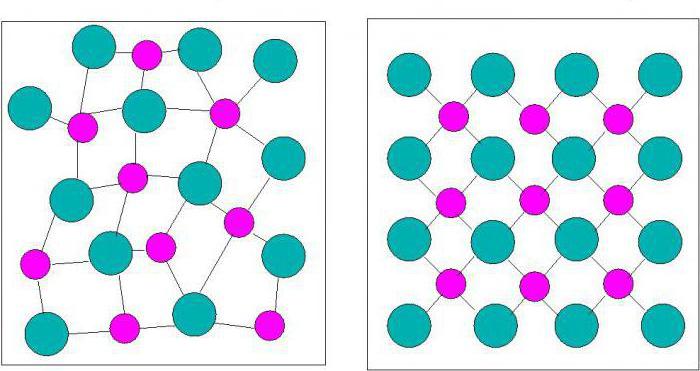
В отличие от кристаллов молекулы и атомы аморфных твердых тел не формируют решетку, а расстояние между ними колеблется в пределах некоторого интервала возможных расстояний. Иначе говоря, у кристаллов атомы или молекулы взаимно расположены таким образом, что формируемая структура может повторяться во всем объеме тела, что называется дальним порядком. В случае же с аморфными телами – сохраняется структура молекул лишь относительно каждой одной такой молекулы, наблюдается закономерность в распределении только соседних молекул – ближний порядок. Наглядный пример представлен ниже.
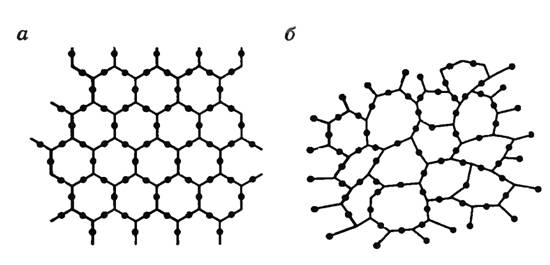
На рисунке слева (а) изображена решетка молекул кварца, а справа (б) расположение молекул кварцевого стекла, которое является аморфным телом.
К аморфным телам относится стекло и другие вещества в стеклообразном состоянии, канифоль, смолы, янтарь, сургуч, битум, воск, а также органические вещества: каучук, кожа, целлюлоза, полиэтилен и др.
Свойства аморфных тел
Особенность строения аморфных твердых тел придает им индивидуальные свойства:
- Слабо выраженная текучесть – одно из наиболее известных свойств таких тел. Примером будут потеки стекла, которое долгое время стоит в оконной раме.
- Аморфные твердые тела не обладают определенной температурой плавления, так как переход в состояние жидкости во время нагрева происходит постепенно, посредством размягчения тела. По этой причине к таким телам применяют так называемый температурный интервал размягчения.
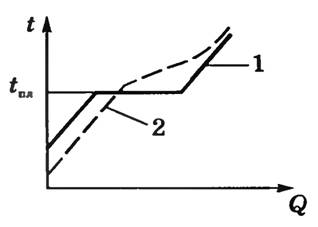
График перехода аморфного тела в жидкое состояние изображен пунктирной линией (2), а график перехода обычного твердого тела в жидкое состояние – сплошной (1).
- В силу своей структуры такие тела являются изотропными, то есть их физические свойства не зависят от выбора направления.
- Вещество в аморфном состоянии обладает большей внутренней энергией, нежели в кристаллическом. По этой причине аморфные тела способны самостоятельно переходить в кристаллическое состояние. Данное явление можно наблюдать как результат помутнения стекол с течением времени.
Стеклообразное состояние
В природе существуют жидкости, которые практически невозможно перевести в кристаллическое состояние посредством охлаждения, так как сложность молекул этих веществ не позволяет им образовать регулярную кристаллическую решетку. К таким жидкостям относятся молекулы некоторых органических полимеров.
Материалы по теме
Однако, при помощи глубокого и быстрого охлаждения, практически любое вещество способно перейти в стеклообразное состояние. Это такое аморфное состояние, которое не имеет явной кристаллической решетки, но может частично кристаллизироваться, в масштабах малых кластеров. Данное состояние вещества является метастабильным, то есть сохраняется при некоторых требуемых термодинамических условиях.
При помощи технологии охлаждения с определенной скоростью вещество не будет успевать кристаллизоваться, и преобразуется в стекло. То есть чем выше скорость охлаждения материала, тем меньше вероятность его кристаллизации. Так, например, для изготовления металлических стекол потребуется скорость охлаждения, равная 100 000 – 1 000 000 Кельвин в секунду.
В природе вещество существует в стеклообразном состоянии возникает из жидкой вулканической магмы, которая, взаимодействуя с холодной водой или воздухом, быстро охлаждается. В данном случае вещество зовется вулканическим стеклом. Также можно наблюдать стекло, образованная в результате плавления падающего метеорита, взаимодействующего с атмосферой – метеоритное стекло или молдавит.

Молдавит, естественное стекло, образованное ударом метеорита, из Беседин, Богемия, Чехия.
Нужно помнить, что не все тела, которые существуют на планете Земля, имеют кристаллическое строение. Исключения из правила получили название «аморфные тела». Чем же они отличаются? Исходя из перевода данного термина – аморфный – можно предположить о том, что такие вещества отличаются от других своей формой или видом. Речь идет об отсутствии так называемой кристаллической решетки. Процесс расщепления, при котором появляются грани, не происходит. Аморфные тела также отличаются тем, что не зависят от окружающей среды, и их свойства постоянны. Такие вещества называются изотропными.

Небольшая характеристика аморфных тел
Из школьного курса физики можно вспомнить то, что аморфные вещества имеют такое строение, при котором атомы в них расположены в хаотичном порядке. Определенное место могут иметь лишь структуры-соседи, где такое расположение является вынужденным. Но все же проводя аналогию с кристаллами, аморфные тела не обладают строгой упорядоченностью молекул и атомов (в физике такое свойство получило название «дальний порядок»). В результате исследований было выяснено, что по своей структуре данные вещества схожи с жидкостями.
Некоторые тела (в качестве примера можно взять диоксид кремния, чья формула SiO2) могут одновременно находиться в аморфном состоянии и иметь кристаллическую структуру. Кварц в первом варианте обладает структурой неправильной решетки, во втором – правильного шестиугольника.

Свойство №1
Как уже говорилось выше, аморфные тела не обладают кристаллической решеткой. Их атомы и молекулы имеют ближний порядок размещения, что и будет первым отличительным свойством данных веществ.
Свойство №2
Текучестью данные тела обделены. Для того чтобы лучше объяснить второе свойство веществ, можно сделать это на примере воска. Ни для кого не секрет, что если налить воду в воронку, то она просто выльется из нее. То же самое будет и с любыми другими текучими веществами. А свойства аморфных тел не позволяют им проделывать такие «трюки». Если воск поместить в воронку, то он предварительно растечется по поверхности и лишь потом начнет стекать с нее. Это связано с тем, что молекулы в веществе перескакивают из одного положения равновесия в абсолютно другое, не имея основного местоположения.

Свойство №3
Пора поговорить о процессе плавления. Следует запомнить тот факт, что аморфные вещества не имеют определенной температуры, при которой начинается плавление. Во время поднятия градуса тело постепенно становится мягче и затем превращается в жидкость. Физики всегда делают упор не на температуре, при которой данный процесс начал происходить, а на соответствующем температурном интервале плавления.
Свойство №4
О нем уже было сказано выше. Аморфные тела изотропны. То есть их свойства в любом направлении неизменны, даже если условия пребывания в местах различны.
Свойство №5
Хоть раз каждый человек наблюдал, что с течением определенного промежутка времени стекла начинали мутнеть. Это свойство аморфных тел связно с повышенной внутренней энергией (она в разы больше, чем у кристаллов). Из-за этого данные вещества спокойно сами могут перейти в кристаллическое состояние.
Переход к кристаллическому состоянию
Спустя определенный промежуток времени любое аморфное тело переходит в кристаллическое состояние. Это можно наблюдать в привычной жизни человека. Например, если оставить леденец или мед на несколько месяцев, то можно заметить, что они оба потеряли свою прозрачность. Обычный человек скажет, что они просто засахарились. И правда, если разломать тело, то можно заметить наличие кристаллов сахара.
Итак, говоря об этом, необходимо уточнить, что самопроизвольное превращение в другое состояние связано с тем, что аморфные вещества неустойчивы. Сравнивая их с кристаллами, можно понять, что последние в разы «мощнее». Объяснить факт можно благодаря межмолекулярной теории. Согласно ей, молекулы постоянно перескакивают с одного места на другое, тем самым заполняя пустоты. Со временем образуется устойчивая кристаллическая решетка.
Плавление аморфных тел
Процессом плавления аморфных тел называется момент, когда с поднятием температуры все связи между атомами рушатся. Именно тогда вещество превращается в жидкость. Если условия плавления таковы, что давление одинаково на протяжении всего периода, то температура также должна быть фиксированной.

Жидкие кристаллы
В природе существуют тела, которые имеют жидкокристаллическую структуру. Как правило, они входят в перечень органических веществ, а их молекулы обладают нитевидной формой. Тела, о которых идет речь, обладают свойствами жидкостей и кристаллов, а именно текучестью и анизотропией.
В таких веществах молекулы располагаются параллельно друг другу, однако, между ними нефиксируемое расстояние. Они движутся постоянно, но ориентацию менять несклонны, поэтому постоянно находятся в одном положении.
Аморфные металлы
Аморфные металлы больше известны обычному человеку под названием металлические стекла.
Еще в 1940 году ученые заговорили о существовании данных тел. Уже тогда стало известно, что специально полученные вакуумным напылением металлы, не имели кристаллических решеток. И лишь через 20 лет было произведено первое стекло такого типа. Особого внимания у ученых оно не вызвало; и только спустя еще 10 лет о нем заговорили американские и японские профессионалы, а потом уже корейские и европейские.
Аморфные металлы отличаются вязкостью, достаточно высоким уровнем прочности и стойкостью к коррозии.
1. Идеальные монокристаллы. К ним
относятся твердые тела, в которых реализуется идеальная трансляционная симметрия
в расположении атомов, то есть реализуется идеальный дальний порядок. Это
означает, что атомы расположены регулярно и по сортам, и по расстояниям.
Рассмотрим
кристалл каменной соли NaCl, элементарная ячейка которого представлена на рис.
Вдоль осей XYZ
атомы натрия Na и хлора Cl чередуются. Такой мотив расположения атомов в
пространстве продолжается до бесконечности и получается трансляцией (смещением)
базисной группы атомов на вектор, соединяющий в любом направлении два атома
одного и того же сорта. Вектор, смещение на который позволяет совместить
систему атомов саму с собой, называется вектором трансляции.
Структурный тип.
Структура
кристалла — это конкретное расположение частиц в пространстве. Описывая
структуру, надо указывать вид и размер частиц и расстояние между ними. Но так
как многие структуры сходны, можно иногда указывать лишь относительное
расположение частиц (атомов или атомных групп) в кристалле, а не абсолютные
расстояния между ними. Так определяется структурный тип
Полиморфизм кристаллов.
Полиморфизм
кристаллов — способность некоторых минералов и иных кристаллических веществ существовать
при одном и том же химическом составе в состояниях с различной атомной
кристаллической структурой. Каждое из таких состояний (термодинамических фаз),
называется полиморфной модификацией, устойчивой при определённых внешних
условиях (температуре и давлении). Полиморфизм был открыт в 1798г., когда было
обнаружено, что СаСО3 может существовать в виде 2 минералов —
кальцита и арагонита. Полиморфизмом обладают простые вещества (Аллотропия), а
также неорганические и органические соединения. Так, углерод имеет 2
модификации: кубическую (алмаз) и гексагональную (графит), резко различающиеся
по физическим свойствам.
Аллотропия
(от греч. allos — другой, греч. tropos — поворот, свойство) — существование
одного и того же химического элемента в виде двух и более простых веществ,
различных по строению и свойствам, т. е. аллотропических модификаций или
аллотропических форм. Примеры аллотропии: 1) О2 — кислород и О3
— озон. Кислород бесцветен, не имеет запаха, озон же пахуч, имеет
бледно-фиолетовый цвет, он более бактерициден. 2) Красный фосфор и белый
фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться,
красный фосфор неядовит, не светится в темноте, сам по себе не воспламеняется.
Аллотропия может быть результатом образования молекул с различным числом атомов
(например, атомарный кислород O, молекулярный кислород O2 и озон O3) или
образования различных кристаллических форм (например, графит и алмаз); в этом
случае аллотропия — частный случай полиморфизма.
2. Монокристаллы с дефектами
решетки — реальные монокристаллы. Дефекты решетки представляют собой нарушения
дальнего порядка и возникают при росте кристаллов или их фазовых превращениях,
под влиянием тепловых, механических, электрических и других воздействий, при
введении примесей. Различают точечные (нульмерные), линейные (одномерные),
поверхностные (двумерные) и объёмные (трёхмерные) дефекты.
В твердых
растворах говорят о среднем дальнем порядке. Как идеальные монокристаллы, так и
монокристаллы с дефектами характеризуются анизотропией свойств.
К линейным
дефектам относятся дислокации. Дислокации — это такие нарушения структуры,
когда искажение проходит через весь кристалл по линии. Простейший пример —
краевая дислокация: отсутствие полуплоскости в кристалле. Линия дислокации проходит
через весь кристалл. Скопление дислокаций при точечном дефекте приводит к
разбиению кристалла на отдельные куски — зерна.
Любые
дислокации приводят к изменению свойств материала (полезные и вредные дефекты).
От дефектов зависят многие важнейшие свойства кристаллов — механические,
оптические, электрические, магнитные и т.д. В совершенной кристаллической
решётке невозможно движение атомов и ионов, так как одновременный обмен местами
двух или более атомов (их миграция) энергетически мало вероятен.
3. Поликристаллы — вещества, состоящие из большого числа различным
образом ориентированных сравнительно небольших монокристаллов (зерен),
правильных или содержащих дефекты.
В
поликристаллах дальний порядок сохраняется лишь в пределах каждого зерна.
4. Двумерные (квазиплоские) системы — пленки или поверхностные слои
твердых тел, в которых трансляционная симметрия сохраняется лишь в плоскости.
5. Аморфные тела — вещества, в которых отсутствует трансляционная
симметрия, т. е. нет дальнего порядка. В аморфных веществах сохраняется ближний
порядок в расположении образующих его частиц в пределах нескольких межатомных
расстояний. Это означает, что расстояния между соседними атомами в любой точке
объема оказываются примерно одинаковыми, но с возрастанием расстояния от данной
точки регулярность в расположении атомов нарушается. Для аморфных материалов
характерна изотропия свойств.
6. Жидкие кристаллы (молекулы выстраиваются в определенный порядок, но
силы маленькие).
Жидкие
кристаллы- это вещества, обладающие одновременно свойствами как жидкостей
(текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой
жидкости, похожие на желе, состоящие из молекул вытянутой формы, определённым
образом упорядоченных во всем объёме этой жидкости. Наиболее характерным
свойством ЖК является их способность изменять ориентацию молекул под
воздействием электрических полей, что открывает широкие возможности для
применения их в промышленности

Рис. ЖК.
Применение ЖК.
Одно из
важных направлений использования жидких кристаллов — термография. Подбирая
состав жидкокристаллического вещества, создают индикаторы для разных диапазонов
температуры и для различных конструкций. Например, жидкие кристаллы в виде
плёнки наносят на транзисторы, интегральные схемы и печатные платы электронных
схем. Неисправные элементы — сильно нагретые или холодные, неработающие — сразу
заметны по ярким цветовым пятнам. Новые возможности получили врачи:
жидкокристаллический индикатор на коже больного быстро диагностирует скрытое
воспаление и даже опухоль. С помощью жидких кристаллов обнаруживают пары?
вредных химических соединений и опасные для здоровья человека гамма- и
ультрафиолетовое излучения. На основе жидких кристаллов созданы измерители
давления, детекторы ультразвука. Но самая многообещающая область применения
жидкокристаллических веществ — информационная техника. От первых индикаторов,
знакомых всем по электронным часам, до цветных телевизоров с
жидкокристаллическим экраном размером с почтовую открытку прошло лишь несколько
лет. Такие телевизоры дают изображение весьма высокого качества, потребляя
ничтожное количество энергии от малогабаритного аккумулятора или батарейки.
7. Фуллерены.
Фуллерены — молекулярные соединения, принадлежащие
классу аллотропных форм углерода (другие — алмаз, карбин и графит) и
представляющие собой выпуклые замкнутые многогранники, составленные из чётного
числа трёхкоординированных атомов углерода. Своим названием эти соединения
обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру, чьи геодезические
конструкции построены по этому принципу. Первоначально данный класс соединений
был ограничен лишь структурами, включающими только пяти- и шестиугольные грани.


Рис. Фуллерены.
Подведем
итог:
Все
твёрдые тела делятся на кристаллические и аморфные. Мы рассмотрели, в чём их
сходство и различие. Кристаллы – это твёрдые тела,
атомы или молекулы которых занимают определённые, упорядоченные положения в
пространстве. Кристаллические тела делятся на монокристаллы и поликристаллы.
Монокристаллы – одиночные кристаллы. Монокристаллами наз. одиночные кристаллы,
имеющие макроскопическую упорядоченную кристаллическую решетку. Поликристаллы –
это твёрдые тела, состоящие из большого числа кристаллов, беспорядочно
ориентированных друг относительно друга. Одним из наиболее существенных
свойств монокристаллов является анизотропия – зависимость (неодинаковость)
физических свойств кристалла от направления. Но в отличии от монокристаллов,
поликристаллы изотропны, т.е. физические свойства одинаковые по всем
направлениям. Это объясняется тем, что кристаллы внутри располагаются
беспорядочно, и каждый в отдельности обладает анизотропией, а в целом кристалл
изотропен. Свойства кристаллических тел: правильность геометрической
формы, постоянная температура плавления, анизотропия свойств.
Аморфные
тела – это твёрдые тела, где сохраняется только ближний порядок в расположении
атомов. (Кремнезём, смола, стекло, канифоль, сахарный леденец). Отличие в
характере движения: частицы не только совершают колебательные движения, но
совершают скачки (движения характерные для жидкой фазы состояния вещества)
Свойства аморфных тел: отсутствие симметрии, отсутствие постоянной температуры
плавления, изотропия свойств.
Аморфные
тела – жидкости с очень большой вязкостью (при низких температурах ведут себя
как кристаллические тела, при высоких температурах и постоянной нагрузке – как
жидкости).
В аморфных телах не наблюдается строгого порядка в расположении их частиц.
ведения о | Состояние твердого тела | ||
Кристаллическое | Аморфное | ||
Монокристаллы | Поликристаллы | ||
Строение | Кристаллическая | Кристаллическая | Ближний |
Свойства | Анизотропия Правильность Постоянная | Изотропны Правильность Постоянная | Отсутствие Изотропия Отсутствие |
Проверь правильность заполнения таблицы:
Характеристики | Тип решетки | |||
атомная | ионная | молекулярная | металлическая | |
Вид частиц в узлах решетки | Атомы | Ионы: катионы, анионы | Молекулы | Атом-ионы |
Характер химической связи между частицами | Ковалентная | Ионная | Силы межмолекулярного | Металлическая связь |
Прочность связи | Очень прочная | Прочная | Слабая | Разной прочности |
Отличительные свойства веществ | Твердые, тугоплавкие, нелетучие, | Твердые, туго | Хрупкие, легкоплавкие, | Металлический блеск, |
Примеры веществ | Кремний, алмаз | Поваренная соль, | Йод, лед, «сухой лед» | Медь, железо, золото |
