Какие свойства характерны для атома кальция
Кальций — это распространенный элемент, часто встречающийся в природе в виде различных соединений, в основном — солей. Скелет любого организма обязан своим существованием этому веществу. Такой важный элемент заслуживает более пристального внимания, поэтому далее будет дана подробная характеристика химического элемента, рассмотрено строение атома кальция….
Признаки
В природе в чистом виде вещество не встречается, определить физические свойства кальция можно только в лабораторных условиях:
- простое состояние это металл, обладающий твердостью, пластичностью, который легко режется,
- плавится при температуре — 842 С,
- температура кипения — 1482С,
- плотность составляет 1,54 г/см3 при 20,
- модуль упругости — 2600 кгс/мм2,
- предельное значение упругости — 0,4 кгс/мм2,
- твердость по Бринеллю — 20-30 кгс/мм2,
- имеет серебристо-белый оттенок,
- при нагревании загорается, пламя имеет кирпично-красный цвет.
 Одной из специфических особенностей является способность изменять свои свойства под давлением. Сначала он теряет металлические качества, проявляя качества полупроводника.
Одной из специфических особенностей является способность изменять свои свойства под давлением. Сначала он теряет металлические качества, проявляя качества полупроводника.
При повышенном давлении металлические свойства возвращаются, элемент приобретает сверхпроводимость. Относится к типу щелочно-земельных металлов.
Атомный порядковый номер элемента — 20. Официально принятое обозначение — Ca (по лат. Calcium).
Каковы химические свойства кальция? Элемент обладает повышенной степенью активности, благодаря чему в чистом виде никогда не встречается. Соединения кальция, напротив, встречаются повсеместно — в составе многочисленных горных пород и организмов. На открытом воздухе происходит быстрая реакция с кислородом или углеводородом, отчего на поверхности элемента возникает серый налет.
С кислотами реагирует бурно, иногда происходит воспламенение. Не менее активно протекает реакция с водой, она сопровождается обильным выделением водорода. Образовавшийся раствор дает щелочную реакцию. Высокая химическая активность кальция, его мгновенное окисление на воздухе вынуждают хранить его в плотно закрытой стеклянной таре, покрытым слоем парафина или под слоем керосина.
С кислородом или галогенами соединяется при обычных условиях. С фосфором, водородом, серой, азотом, углеродом и прочими неметаллическими элементами вступает в химическую реакцию при нагревании, а со фтором реакция идет даже на холоде. С водой взаимодействует активно, с холодной — медленнее, с горячей — очень бурно.
Атомная структура
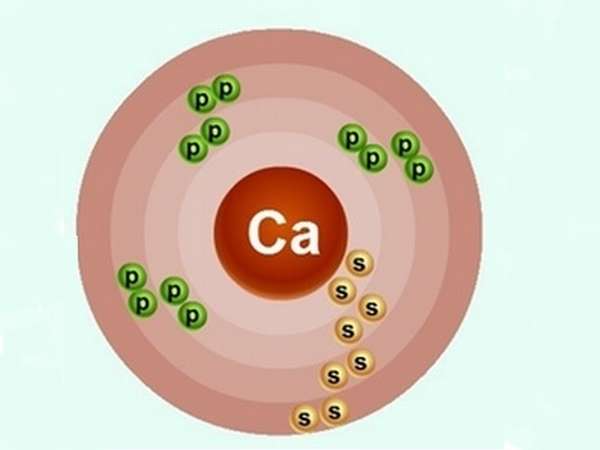
 Рассмотрим строение атома кальция. Ядро несет положительный заряд (+20). Внутри него имеются 20 нейтронов и столько же протонов, вокруг ядра движутся по 4 орбитам 20 электронов, распределенных по 2:8:8:2.
Рассмотрим строение атома кальция. Ядро несет положительный заряд (+20). Внутри него имеются 20 нейтронов и столько же протонов, вокруг ядра движутся по 4 орбитам 20 электронов, распределенных по 2:8:8:2.
Степень окисления кальция равняется +2. На внешнем энергетическом уровне атом содержит 2 спаренных s-электрона, которые он легко отдает при химических реакциях.
Они определяют валентность элемента. Электронное строение атома кальция: 1s2 2s2 2p6 3s2 3p6 4s2 (коротко 4s2).
Внимание! Моль — это определенное (6,02 · 1023) количество молекул. Моль одного вещества имеет массу, отличающуюся от массы моля другого вещества, поскольку строение молекул и, соответственно, их вес будут разными.
Молярная масса кальция — это отношение массы вещества к числу молей: Формула, по которой рассчитывается масса в молях:
,Где M — молярная масса.
m — масса вещества.
n — количество моль.
Молярная масса кальция составляет 40,08 г/моль.
Каково отличие атомов от ионов
Ионы — это частицы, образованные при удалении или присоединении электронов к атому. Бывают положительно (катион) или отрицательно (анион) заряженными при потере или получении дополнительных электронов. Могут существовать как в составе молекул химических соединений, так и в самостоятельном виде (плазма, газ или жидкость).
Строение атома кальция отличается от иона. Атом представляет собой нейтральную частицу с одинаковым количеством электронов и протонов. В этом заключается основное отличие атома от иона.
Атом кальция отличается от иона своим зарядом и свойствами. Строение атома кальция таково, что на внешней оболочке находятся 2 электрона, которые могут вступать в различные связи. При соединении элемента 2 внешних электрона переходят на орбиты других атомов, превращая нейтральный атом в положительно заряженный ион Ca++. При этом атом имеет восстановительные свойства, а ион — окислительные.
Главные особенности
 В таблице Менделеева элемент помещен во II группу 4 периода главной подгруппы (А), и все без исключения элементы этой группы относятся к щелочноземельным металлам, со всеми соответствующими признаками и свойствами.
В таблице Менделеева элемент помещен во II группу 4 периода главной подгруппы (А), и все без исключения элементы этой группы относятся к щелочноземельным металлам, со всеми соответствующими признаками и свойствами.
В отличие от типичных металлов кальций обладает некоторыми специфическими свойствами. Есть основания предположить, что это неметалл.
При определенных условиях, как было сказано выше, под высоким давлением он утрачивает металлические свойства.
Элемент химически активен, поэтому в природе соединения кальция содержатся в виде солей, главным образом, в составе минералов или отложений земной коры. Также большое количество кальция содержится в морской воде, где его доля составляет около 1 г/л. Тело человека содержит около 1-1,5 кг вещества, причем, большая его часть содержится в костях, обеспечивая их прочность.
Наиболее богаты кальцием осадочные породы:
- мел.
- известняк.
- гипс.
- мрамор.
- доломит.
- апатит.
Все внутрипещерные образования, сталактиты и сталагмиты представляют собой карбонат СаС03. Строение атома позволяет ему активно вступать в реакцию с другими веществами, поэтому количество разнообразных соединений весьма велико.
Элемент является щелочноземельным металлом. поскольку, вступая в реакцию он отдает электроны, то является восстановителем и степень окисления кальция в соединениях +2. У простого элемента степень окисления равна нулю, как и у всех металлов, поскольку у них равномерно распределена электронная плотность. В неорганической химии понятие «степень окисления» часто тождественно понятию «валентность».
Сфера использования
 Каково применение кальция? Основное направление — металлургия. Он выполняет роль восстановителя при производстве меди, хрома, нержавеющей стали, урана, никеля, тория.
Каково применение кальция? Основное направление — металлургия. Он выполняет роль восстановителя при производстве меди, хрома, нержавеющей стали, урана, никеля, тория.
Для получения редко встречающихся земных элементов металлическую разновидность применяют в металлотермии, причем довольно широко.
Для раскисления стали (удаления кислорода, находящегося в расплаве) используют в составе соединения с алюминием или в качестве отдельного химического элемента.
Кроме того, металлический элемент используется как легирующая добавка, увеличивающая прочность подшипников, ответственных деталей двигателей или летательных аппаратов.
Применяется в нефтеперерабатывающей промышленности для удаления серы, служит для обезвоживания различных органических жидкостей. С его помощью в промышленности производится очистка аргона от азотистых примесей.
Не менее широко используется в медицине, воздействует на многие функции организма, в связи с чем количество элемента постоянно должно пополняться. Кроме того, способствует выводу из организма радионуклидов. Препараты глюконат кальция, хлористый кальций, гипс и другие широко применяются для лечения или профилактики различных заболеваний.
Какую роль играет внутри организма
Имеет важное структурное значение, являясь строительным материалом для твердых покровов, костей, зубов, роговых пластин, копыт животных. Раковины моллюсков практически полностью состоят из кальцинированных соединений. Велика биологическая роль кальция. В организме человека он осуществляет массу функций, участвуя в большинстве жизненно важных процессов:
- регулирует мышечные сокращения, секрецию нейромедиаторов,
- воздействуя на кровеносную систему, регулирует давление,
- принимает активное участие в регулировании свертывания крови и обмена веществ внутри клеток,
- участвует в постоянном обновлении состава костей,
- укрепляет иммунную систему,
- способствует синтезу ферментов и гормонов,
- воздействует на мышцы, регулирует сердечные сокращения,
- влияет на внутриклеточные процессы,
- защищает клетку, регулируя проницаемость мембраны.
Суточное пополнение организма человека кальцием должно составлять не менее 800-1250 мг, предельная норма — 2500 мг/сут.
Важно! Это единственный элемент, способный нормализовать кислотно-щелочной баланс в организме. Преобладание кислоты вызывает активное образование солей, камней в почках, создаст предпосылки к возникновению сердечно-сосудистых заболеваний.
Свойства кальция и его соединений
Химия. Элемент кальций
Заключение
Элемент имеет колоссальное значение в области химии, геологии, биологии, играет важнейшую роль в функционировании живых организмов и активно участвует в общих природных процессах.
Кальций — химический элемент II группы с атомным номером 20 в периодической системе, обозначается символом Ca (лат. Calcium). Кальций – мягкий щелочно-земельный металл серебристо-серого цвета.
20 элемент таблицы МенделееваНазвание элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций.
Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад.
Кальций один из наиболее распространенных на Земле элементов. Соединения кальция находятся практически во всех животных и растительных тканях. На его долю приходится 3,38 % массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа).
Нахождение кальция в природе
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа). Содержание элемента в морской воде — 400 мг/л.
Изотопы
Кальций встречается в природе в виде смеси шести изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca и 48Ca, среди которых наиболее распространённый — 40Ca — составляет 96,97 %. Ядра кальция содержат магическое число протонов: Z = 20. Изотопы
40
20
Ca20 и
48
20
Ca28 являются двумя из пяти существующих в природе ядер с дважды магическим числом.
Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48Ca, самый тяжелый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), испытывает двойной бета-распад с периодом полураспада 1,6·1017 лет.
В горных породах и минералах
Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
Биологическая роль кальция
Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10−4 ммоль/л, в межклеточных жидкостях около 2,5 ммоль/л.
Потребность в кальции зависит от возраста. Для взрослых в возрасте 19-50 лет и детей 4-8 лет включительно дневная потребность (RDA) составляет 1000 мг (содержится примерно в 790 мл молока с жирностью 1 %), а для детей в возрасте от 9 до 18 лет включительно — 1300 мг в сутки (содержится примерно в 1030 мл молока жирностью 1 %). В подростковом возрасте потребление достаточного количества кальция очень важно из-за интенсивного роста скелета. Однако по данным исследований в США всего 11 % девочек и 31 % мальчиков в возрасте 12-19 лет достигают своих потребностей. В сбалансированной диете большая часть кальция (около 80 %) поступает в организм ребёнка с молочными продуктами. Оставшийся кальций приходится на зерновые (в том числе цельнозерновой хлеб и гречку), бобовые, апельсины, зелень, орехи. В «молочных» продуктах на основе молочного жира (сливочном масле, сливках, сметане, мороженом на основе сливок) кальция практически не содержится. Чем больше в молочном продукте молочного жира, тем меньше в нём кальция. Всасывание кальция в кишечнике происходит двумя способами: чрезклеточно (трансцеллюлярно) и межклеточно (парацелюллярно). Первый механизм опосредован действием активной формы витамина D (кальцитриола) и её кишечными рецепторами. Он играет большую роль при малом и умеренном потреблении кальция. При большем содержании кальция в диете основную роль начинает играть межклеточная абсорбция, которая связана с большим градиентом концентрации кальция. За счёт чрезклеточного механизма кальций всасывается в большей степени в двенадцатиперстной кишке (из-за наибольшей концентрации там рецепторов в кальцитриолу). За счёт межклеточного пассивного переноса абсорбция кальция наиболее активна во всех трёх отделах тонкого кишечника. Всасыванию кальция парацеллюлярно способствует лактоза (молочный сахар).
Усвоению кальция препятствуют некоторые животные жиры (включая жир коровьего молока и говяжий жир, но не сало) и пальмовое масло. Содержащиеся в таких жирах пальмитиновая и стеариновая жирные кислоты отщепляются при переваривании в кишечнике и в свободном виде прочно связывают кальций, образуя пальмитат кальция и стеарат кальция (нерастворимые мыла). В виде этого мыла со стулом теряется как кальций, так и жир. Этот механизм ответственен за снижение всасывания кальция, снижение минерализации костей и снижение косвенных показателей их прочности у младенцев при использовании детских смесей на основе пальмового масла (пальмового олеина). У таких детей образование кальциевых мыл в кишечнике ассоциируется с уплотнением стула, уменьшением его частоты, а также более частым срыгиванием и коликами.
Концентрация кальция в крови из-за её важности для большого числа жизненно важных процессов точно регулируется, и при правильном питании и достаточном потреблении обезжиренных молочных продуктов и витамина D дефицита не возникает. Длительный дефицит кальция и/или витамина D в диете приводит к увеличению риска остеопороза, а в младенчестве вызывает рахит.
Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию. Максимальная безопасная доза для взрослых в возрасте от 19 до 50 лет включительно составляет 2500 мг в сутки (около 340 г сыра Эдам).
| |||
| Свойства атома | |||
|---|---|---|---|
| Название, символ, номер | Ка́льций/Calcium (Ca), 20 | ||
| Атомная масса (молярная масса) | 40,078(4)а. е. м. (г/моль) | ||
| Электронная конфигурация | [Ar] 4s2 | ||
| Радиус атома | 197 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 174 пм | ||
| Радиус иона | (+2e) 99 пм | ||
| Электроотрицательность | 1,00 (шкала Полинга) | ||
| Электродный потенциал | −2,76 В | ||
| Степени окисления | 2 | ||
| Энергия ионизации (первый электрон) | 589,4 (6,11) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 1,55 г/см³ | ||
| Температура плавления | 1112 K | ||
| Температура кипения | 1757 K | ||
| Уд. теплота плавления | 9,20 кДж/моль | ||
| Уд. теплота испарения | 153,6 кДж/моль | ||
| Молярная теплоёмкость | 25,9 Дж/(K·моль) | ||
| Молярный объём | 29,9 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | кубическая гранецентрированная | ||
| Параметры решётки | 5,580 Å | ||
| Температура Дебая | 230 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) (201) Вт/(м·К) | ||
end_info>
КАЛЬЦИЙ, Ca (от лат. Calx, род. падеж calcis — известь *. а. calcium; н. Kalzium; ф. calcium; и. calcio), — химический элемент II группы периодической системы Менделеева, атомный номер 20, атомная масса 40,08. Состоит из шести стабильных изотопов: 40Ca (96,97%), 42Ca (0,64%), 43Ca (0,145%), 44Ca (2,06%), 46Ca (0,0033%) и 48Ca (0,185%). Открыт английским химиком Г. Дэви в 1808.
Физические свойства
Кальций — серебристо-белый лёгкий металл. Известны две кристаллические модификации: а-Ca с гранецентрированной кубической решёткой, а=0,55884±2 нм (26°С); выше 443°С Я-Ca с объёмноцентрированной кубической решёткой, а=0,4480+5 нм (467°С).
Физические свойства кальция: плотность 1550 кг/м3 (20°С); t плавления 842°С; t кипения 1491°С; коэффициент теплопроводности 125 Вт/м•К; уд. теплоёмкость (0-100°С) 623,9 Дж/кг•К; уд. электросопротивление (при 20°С) 4,6•10-8 Ом•м; температурный коэффициент электросопротивления 4,57•10-3 (при 20°С); коэффициент термического расширения при 0-300°С 22•10-6 К-1. Твёрдость кальция по Бринеллю 200-300 МПа. Кальций — пластичный металл; хорошо прессуется, прокатывается и подвергается обработке резанием.
Химические свойства
Степень окисления +2. Металлический кальций химически активен, обладает большим сродством к кислороду и при обычной температуре во влажном воздухе покрывается плёнкой (поэтому хранят его в масле или герметически закрытом сосуде). С горячей водой кальций легко реагирует с образованием гидрооксида Ca(OH)2 и выделением водорода. Энергично взаимодействует, особенно при нагревании, с различными неметаллами (Н2, С, N2, Si, Cl2 и др. с образованием соответственно гидрида, карбида, нитрида, силицида, хлорида и т.д.). В реакциях с кислотами кальций образует соответствующие соли, вытесняя водород.
Природный кальций
Кальций — один из самых распространённых (5-е место) петрогенных элементов земной коры — 3,27% (по массе). Кларк кальция в каменных метеоритах 1,40%, ультраосновных — 0,7%, основных — 6,72%, средних — 4,65%, кислых породах — 1,58% (по данным А. П. Виноградова). Кальций входит в состав многих минералов (силикаты, алюмосиликаты, боросиликаты, карбонаты, сульфаты, фосфаты, ванадаты, вольфраматы, молибдаты, титанаты, ниобаты, фториды, хлориды и др.; в метеоритах встречается редчайший сульфид кальция). В минералах кальция присутствуют замещающие его изоморфно элементы-примеси (Na, Sr, редкоземельные, радиоактивные и другие элементы). Силикаты (пироксены, амфиболы) и алюмосиликаты (плагиоклазы) кальция — важнейшие породообразующие минералы магматических и метаморфических пород; в условиях гидротермальных и поверхностных процессов становятся устойчивыми и широко распространены карбонаты кальция.
При выплавлении базальтовых магм кальций накапливается в расплаве и входит в главные породообразующие минералы, при фракционировании которых его содержание в дифференциации магмы от основных к кислым породам падает. При выветривании магматических, метаморфических и осадочных пород кальций выщелачивается и в бассейне осадконакопления выделяется преимущественно в виде органогенных известняков и доломитов, составляющих в среднем около 20% объёма осадочной толщи; в виде терригенной примеси пироксенов, плагиоклаза и др., а также карбонатов кальция входит в состав глин и песчаников. Содержание кальция в осадочных породах (по А. Б. Ронову и А. А. Ярошевскому): в глинах 2,9-3,4%, в песчаниках 2,4-4,1%, в карбонатах 27,8-30,3% (первая цифра — в платформенных отложениях, вторая — в геосинклинальных); в океанической воде 0,0408% (по А. П. Виноградову). Поведение кальция в морской воде контролируется режимом CO2:CaCO3тв+Н2О+CO2 Ca(HCO3)2раств («карбонатное равновесие») при активном участии живого вещества. Кальций из морской воды интенсивно поглощается известняковыми водорослями, моллюсками, кораллами и др. В поверхностном цикле кальция важную роль играют поверхностные и подземные воды. В известняковых массивах в результате растворения ими кальцита развиваются карстовые явления; в районах с влажным климатом почвы обеднены кальцием. При испарении морской воды в замкнутых бассейнах и солёных озёрах осаждаются помимо кальцита гипс и ангидрит.
Получение и применение
Получают металлический кальций двумя методами: электролизом расплава CaCl2 с использованием медно-кальциевого анода получают сплав Ca — Cu (~65% Ca), из которого в вакууме при 950-1000°С отгоняют Ca; при прокаливании смеси CaO и порошкообразного Al при 1200°С в вакууме выделяющиеся по реакции 6CaO+2Al=3CaOAl2О3+3Ca пары кальция конденсируют на холодной поверхности.
Металлический кальций находит применение при получении антифрикционных сплавов Pb — Na — Ca; сплав Pb — Ca используется для изготовления оболочки электрических кабелей. Кальций применяется также в качестве восстановителя U, Th, Cr, V, Zr и редкоземельных элементов из их оксидов или галогенидов, для удаления серы из нефтепродуктов, обезвоживания органических растворителей, в качестве поглотителя газов в электровакуумных приборах и др.
