Какие свойства глюкозы находят свое практическое применение

Получение глюкозы
В промышленности
Гидролизкрахмала:
(C6H10O5)n
+ nH2O t,H+→ nC6H12O6
крахмал глюкоза
В лаборатории
Из формальдегида
(1861 г
А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
В природе
Фотосинтез:
6CO2 + 6H2O
hν, хлорофилл → C6H12O6 +
6O2
Другие способы
Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза
глюкоза
C12H22O11 + H2O t,H+→ C6H12O6
+ C6H12O6
сахароза глюкоза
фруктоза
Химические свойства глюкозы
I.
Специфические свойства
Важнейшим свойством моносахаридов
является их ферментативное брожение, т.е. распад молекул на осколки под
действием различных ферментов. Брожение происходит в присутствии ферментов,
выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В
зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
3. Маслянокислоеброжение:
C6H12O6 → C3H7COOH
+ 2H2 ↑+ 2CO2↑
II. Свойства
альдегидов
1. Реакция серебряного зеркала:
Видео «Качественная реакция глюкозы саммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2t→ СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
3. Восстановление:
СH2OH(CHOH)4-COH
+ H2t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
III. Свойствамногоатомныхспиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии
газообразного хлористого водорода атом водорода гликозидного гидроксила
замещается на метильную группу.
α — глюкоза | + СH3ОН | HCl(газ)→ | + H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько
капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида
меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае
глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт,
образуя комплексное соединение – ярко синего цвета.
Видео
«Качественная реакция глюкозы с гидроксидом меди (II)»
(глюкозат меди (II) – синий раствор)
Применение
Глюкоза является ценным питательным
продуктом. В организме она подвергается сложным биохимическим превращениям в
результате которых образуется диоксид углерода и вода, при это выделяется
энергия согласно итоговому уравнению:
C6H12O6
+ 6O2 → 6H2O
+ 6CO2 + 2800 кДж
Так как глюкоза легко усваивается
организмом, её используют в медицине в качестве укрепляющего лечебного средства
при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и
противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле
(изготовление мармелада, карамели, пряников и т. д.), в текстильной
промышленности в качестве восстановителя, в качестве исходного продукта при
производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных
сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например,
при квашении капусты, огурцов, молока происходит молочнокислое брожение
глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса
недостаточно уплотнена, то под влиянием проникшего воздуха происходит
маслянокислое брожение и корм становится непригоден к применению. На практике
используется также спиртовое брожение глюкозы, например при производстве пива.
ВИДЕО:
Окислениеглюкозы кислородом воздуха в присутствии метеленового голубого
Определениеглюкозы в виноградном соке
Глюкоза С6Н12O6 представляет собой наиболее распространенный и наиболее важный моносахарид — гексозу. Она является структурной единицей большинства пищевых ди- и полисахаридов.
Биологическая роль глюкозы
Глюкоза образуется в природе в процессе фотосинтеза, протекающего под действием солнечного света в листьях растений:![]()
Глюкоза – ценное питательное вещество. Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций. При окислении ее в тканях освобождается энергия, необходимая для нормальной жизнедеятельности организмов:
![]()
Глюкоза – необходимый компонент обмена углеводов. Она необходима для образования в печени гликогена (запасной углевод человека и животных).
Уровень содержания глюкозы в крови человека постоянен. Во всем объеме крови взрослого человека содержится 5-6 г глюкозы. Такого количества достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности.
При снижении ее уровня в крови или высокой концентрации и невозможности использования, как это происходит при сахарном диабете, наступает сонливость, может наступить потеря сознания (гипогликемическая кома).
Строение глюкозы. Изомерия
Молекулярная формула глюкозы С6Н12О6.
В молекуле глюкозы присутствуют альдегидная и гидроксильная группы.
Видеоопыт «Распознавание глюкозы с помощью качественных реакций»
Моносахаридам свойственна также иная структура, возникающая в результате внутримолекулярной реакции между карбонильной группой с одним из спиртовых гидроксидов. Такая реакция внутри одной молекулы сопровождается ее циклизацией.

Известно, что наиболее устойчивыми являются 5-ти и 6-ти членные циклы. Поэтому, как правило, происходит взаимодействие карбонильной группы с гидроксилом при 4-м или 5-м углеродном атоме.
В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
Образование циклической формы глюкозы при взаимодействии альдегидной группы и спиртового гидроксила при С5 приводит к появлению нового гидроксила у С1 называемого полуацетальным (крайний правый). Он отличается от других большей реакционной способностью, а циклическую форму в этом случае называют также полуацетальной.
В кристаллическом состоянии глюкоза находится в циклической форме, а при растворении частично переходит в открытую и устанавливается состояние подвижного равновесия.
Например, в водном растворе глюкозы существуют следующие структуры: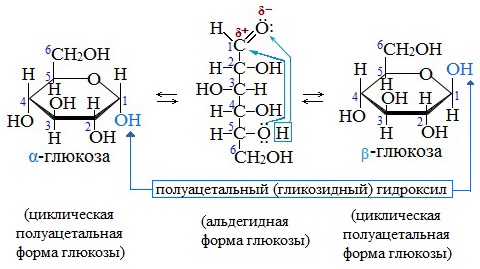
Подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами) называется таутомерией. Данный случай относится к цикло-цепной таутомерии моносахаридов.
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца.
В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении.
С учетом пространственного строения шестичленного цикла
формулы этих изомеров имеют вид:
Видеофильм «Глюкоза и ее изомеры»
Аналогичные процессы происходят и в растворе рибозы: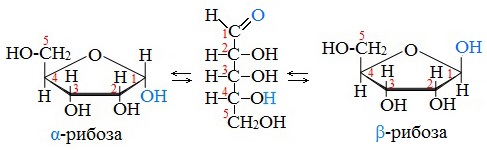
В твердом состоянии глюкоза имеет циклическое строение.
Обычная кристаллическая глюкоза – это α-форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул).
Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией.
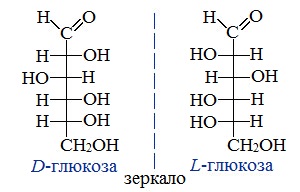
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры) и оптическая изомерия:
Физические свойства глюкозы
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий).
Глюкоза. Нахождение в природе
Она содержится в растительных и живых организмах, особенно много ее содержится в виноградном соке (отсюда и название – виноградный сахар), в спелых фруктах и ягодах. Мед в основном состоит из смеси глюкозы с фруктозой.
В крови человека ее содержится примерно 0,1 %
Видеоопыт «Определение глюкозы в виноградном соке»
Химические свойства глюкозы
Получение глюкозы
Основным способом получения моносахаридов, имеющим практическое значения, является гидролиз ди- и полисахароидов.
1. Гидролиз полисахаридов
Глюкозу чаще всего получают гидролизом крахмала (промышленный способ получения):
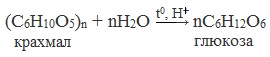 2. Гидролиз дисахаридов
2. Гидролиз дисахаридов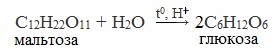
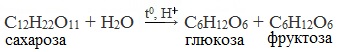 3. Альдольная конденсация формальдегида (реакция А.М. Бутлерова)
3. Альдольная конденсация формальдегида (реакция А.М. Бутлерова)
Первый синтез углеводов из формальдегида в щелочной среде осуществил А.М. Бутлеров в 1861 году.
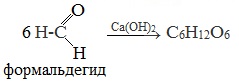
4. Фотосинтез
В природе глюкоза образуется в растениях в результате фотосинтеза:

Применение глюкозы
Глюкоза применяется в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, для приготовления лечебных препаратов, консервирования крови, внутривенного вливания, при самых разнообразных заболеваниях (особенно при истощении организма).
Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.)
Глюкоза находит широкое применение в текстильной промышленности при крашении и печатании рисунков.
Глюкоза применяется в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д.
Она применяется в производстве зеркал и елочных игрушек (серебрение).
В микробиологической промышленности как питательная среда для получения кормовых дрожжей.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Применение глюкозы в медицине
Применение глюкозы в микробиологической промышленности
Применение глюкозы в пищевой промышленности
Фруктоза
Фруктоза (фруктовый сахар) С6Н12О6 – изомер глюкозы. Фруктоза в свободном виде содержится в фруктах, меде. Входит в состав сахарозы и полисахарида инсулина. Она слаще глюкозы и сахарозы. Ценный питательный продукт.
В отличие от глюкозы она может без участия инсулина проникать из крови в клетки тканей. По этой причине фруктоза рекомендуется в качестве наиболее безопасного источника углеводов для больных диабетом.
Как и глюкоза, она может существовать в линейной и циклических формах. В линейной форме фруктоза представляет собой кетоноспирт с пятью гидроксильными группами.
Строение ее молекулы можно выразить формулой:
Имея гидроксильные группы, фруктоза, как и глюкоза, способна образовывать сахараты и сложные эфиры. Однако вследствие отсутствия альдегидной группы она в меньшей степени подвержена окислению, чем глюкоза. Фруктоза, также как и глюкоза, не подвергается гидролизу.
Фруктоза вступает во все реакции многоатомных спиртов, но, в отличие от глюкозы, не реагирует с аммиачным раствором оксида серебра.
Углеводы
Моносахариды
I. Получение глюкозы
1. В промышленности
- Гидролиз крахмала:
(C6H10O5)n + nH2O t,H+→ nC6H12O6
крахмал глюкоза
2. В лаборатории
- Из формальдегида (1861 г А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
3. В природе
- Фотосинтез:
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2
4. Другие способы
- Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза глюкоза
C12H22O11 + H2O t,H+→ C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
II. Химические свойства глюкозы
1. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
3. Маслянокислое брожение:
C6H12O6 → C3H7COOH + 2H2 ↑+ 2CO2↑
2. Свойства альдегидов
1. Реакция серебряного зеркала:
Видео-опыт: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2 t → СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
Рис. 1 Cu2O↓
3. Восстановление:
СH2OH(CHOH)4-COH + H2 t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
3. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
α — глюкоза | + СH3ОН | HCl(газ)→ | + H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
Видео-опыт: «Качественная реакция глюкозы с гидроксидом меди (II)»
Рис. 2. Глюконат меди (II)
4. Реакции окисления
Видео-опыт: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео-опыт: “Определение глюкозы в виноградном соке”
Видео-опыт: “Распознавание глюкозы с помощью качественных реакций”
III. Применение
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
IV. Тренажеры
Тренажер №1: “Химические свойства глюкозы”
ЦОРы
Видео: «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
Видео: «Качественная реакция глюкозы с гидроксидом меди (II)»
Видео: “Окисление глюкозы кислородом воздуха в присутствии метеленового голубого”
Видео: “Определение глюкозы в виноградном соке”
Видео: “Распознавание глюкозы с помощью качественных реакций”
Глюкоза, свойства, получение и применение.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Глюкоза – один из самых распространённых углеводов и источников энергии в живых организмах на планете, имеющий формулу C6H12O6.
Глюкоза, формула, молекула, строение, изомерия, вещество
Биологическая роль глюкозы
Физические свойства глюкозы
Получение и производство глюкозы
Химические свойства глюкозы. Химические реакции (уравнения) глюкозы
Применение глюкозы
Глюкоза, формула, молекула, строение, изомерия, вещество:
Глюкоза (виноградный сахар, декстроза или D-глюкоза) – органическое соединение, естественный моносахарид (шестиатомный гидроксиальдегид, гексоза), имеющий формулу C6H12O6.
Глюкоза (от греч. γλυκύς – «сладкий» и суффикса «оза») – один из самых распространённых углеводов и источников энергии в живых организмах на планете.
В быту глюкоза именуется также виноградным сахаром по причине того, что она содержится в винограде и впервые в 1747 году её получил немецкий химик Андреас Маргграф из виноградного сока. Глюкоза также встречается в листьях и других частях растений, соке многих фруктов, овощей и ягод: вишне, черешне, тыкве, малине, сливе, арбузах, яблоках, груше, дыне, персиках, мандаринах, землянике, томатах, капусте, смородине, свекле, финиках, картофеле, крыжовнике, абрикосах, огурцах, клюкве, апельсинах и пр., а также в мёде. Мед в основном состоит из смеси глюкозы с фруктозой. Кроме того, она (глюкоза) содержится во многих бобовых и злаках: пшенице, рисе, овсе, кукурузе, гречке и пр.
Глюкоза – это моносахарид, т.е. простейший углевод, состоящий из одной молекулы или одной структурной единицы.
Она (глюкоза) является структурной единицей большинства пищевых дисахаридов (мальтозы, лактозы и сахарозы) и полисахаридов (целлюлозы, крахмала, гликогена). Полисахариды – высокомолекулярные углеводы, полимеры моносахаридов (гликаны). Молекулы полисахаридов представляют собой длинные линейные или разветвлённые цепочки моносахаридных остатков, соединённых гликозидной связью. Олигосахариды – это углеводы, содержащие от 2 до 10 моносахаридных остатков. Дисахариды – углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Химическая формула глюкозы C6H12O6.
Глюкоза принадлежит к классу альдогексоз, то есть является полигидроксиальдегидом.
Глюкоза представляет собой моносахарид, содержащий шесть атомов углерода, одну альдегидную (-CHO) и пять гидроксильных (-OH) групп.
Молекула глюкозы может существовать в виде двух циклических форм (α-D-глюгоза и β-D-глюкоза, также именуемые α-D-глюкопираноза и β-D-глюкопираноза), отличающихся пространственным расположением одной гидроксильной группы, и в виде линейной – открытой цепной (ациклической) форме (D-глюкоза, также именуемая декстроза).
Циклическая форма глюкозы является результатом внутримолекулярной реакции между атомом альдегида C и гидроксильной группой C-5 линейной формы глюкозы (D-глюкозы). ОН-группа при углероде С-5 присоединяется к альдегидной группе с образованием внутримолекулярного полуацеталя. Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В α-D-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе –СН2ОН, в β-D-глюкозе – в цис-положении.
В циклической форме глюкоза находится в кристаллическом, твердом состоянии. Обычная кристаллическая глюкоза – это α-форма (α-D-глюкопираноза).
При растворении в воде глюкоза частично переходит в открытую цепную форму, где устанавливается состояние подвижного равновесия между указанными тремя формами. В растворе более устойчива β-форма (β-D-глюкопираноза). Линейная форма глюкозы составляет менее 0,02% молекул глюкозы в водном растворе, остальное приходится – на циклические формы. Равновесная доля α-D-глюкопиранозы при 31 °C составляет 38 %, а более устойчивой β-D-глюкопираноза – 62 %. В растворах α-D-глюкопираноза и β-D-глюкопираноза взаимопревращаются друг в друга через образование открытой цепной формы.
Наряду с наиболее распространённой в природе открытой цепной (ациклической) формой – D-глюкозой существует также её энантиомер L-глюкоза, которая в природе практически не встречается и получается искусственным путем. L-глюкоза не имеет значительного применения.
Строение молекулы глюкозы, структурная формула глюкозы:

Рис. 1. α-D-глюкопираноза

Рис. 2. β-D-глюкопираноза

Рис. 3. D-глюкоза (декстроза)

Рис. 4. D-глюкоза (слева) и L-глюкоза (справа)
Систематическое химическое наименование глюкозы: (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь (для ациклической формы – D-глюкозы). Используются также и другие химические названия глюкозы: декстроза (для ациклической формы – D-глюкозы).
По внешнему виду глюкоза представляет собой белое кристаллическое вещество, со сладким вкусом, без запаха. Однако сладость глюкозы вдвое ниже, чем сахарозы.
Глюкоза очень хорошо растворяется в воде. Растворимость в воде составляет 32,3 г на 100 г воды (при 0 °C), 82 г/100 г (при 25 °C), 562 г/100 г (при 90,8 °C). Хорошо растворима также в аммиачном растворе гидроксида меди (реактив Швейцера), серной кислоте, хлориде цинка. Малорастворима в этаноле и метаноле.
Температура плавления α-D-глюкозы составляет 146 °C, β-D-глюкозы – 148-150 °C.
Биологическая роль глюкозы:
В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза является ценным питательным веществом. При окислении глюкозы в тканях человека и животных освобождается энергия, необходимая для нормальной жизнедеятельности организмов.
Глюкоза депонируется у человека и животных в виде гликогена, который хранится преимущественно в клетках печени (гепатоцитах) и скелетных мышцах. В крови человека также содержится порядка 5-6 г глюкозы. Уровень глюкозы в крови человека постоянен. Данного количества глюкозы достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности.
У растений глюкоза образуется в результате фотосинтеза и накапливается в виде крахмала и целлюлозы. Последняя представляет собой составную часть оболочки клеток растений, обеспечивая механическую прочность и эластичность растительной ткани.
Физические свойства глюкозы:
| Наименование параметра: | Значение: |
| Цвет | белый, бесцветный |
| Запах | без запаха |
| Вкус | сладкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое кристаллическое вещество |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), г/см3 | 1,562 |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 1562 |
| Температура разложения, °C | — |
| Температура плавления α-D-глюкозы, °C | 146 |
| Температура плавления β-D-глюкозы, °C | 148–150 |
| Температура кипения, °C | — |
| Молярная масса глюкозы, г/моль | 180,16 |
Получение и производство глюкозы:
В природе глюкоза образуется в результате реакции фотосинтеза и содержится в различных частях растений: листьях и плодах. У животных глюкоза образуется в результате расщепления гликогена.
Глюкоза образуется в ходе следующих химических реакций:
1. реакции сахарозы с водой (гидролиз сахарозы):
С12Н22О11 + Н2О → С6Н12O6 + С6Н12O6 (tо, kat = H2SO4, HCl).
При гидролизе (при нагревании в присутствии ионов водорода) сахароза расщепляется на составляющие ее моносахариды – глюкозу и фруктозу за счёт разрыва гликозидных связей между ними. Данная реакция является обратной процессу образования сахарозы из моносахаридов.
Аналогичная реакция происходит в кишечнике у живых организмов при попадании в него сахарозы. В кишечнике сахароза под действием ферментов быстро гидролизуется на глюкозу и фруктозу.
2. реакции мальтозы с водой (гидролиз мальтозы):
С12Н22О11 + Н2О → 2С6Н12O6 (tо, kat = H2SO4, HCl).
При гидролизе (при нагревании в присутствии ионов водорода) мальтоза расщепляется на составляющие ее моносахариды – две молекулы глюкозы за счёт разрыва гликозидных связей между ними. Данная реакция является обратной процессу образования мальтозы из моносахаридов.
Аналогичная реакция происходит в кишечнике у живых организмов при попадании в него мальтозы. В кишечнике сахароза под действием ферментов быстро гидролизуется на две молекулы глюкозы.
3. реакции крахмала с водой (гидролиз крахмала):
(C6H10O5)n + nН2О → nС6Н12O6 (tо, kat = H2SO4).
Важнейшее свойство крахмала – способность подвергаться гидролизу под действием ферментов или при нагревании с кислотами.
Гидролиз протекает ступенчато. Из крахмала сначала образуется декстрин ((C6H10O5)n), который гидролизуется до мальтозы (C12H22O11). Затем в результате гидролиза мальтозы образуется глюкоза (С6Н12O6).
Аналогичная реакция происходит во рту, желудке и кишечнике у живых организмов при попадании в него крахмала. В желудке и кишечнике крахмал под действием ферментов окончательно гидролизуется на глюкозу.
Данная реакция используется в качестве промышленного способа получения глюкозы.
4. реакции А.М. Бутлерова – альдольной конденсации формальдегида:
CH2O → С6Н12O6 (kat = Ca(OH)2).
Первый синтез углеводов из формальдегида в щелочной среде осуществил А.М. Бутлеров в 1861 году.
Формальдегид под действием гидроксидов щелочноземельных металлов вступает в реакцию самоконденсации, образуя при этом смесь углеводов («формозу»), в т.ч. глюкозу.
5. реакции фотосинтеза:
CO2 + H2O → С6Н12O6 + O2 (hv, kat = хлорофилл).
В природе глюкоза образуется в растениях в результате фотосинтеза из углекислого газа и воды под действием солнечного света в листьях растений. В ходе реакции помимо глюкозы образуется кислород.
6. реакции гидролиза гликогена в кислой среде:
(C6H10O5)n → (C6H10O5)y → C6H12O6 (H2O, Н+).
Важнейшее свойство гликогена – способность подвергаться гидролизу в водных растворах кислот.
Гидролиз протекает ступенчато. Из гликогена ((C6H10O5)n) сначала образуется декстрин ((C6H10O5)y, при этом y < n), который гидролизуется до глюкозы (С6Н12O6).
Химические свойства глюкозы. Химические реакции (уравнения) глюкозы:
Основные химические реакции глюкозы следующие:
1. реакции ферментативного брожения глюкозы:
Важнейшим химическим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента соответственно различают реакции следующих видов:
1.1. реакцию спиртовое брожение глюкозы:
С6Н12О6 → 2С2Н5-OН6 + 2СО2.
В результате данной реакции образуются этиловый спирт (этанол) и углекислый газ.
1.2. реакцию молочнокислого брожения глюкозы:
С6Н12О6 → CH3CH(OH)COOH.
В результате данной реакции образуется молочная кислота.
1.3. реакцию маслянокислого брожения глюкозы:
C6H12O6 → C3H7COOH + 2H2 + 2CO2.
В результате данной реакции образуются масляная кислота, водород и углекислый газ.
Благодаря брожению получают продукты питания – кефир, сыр, алкоголь.
2. реакция глюкозы с водородом:
CH2OH(CHOH)4-COH + H2 → CH2OH(CHOH)4-CH2OH (tо, kat = Ni).
Глюкоза вступает в реакцию с водородом в присутствии катализатора (в качестве которого используется никель) при высокой температуре. В результате реакции образуется шестиатомный спирт (сорбит).
3. качественная реакция на глюкозу (реакция глюкозы с гидроксидом меди):
CH2OH(CHOH)4-COH + 2Cu(OH)2 → CH2OH(CHOH)4-COOH + Cu2O + 2H2O.
В молек
