Какие свойства бензола лежат в основе его применения
Наверно каждый человек помнит о таком веществе, как бензол, еще с курса органической химии. Данное углеводородное соединение было открыто химиком Фарадеем в 1825 г., однако название «бензол» оно приобрело еще в далеком XVII веке.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола — C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.

Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
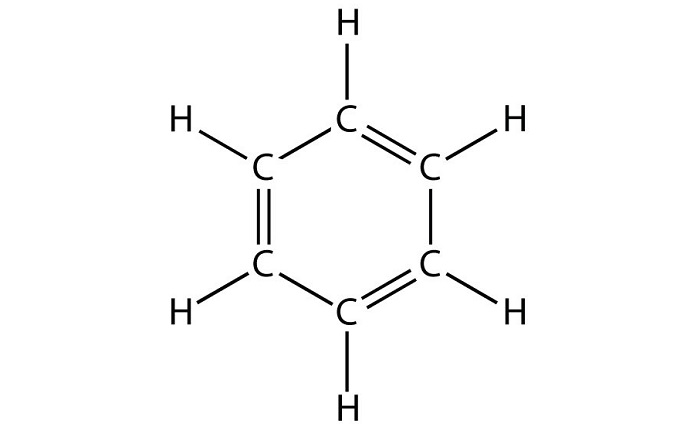
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,50C;
температура кипения — 800C;
общая плотность вещества — 0,879 г/см3;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 250C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
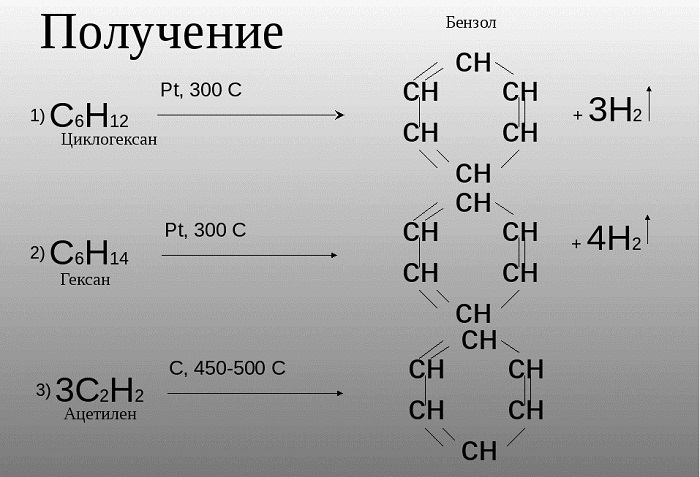
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
3HС ≡ CH (Cакт., 550C) → C6H6
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
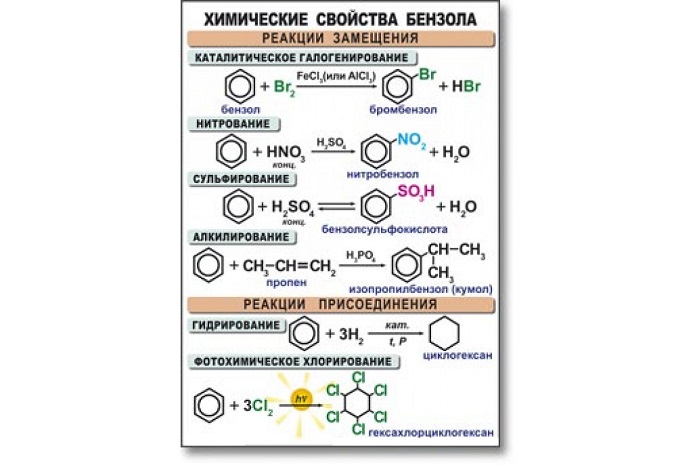
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
С6H6 + 3Cl2 → C6H5Cl + Hcl2;
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
C6H6 + C2H5Br → C6H5C2H5 + HBr3;
- нитрование и сульфирование бензола:
C6H6 + H2SO4 → C6H5SO3H + H2O,
C6H6 + HNO3 → C6H5NO2 + H2O;
- галогенирование бензола:
С6H5 — CH3 + Br = C6H5 — CH2Br + HBr;
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
C6H5CH3 + [O] → C6H5COOH.
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.
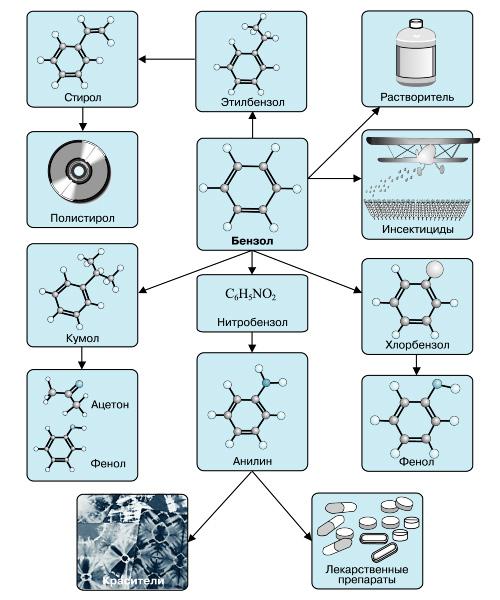
Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Бензол — углеводород, представитель ароматических (бензольных) соединений. Представляет собой бесцветную, прозрачную, сильно преломляющую свет легкоподвижную жидкость с характерным «ароматическим» запахом; легко испаряется при обычной комнатной температуре; кипит при температуре 80,5°С и застывает на холоде в кристаллическую массу, плавящуюся при +6°С; легко растворим в эфире, спирте, хлороформе и других растворителях, за исключением воды. Бензол — растворяющее средство для жиров, смол, масел, асфальта, алкалоидов, серы, фосфора, йода; на воздухе горит светлым, сильно коптящим пламенем и дает легко воспламеняющиеся пары.
Использование в промышленности
Бензол — один из наиболее распространенных химических продуктов и самое распространенное ароматическое соединение. В физическом весе пластмасс около 30%, в каучуках и резинах — 66%, в синтетических волокнах — до 80% приходится на ароматические углеводороды, родоначальником которых является бензол.
Бензол является важнейшим сырьем для химической промышленности, поскольку он используется и как исходный реагент для синтеза самых разнообразных соединений, и как растворитель для других реакций (бензол растворяет практически все органические соединения, это своего рода «органическая вода»).
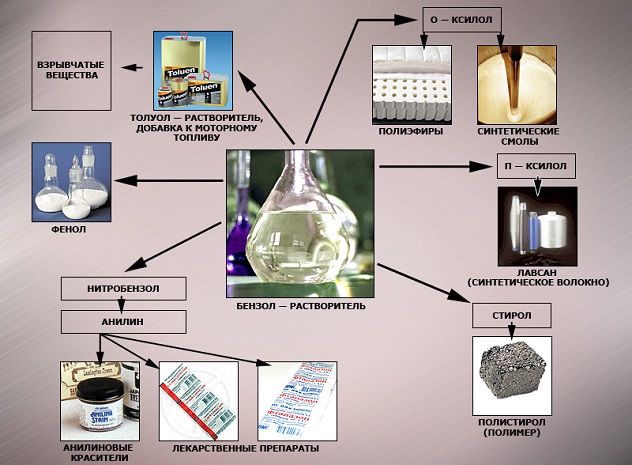
В настоящее время бензол применяется в основном в производстве этилбензола, кумола и циклогексана. На основе бензола по-прежнему получают различные полупродукты (сульфо-, нитро-, галоген-, алкил-, арил-, ацетилбензолы и др.), используемые в дальнейшем для получения синтетических каучуков, пластмасс, синтетических волокон, красителей, поверхностно-активных веществ (ПАВ), инсектицидов, лекарственных веществ.
Бензол широко применяется также в качестве растворителя и экстрагента в производстве лаков и красок; применяется как компонент моторного топлива для повышения октанового числа.
Воздействие на организм человека
Бензол высокотоксичен. При отравлении его парами обычно наблюдаются учащенное сердцебиение, сонливость, головокружение, головные боли, тремор и прочие симптомы отравления. Попадание бензола внутрь может вызвать поражение желудочно-кишечного тракта. Бензол оказывает угнетающее действие на функцию кроветворения, обладает канцерогенным действием.
Вдыхание паров бензола в осложненных случаях способно привести к летальному исходу.
Действие бензола на организм обладает свойством кумулятивности, иными словами, многократное воздействие малыми дозами суммируется.
Основной путь поступления в организм — в виде паров (через дыхательные пути) и в жидком состоянии (через кожу). Метаболизм бензола в организме происходит по-разному. Бензол окисляется до фенолов и полифенолов, которые связываются серной и глюкуроновой кислотами и в виде органических сульфатов выделяются с мочой.
Общий характер действия: наркотическое и отчасти судорожное. Бензол действует на нервную систему и органы кроветворения.
Острые отравления в производственных условиях возникают редко: при авариях, чистке цистерн из-под этих веществ, при применении их в составе быстро сохнущих красок при работе в замкнутых помещениях, при переливании в плохо вентилируемых помещениях.
Легкая форма отравления бензолом напоминает опьянение: могут наблюдаться головная боль, головокружение, звон в ушах, спутанность сознания, рвота. В более выраженных случаях — потеря сознания, мышечные подергивания, которые могут перейти в судороги, зрачки расширены, плохо реагируют на свет, дыхание учащено, затем замедляется, температура тела снижается, кожные покровы бледные. Пульс слабого наполнения, учащен, артериальное давление падает.
Хроническое отравление бензолом вызывает головную боль, головокружение, слабость, быструю утомляемость, раздражительность, расстройство сна, плохой аппетит, неприятные ощущения в области сердца, кровоточивость десен, носовые кровотечения, появление синяков на теле. Ранним признаком хронического отравления являются функциональные изменения нервной системы: неврастенический или астенический синдром с вегетативной дисфункцией.
При появлении симптомов отравления необходимо срочно обратиться в медицинское учреждение.
Материал подготовлен на основе информации открытых источников
Что такое бензол?
Бензол – это органическое вещество, при обычных условиях представляет собой бесцветную жидкость со специфическим сладковатым запахом. Является простейшим ароматическим углеводородом. Входит в состав сырой нефти. Не растворим в воде, сильно токсичен. Химическая формула C6H6. Первый раз был получен Майклом Фарадеем, который выделил его из конденсата светильного газа (смесь водорода 50 %, метана 34 %, угарного газа 8 %).
Физические и химические свойства
Молярная масса равна 78,11 г/моль. При температуре 80,1 °C начинает кипеть, при -5 °С — плавиться. Плотность равна 0.879 г/см³. Вступает в реакции замещения:
· галогенирования, при котором атом водорода заменяется хлором или бромом, такие реакции проходят при нагревании с обязательным участием катализатора;
· нитрования (введение нитрогруппы в бензольное кольцо), итогом которой становится тяжёлая желтоватая жидкость с запахом горького миндаля – нитробензол, такая реакция может использоваться как качественная на определение;
· алкилирование галогеналканами (реакция Фриделя-Крафтса), эта реакция позволяет ввести углеводородный радикал в бензольное кольцо, и считается одним из методов получения гомологов бензола;
· алкилирование алкенами.
Бензол может вступать в реакцию горения, в результате которой образуются вода и углекислый газ.
Получение
Сейчас существует несколько методов получения бензола:
· добыча методом коксования каменного угля – активно применялась почти до середины ХХ века, бензол, полученный таким способом, не подходит для некоторых технологических процессов в современном производстве;
· методика аромаизинга бензиновых фракций нефти используется в США (в РФ и странах Европы этим методом получают половину всего бензола);
· термическое разложение тяжелых и лёгких фракций нефти – во время процесса попутно образуются толуол и ксилолы, обычно их сразу отправляют на процесс деалкилирования, и тоже получают бензол;
· тримеризация ацетилена – газ пропускают при высокой температуре над средой из активированного угля, при этом образуется бензол, плюс еще несколько ароматических углеводородов.
Важно: мировой спрос на бензол сейчас составляет более 42 млн. т, по прогнозам экспертов, к концу 2020 года эта цифра составит более 57 млн. т. Ежегодно даже рынку США не хватает ~600 тысяч тонн этого вещества.
Применение
Почему бензола требуется так много? Он необходим в производстве синтетического каучука (резина для автомобильных шин), пластмассы, синтетического волокна, красителей, ПАВ и пр. Бензол может использоваться как растворитель и экстрагент в промышленном производстве красок, его добавляют в бензин для повышения октанового числа (не более 1% по современным нормам).
Опасен ли бензол?
Влияние на человека
Это вещество является самым распространённым ксенобиотиком антропогенного происхождения (чужеродное для живых организмов вещество, не участвующее в естественном биотическом круговороте). Внимание! Бензол сильно ядовит – минимальная смертельная доза при приеме внутрь составляет всего 15 миллилитров. Он относится к веществам третьего класса опасности для человека по мировому стандарту NFPA 704 (как хлор и серная кислота). Его кратковременное воздействие может привести к серьёзным временным или умеренным остаточным последствиям. Сильный канцероген.
Горючесть
Быстро испаряется при нормальном атмосферном давлении и температуре, легко рассеивается в воздухе и легко возгорается. Температура вспышки ниже 23 °C. Поэтому по стандарту NFPA 704 это вещество имеет четвёртый класс, то есть является максимально огнеопасным.
Меры предосторожности
Работа с бензолом строго регламентируется. Во время лабораторных экспериментов его рекомендуется использовать в малом количестве (не более 50 мл). Все действия должны проводиться в защитных перчатках из фторкаучука, так же обязательна защита глаз и органов дыхания. Запрещается работать в закрытом, невентилируемом помещении, с температурой воздуха больше 30°С.
Купить бензол вы можете в магазине Химик24. Реализация оптом и в розницу.
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости
со специфическим запахом. Ароматические углеводороды легче воды и в ней не
растворяются, однако легко растворяются в органических растворителях – спирте,
эфире, ацетоне.
Бензол и его гомологи сами являются хорошими
растворителями для многих органических веществ. Все арены горят коптящим
пламенем ввиду высокого содержания углерода вих молекулах.
Физические свойства некоторых аренов представлены
в таблице.
Таблица.
Физические свойства некоторых аренов
Название | Формула | t°.пл., | t°.кип., |
Бензол | C6H6 | +5,5 | 80,1 |
Толуол | С6Н5СH3 | -95,0 | 110,6 |
Этилбензол | С6Н5С2H5 | -95,0 | 136,2 |
Ксилол | С6Н4(СH3)2 | ||
орто- | -25,18 | 144,41 | |
мета- | -47,87 | 139,10 | |
пара- | 13,26 | 138,35 | |
Пропилбензол | С6Н5(CH2)2CH3 | -99,0 | 159,20 |
Кумол | C6H5CH(CH3)2 | -96,0 | 152,39 |
Стирол | С6Н5CH=СН2 | -30,6 | 145,2 |
Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при
длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для
жизни, токсичны.
Получение
аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей
бензойной кислоты с твёрдыми щелочами
C6H5-COONa
+ NaOH t → C6H6 + Na2CO3
бензоат натрия
2. Реакция Вюрца-Фиттинга:
(здесь
Г – галоген)
С6H5-Г
+ 2Na + R-Г → C6H5—R + 2NaГ
С6H5-Cl
+ 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
В промышленности
- выделяют
из нефти и угля методом фракционной перегонки, риформингом; - из
каменноугольной смолы и коксового газа
1. Дегидроциклизацией
алканов с числом атомов углерода больше 6:
C6H14 t, kat→ C6H6 + 4H2

2. Тримеризация ацетилена
(только для бензола) – р. Зелинского:
3С2H2 600°C, акт. уголь →
C6H6

3. Дегидрированием
циклогексана и его гомологов:
Советский
академик Николай Дмитриевич Зелинский установил, что бензол образуется из
циклогексана (дегидрирование циклоалканов
C6H12 t,
kat→ C6H6 +
3H2

C6H11-CH3
t, kat→ C6H5-CH3 + 3H2
метилциклогексан толуол
4. Алкилирование бензола
(получение гомологов бензола) – р
Фриделя-Крафтса.
C6H6 +
C2H5-Cl t, AlCl3→ C6H5-C2H5
+ HCl
хлорэтан этилбензол
Химические
свойства аренов
I. РЕАКЦИИ
ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C6H6 + 15O2t →
12CO2 + 6H2O + Q
2. Бензол при обычных условиях не обесцвечивает
бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия
(обесцвечивают марганцовку):
А) в кислой среде до
бензойной кислоты
При действии на гомологи бензола перманганата калия и
других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была
цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную
кислоту:
Гомологи, содержащие две боковые цепи, дают
двухосновные кислоты:
5C6H5-C2H5
+ 12KMnO4 + 18H2SO4 → 5C6H5COOH
+ 5CO2 + 6K2SO4 + 12MnSO4+28H2O
5C6H5-CH3
+ 6KMnO4 + 9H2SO4 → 5C6H5COOH
+ 3K2SO4 + 6MnSO4 +14H2O
Упрощённо:
C6H5-CH3
+ 3O KMnO4 → C6H5COOH
+ H2O
Б) в нейтральной и
слабощелочной до солей бензойной кислоты
C6H5-CH3
+ 2KMnO4 → C6H5COOК + KОН + 2MnO2 + H2O
II. РЕАКЦИИ
ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
C6H6 +3Cl2hν → C6H6Cl6(гексахлорциклогексан —
гексахлоран)

2. Гидрирование
C6H6 + 3H2 t,Pt или Ni → C6H12 (циклогексан)

3. Полимеризация
III. РЕАКЦИИ
ЗАМЕЩЕНИЯ – ионный механизм (легче, чем у алканов)
1. Галогенирование —
a) бензола
C6H6 + Cl2 AlCl3→ C6H5-Cl + HCl (хлорбензол)

C6H6
+ 6Cl2 t ,AlCl3→ C6Cl6
+ 6HCl (гексахлорбензол)
C6H6
+ Br2 t,FeCl3→ C6H5-Br + HBr (бромбензол)

б) гомологов бензола при облучении
или нагревании
По химическим свойствам алкильные радикалы подобны
алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному
механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении
идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца
на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно
связанного с бензольным кольцом (a -атома углерода).
1) C6H5-CH3
+ Cl2hν→ C6H5-CH2-Cl +
HCl
2)
в) гомологов бензола в
присутствии катализатора
C6H5-CH3 + Cl2 AlCl3→ (смесь орта, пара производных) + HCl
2. Нитрование (с азотной кислотой)
C6H6
+ HO-NO2 t, H2SO4→ C6H5-NO2 +
H2O
нитробензол — запахминдаля!

C6H5-CH3
+ 3HO-NO2 t, H2SO4→ СH3-C6H2(NO2)3
+ 3H2O
2,4,6-тринитротолуол (тол, тротил)
Применение бензола и его гомологов
Бензол C6H6 – хороший
растворитель. Бензол в качестве добавки улучшает качество моторного топлива.
Служит сырьем для получения многих ароматических органических соединений –
нитробензола C6H5NO2 (растворитель, из него
получают анилин), хлорбензола C6H5Cl, фенола C6H5OH,
стирола и т.д.
Толуол C6H5–CH3 – растворитель,
используется при производстве красителей, лекарственных и взрывчатых веществ
(тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2.
Технический ксилол – смесь трех изомеров (орто-, мета— и пара-ксилолов) –
применяется в качестве растворителя и исходного продукта для синтеза многих
органических соединений.
Изопропилбензол C6H5–CH(CH3)2
служит для получения фенола и ацетона.
Хлорпроизводные
бензола используют для защиты
растений. Так, продукт замещения в бензоле атомов Н атомами хлора –
гексахлорбензол С6Сl6 – фунгицид; его применяют для
сухого протравливания семян пшеницы и ржи против твердой головни. Продукт
присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 –
инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые
вещества относятся к пестицидам – химическим средствам борьбы с
микроорганизмами, растениями и животными.
Стирол C6H5 – CH = CH2
очень легко полимеризуется, образуя полистирол, а сополимеризуясь с
бутадиеном – бутадиенстирольные каучуки.
ВИДЕО-ОПЫТЫ
Изучение физических свойств бензола
Горениебензола
Изучениеотношения бензола к бромной воде и раствору перманганата калия
Бромирование бензола
Нитрование бензола
Хлорированиебензола (получение гексахлорана)
