Какие свойства бензола я

Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:

Арены ряда бензола (моноциклические арены)
Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Электронное строение молекулы бензола
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С—С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120о. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp2-гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:

Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; toпл= 5,5оС; toкип. = 80оС; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I. Реакции замещения
1.Галогенирование

2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование

4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса, образуются гомологи бензола:

Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):

II. Реакции присоединения
1.Гидрирование

2.Присоединение хлора

III. Реакции окисления
1. Горение
2С6Н6 + 15О2 → 12СО2 + 6Н2О
2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
В промышленности:
1) переработка нефти и угля;
2) дегидрирование циклогексана:

3) дегидроциклизация (ароматизация) гексана:

4) тримеризация ацетилена:

В лаборатории:
Сплавление солей бензойной кислоты со щелочами:

Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.



Физические свойства толуола
Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I. Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:

а) галогенирование

При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:

б) нитрование

в) сульфирование

г) алкилирование

2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:

При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:

II. Реакции присоединения
Гидрирование

III.Реакции окисления
1.Горение
C6H5CH3 + 9O2 → 7CO2 + 4H2O
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:

Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:

3) дегидроциклизация гептана:

В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):

1. Реакции замещения в бензольном кольце
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
![]()
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
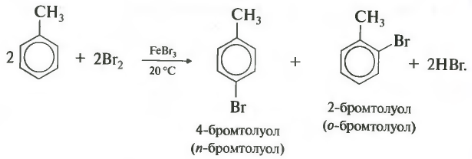
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
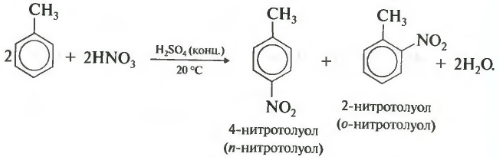
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
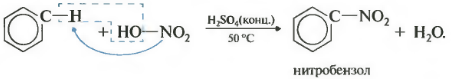
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.
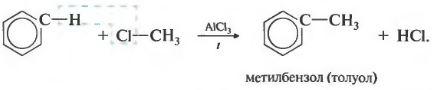
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
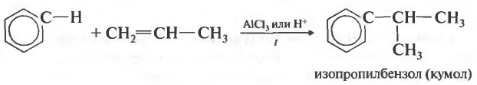
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
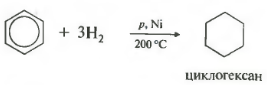
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
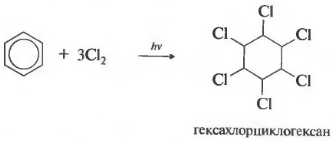
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
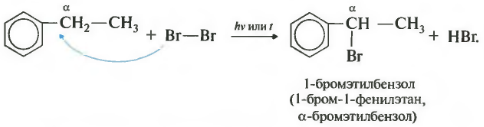
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
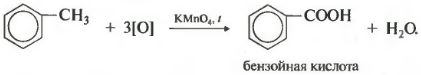
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
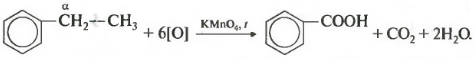
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
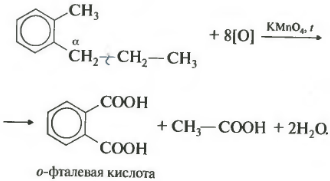
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
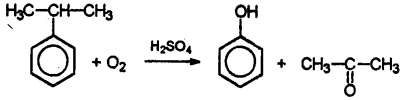
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
![]()
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
С.В.Стаханова, НИТУ «МИСиС», Москва
КЛЮЧЕВЫЕ СЛОВА: ароматические углеводороды, арены, sp2—гибридизация, единое p-электронная облако, круговое сопряжение, ионный механизм реакции замещения, электрофильное замещение, нитрование, галогенирование, алкилирование по Фриделю-Крафтсу, алкилирование алкенами, гидрирование, окисление.
СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА. АРОМАТИЧНОСТЬ
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С6Н6. Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный шестиугольник (рис. 1). Каждый атом углерода связан с одним атомом водорода. Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Рис. 1. Модели молекулы бензола: а) шаростержневая; в) полусферическая.
Для изображения молекулы бензола пользуются следующими структурными формулами:
Формулы а) и б) предложил в 1865 г немецкий химик Август Кекуле. Несмотря на то, что они недостаточно точно передают строение молекулы бензола, их используют до сих пор и называют формулами Кекуле.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения. Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно. Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам:онне обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы – единого p-электронного облака.
В молекуле бензола каждый атом углерода находится в состоянии sp2-гибридизации и связан тремя s-связями с двумя атомами углерода и одним атомом водорода. Четвертый валентный электрон атома углерода находится на p-орбитали, перпендикулярной плоскости молекулы. В молекуле бензола происходит боковое перекрывание р-орбиталей каждого атома углерода с р-орбиталями обоих соседних атомов углерода (рис. 2). В результате такого сопряжения образуется единое p-электронное облако, расположенное над и под плоскостью бензольного кольца – осуществляется круговое сопряжение.
Такая циклическая система с общим облаком из шести электронов очень устойчива, энергетически выгодна; поэтому бензол преимущественно вступает в те реакции, в которых ароматическое кольцо сохраняется.
Рис. 2. Электронное строение молекулы бензола: а) схема перекрывания р-орбиталей; б) единое p-электронное облако.
Подчеркнем еще раз, что в молекуле бензола нельзя выделить трех двойных и трех простых связей. Электронная плотность распределяется в молекуле равномерно, и все связи между атомами углерода оказываются совершенно одинаковыми. Поэтому нужно помнить, что формула Кекуле, которая часто используется для изображения бензола, условна и не отражает реального строения его молекулы.
Итак, ароматическимиявляются соединения, в молекулах которых имеется устойчивая циклическая группировка с особым характером связи. Имея молекулярную формулу, указывающую на высокую степень ненасыщенности, эти вещества, однако, не реагируют как ненасыщенные, а вступают преимущественно в реакции замещения с сохранением ароматической системы.
ГОМОЛОГИ БЕНЗОЛА,
ИЗОМЕРИЯ, НОМЕНКЛАТУРА
Общая формула гомологического ряда ароматических углеводородов CnH2n-2.
Ближайшим гомологом бензола является метилбензол. Чаще употребляют его тривиалное название – толуол:
Бензол и толуол не имеют ароматических изомеров. Для этих веществ характерна лишь межклассовая изомерия. Так, соответствуют молекулярной формуле С6Н6 и, следовательно, изомерны бензолу непередельные нециклические углеводороды, содержащие две тройных или две двойные и одну тройную связи в молекуле, например:
Начиная с аренов с восьмью атомами углерода появляется возможность изомерии, связанной с составом и взаимным расположением углеводородныхрадикалов. Если с бензольным кольцом связаны два заместителя, то они могут находиться в трех различных положениях относительно друг друга: рядом (такое положение обозночают приставкой орто-), через один атом углерода (мета-), и напротив друг друга (пара-). Диметилбензол, стуктурные формулы изомеров которого приведены ниже, имеет тривиальное название ксилол.
Таким образом, молекулярной формуле С8Н8 отвечают четыре изомерных ароматических углеводорода:
Многие гомологи бензола имеют не только систематические (когда их рассматривают как производные бензола), но и тривиальные названия, например:
Следует запомнить названия радикалов, образованных ароматическими углеводородами:
Существуют и производные бензола с ненасыщенными боковыми цепями (разумеется, они не являются его гомологами):
Напомним, что непредельные радикалы
имеют названия винил и этинил соответственно.
Арены могут содержать несколько бензольных ядер в молекуле. Такие вещества называют полиядерными ароматическими углеводородами. Их разделяют на соединения с изолированными бензольными ядрами, например
и соединения с конденсированными бензольными ядрами, простейшим примером которых является нафталин:
ФИЗИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА И ЕГО ГОМОЛОГОВ
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом (табл.1). Все они практически не смешиваются с водой, однако являются хорошими растворителями органических веществ.
Таблица 1. Физические свойства некоторых аренов
| Название | Тплавл., оС | Ткип., оС |
| Бензол | 5,5 | 80 |
| Толуол | -95 | 110 |
| Этилбензол | -94 | 136 |
| о-Ксилол | -25 | 144 |
| м-Ксилол | -47 | 139 |
| п-Ксилол | 13 | 138 |
| Пропилбензол | -99 | 159 |
| Изопропилбензол | -96 | 152 |
| Стирол | -31 | 145 |
| Фенилацетилен | -45 | 142 |
Многие ароматические углеводороды токсичны, причем вредны не только сами жидкости, но и их пары. Поэтому при работе с ними необходимо соблюдать особую осторожность. Разумеется, для нагревания аренов, как и других органических веществ, нельзя пользоваться открытым пламенем, так как они легко могут вспыхнуть. Их нагревают с помощью плиток или колбонагревателей с закрытой спиралью.
ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА
РЕАКЦИИ ЗАМЕЩЕНИЯ
Для бензола наиболее характерны реакции замещения атомов водорода ароматического ядра, в которых сохраняется устойчивая шести-p-электронная ароматическая система.
Реакции замещения протекают по ионному механизму (точнее, по механизму электрофильного замещения, см. приложение 1). Важнейшими примерами реакций замещения в ароматическом ряду являются галогенирование, нитрование и алкилирование бензола.
ГАЛОГЕНИРОВАНИЕ
Замещение атома водорода в бензольном ядре на бром или хлор протекает в присутствии катализаторов – хлоридов алюминия и железа:
Обратите внимание на то, что в других условиях, например, при освещении или нагревании, взаимодействие бензола с хлором будет протекать не по ионному, а по радикальному механизму, что приведет к образованию других продуктов (см. разделы «Реакции замещения», «Особенности химических свойств гомологов бензола»).
НИТРОВАНИЕ
Реакция протекает под действием смеси концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
АЛКИЛИРОВАНИЕ
Алкилирование – это введение в молекулу алкильного радикала (-СН3, -С2Н5, -С3Н7 и др.), в результате чего образуются гомологи бензола.
Алкилирование бензола можно осуществить двумя путями. Во-первых, действием на бензол галогензамещенными алканами в присутствии катализаторов – галогенидов алюминия (алкилирование по Фриделю-Крафтсу):
Во-вторых, взаимодействием бензола с этиленовыми углеводородами в присутствии кислотных катализаторов (алкилирование алкенами):
При алкилировании бензола пропиленом образуется преимущественно изопропилбензол[1]:
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
В отдельных случаях бензол способен вступать в реакции присоединения.
Гидрирование бензола протекает при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd):
Аналогично протекает гидрирование и гомологов бензола, например:
Присоединение хлора происходит при действии солнечного света или ультрафиолетового излучения на раствор хлора в бензоле. Одновременно присоединяются сразу три молекулы хлора и образуется твердый продукт – гексахлорциклогексан:
ОКИСЛЕНИЕ
Бензол устойчив к окислению: он, в отличие от непредельных углеводородов, не обесцвечивает раствор перманганата калия. При поджигании бензол горит ярким коптящим пламенем:
С6Н6 + 7,5О2 → 6СО2 + 3Н2О.
