Какие свойства аммиака лежат в основе

Аммиак – NH3

Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
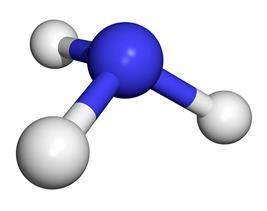
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ — сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео — Эксперимент » Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 «Горение аммиака»
Тренажёр №2 «Химические свойства аммиака»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
1. Каково электронное и пространственное строение молекулы аммиака?
Электронное строение молекулы аммиака: 3 испаренных электрона атома азота участвуют в формировании 3-х ковалентных связей с 3-мя атомами водорода. Общие электронные пары смещены в сторону более электроотрицательного атома азота. Пространственное строение: молекула аммиака имеет форму треугольной пирамиды.
2. Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
Аммиак легко сжижается при обычном давлении и температуре -33,4°С, а при испарении жидкого газа из окружающей среды поглощается много тепла, поэтому он применяется в холодильных установках.
Аммиак очень хорошо растворим в воде. 10 % раствор аммиака называется нашатырным спиртом и используется в медицине.
3. Какую химическую связь называют водородной? В чем особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии?
Водородная связь — это химическая связь между атомами водорода и атомами сильно электроотрицательных элементов (фтор, кислород, азот). Водородная связь образуется обычно между двумя соседними молекулами. Например, она образуется между молекулами воды, спиртов, фтороводорода, аммиака.
Это очень слабая связь— примерно в 15-20 раз слабее ковалентной. Благодаря ей некоторые низкомолекулярные вещества образуют ассоциаты, что приводит к повышению температур плавления и кипения веществ.
Аномально высокие температуры плавления и кипения характерны для воды (если рассматривать водородные соединения VI группы). Все водородные соединения VI группы, кроме воды, являются газами.
Очень важную роль играет водородная связь в молекулах важнейших для живых существ соединений — белков и нуклеиновых кислот.
4. Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ?
Водородные связи образуются между молекулами воды спиртов, кислой, галогенводородов, при этом аномально увеличиваются температуры плавления и кипения.
5. На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно-акцептоному механизму. Является ли связь, образованная по донорно-акцепторному механизму, особым типом химической связи? Объясните, почему.
Катион аммония образуется в результате взаимодействия свободной (неподеленной / электронной пары атома азота молекулы аммиака с катионом водорода, переходящего к аммиаку от молекулы кислот или воды. Механизм образования ковалентной связи, которая возникает не в результате обобществления неспаренных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называют донорно-аклепторным. Т.е. Донорно-аклепторный — это не особый вид связи, а лишь особый механизм образования ковалентной связи.
6. Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции.

7. Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония?

8. Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции: ![]()

9. Почему азот в аммиаке проявляет только восстановительные свойства?
Аммиак проявляет только восстановительные свойства, т.к. азот находится в самой низкой степени окисления и не может больше принимать электроны.
10. Как получают аммиак: а) в промышленности; б) в лабораторных условиях?

Одним из важнейших химических веществ, которое используют в разных сферах деятельности человека, является аммиак. Ежегодно это вещество производят в огромных количествах – больше 100 млн тонн. Только вдумайтесь в это число! Сразу же возникает вопрос: « Для чего производят такое количество аммиака?». В этой статье мы ответим на этот вопрос, а также выясним причину популярности аммиака.
Свойства аммиака
Физические и химические свойства аммиака обуславливают его применения в различных областях. Аммиак представляет собой газообразное вещество без цвета с очень резким и неприятным запахом. Вещество ядовито. При длительном воздействии на человеческий организм способен вызывать отёки и поражение различных органов.
Аммиак – это слабая кислота, он взаимодействует с кислотами, водой, а с металлами способен образовывать соли. Он способен вступать в различные химические реакции с другими химическими веществами. Например, реакция безводного аммиака с азотной кислотой на практике позволяет получить аммиачную селитру, которая применяется для производства удобрений.
Аммиак является восстановителем. Он способен восстанавливать разные металлы из их оксидов. Реакция взаимодействия аммиака с оксидом меди дает возможность получить азот.
Различные сферы использования аммиака
Несмотря на свою токсичность, аммиак используют в самых разных сферах. Основная часть производимого аммиака идет на изготовление разных продуктов химической промышленности. К таким продуктам относятся:
— аммиачные и аммиачно-нитратные удобрения (аммиачные и нитратная селитра, сульфат аммония, хлористый аммоний и др.). Такие удобрения подходят для разных сельскохозяйственных культур. Важно знать, что внесение в почву удобрений нормируется из-за того, что содержащиеся в них вещества могут мигрировать в спелые овощи и фрукты.
— сода. Существует аммиачный метод получения кальцинированной соды. Аммиак используется для насыщения солевого рассола. Данный метод активно используется для промышленного производства соды.
— азотная кислота. Для её производства используют синтетический аммиак. На данный момент промышленное производство данного вещества основано на явлении катализа синтетического аммиака.
— взрывчатые вещества. Нитрат аммония нейтрален к механическому воздействию, но при некоторых условиях характеризируется высокими взрывчатыми свойствами. Именно поэтому он используется для производства таких веществ. В результате получают аммониты – аммиачные взрывчатые вещества.
— растворитель. Аммиак, в жидком состоянии, может использоваться как растворитель различных органический и неорганических веществ.
— аммиачная – холодильная установка. Аммиак применяется в холодильной технике, в качестве холодильного агента. Аммиак не вызывает парниковый эффект, он экологически чистый и дешевле фреонов. Эти факторы обуславливают применения данного вещества в качестве хладагента.
— нашатырный спирт. Его применяют в медицине и в быту. Данное вещество отлично выводит пятна с одежды различного происхождения, а также нейтрализует кислоты.
Применение аммиака в медицине
Аммиак широко применяется в медицине в качестве 10% -ого раствора аммиака и имеет название – нашатырный спирт. Когда человек падает в обморок, нашатырным спиртом приводят его в чувство. Также его используют как рвотное средство. Для этого его разводят и в малых количествах принимают внутрь. Особенно популярный такой метод при алкогольных отравлениях. Из нашатырного спирта делают примочки и обрабатывают укусы насекомых. Хирурги используют разведенный в воде нашатырный спирт для обработки рук.
Важно помнить, что передозировка аммиаком очень опасна. Возможны болевые ощущения в различных органах, их отеки и даже летальный исход. Этого можно избежать, если использовать данное вещество по назначению и с осторожностью!
Химия
9 класс
Прежде всего рассмотрим строение молекулы аммиака NH3. Как вы уже знаете, на внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три электрона — неспаренные. Именно они и участвуют в формировании трёх ковалентных связей с тремя атомами водорода при образовании молекулы аммиака NH3.

Три общие электронные пары смещены в сторону более электроотрицательного атома азота, а так как молекула аммиака имеет форму треугольной пирамиды (рис. 128), то в результате смещения электронных пар возникает диполь, т. е. молекула с двумя полюсами.

Рис. 128.
Строение молекулы аммиака
Молекулы аммиака (в жидком аммиаке) взаимодействуют, связываясь друг с другом:

Этот особый тип химической межмолекулярной связи, как вы уже знаете, называют водородной связью.
Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Аммиак нельзя вдыхать продолжительное время, так как он ядовит. Этот газ легко сжижается при обычном давлении и температуре -33,4 °С. При испарении жидкого аммиака из окружающей среды поглощается много тепла, поэтому аммиак применяют в холодильных установках.
Аммиак хорошо растворим в воде: при 20 °С в 1 объёме воды растворяется около 710 объёмов аммиака (рис. 129). Концентрированный (25%-й по массе) водный раствор аммиака называют водным аммиаком или аммиачной водой, а используемый в медицине 10%-й раствор аммиака известен под названием нашатырный спирт. В водном растворе аммиака образуется непрочное соединение — гидрат аммиака NH3 • Н2O.

Рис. 129.
«Аммиачный фонтан» (растворение аммиака в воде)
Если к раствору аммиака добавить несколько капель фенолфталеина, раствор окрасится в малиновый цвет, что указывает на щелочную среду. Щелочная реакция водных растворов аммиака объясняется наличием гидроксид-ионов ОН-:

Если окрашенный фенолфталеином раствор аммиака подогреть, то окраска исчезнет (почему?).
Лабораторный опыт № 30
Изучение свойств аммиака
Добавьте к раствору аммиака 1—2 мл воды, а затем — 2 капли раствора фенолфталеина. Что наблюдаете? Что можно сказать о растворимости аммиака в воде? Подогрейте содержимое пробирки. Что наблюдаете? Объясните результаты проведённого эксперимента.
Аммиак взаимодействует с кислотами, образуя соли аммония. Это взаимодействие можно наблюдать в следующем опыте: стеклянную палочку или стакан, смоченные раствором аммиака, поднести к другой палочке или стакану, смоченным соляной кислотой, — появится густой белый дым (рис. 130):


Рис. 130.
«Дым без огня»
Вот и верь после этого поговорке, что дыма без огня не бывает.
И водный раствор аммиака, и соли аммония содержат особый ион — катион аммония NH+4, играющий роль катиона металла. Ион аммония образуется в результате возникновения ковалентной связи между атомом азота, имеющим свободную (неподелённую) электронную пару, и катионом водорода, который переходит к аммиаку от молекул кислот или воды:

Механизм образования ковалентной связи, которая возникает не в результате обобществления неспаренных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называют донорно-акцепторным.
При образовании иона аммония донором свободной электронной пары служит атом азота в аммиаке, а акцептором — катион водорода кислоты или воды.
Ещё одно химическое свойство аммиака вы сможете сами прогнозировать, если обратите внимание на степень окисления в нём атомов азота, а именно -3. Конечно же аммиак — сильнейший восстановитель, т. е. его атомы азота могут только отдавать электроны, но не принимать их. Так, аммиак способен окисляться или до свободного азота (без участия катализатора):
4NH3 + 3O2 = 2N2 + 6Н2O,
или до оксида азота (II) (в присутствии катализатора):

В промышленности аммиак производят синтезом из азота и водорода (рис. 131).

Рис. 131.
Промышленная установка (а) и схема промышленного получения аммиака (б)
В лаборатории аммиак получают действием гашёной извести Са(ОН)2 на соли аммония, чаще всего на хлорид аммония:

Газ собирают в перевёрнутый кверху дном сосуд, а распознают или по запаху, или по посинению влажной красной лакмусовой бумажки, или по появлению белого дыма при внесении палочки, смоченной соляной кислотой.
Аммиак и его соли широко используют в промышленности и технике, в сельском хозяйстве, быту. Основные области их применения показаны на рисунке 132.

Рис. 132.
Применение аммиака и солей аммония:
1,2 — в холодильных установках; 3 — производство минеральных удобрений; 4 — производство азотной кислоты; 5 — для паяния; 6 — получение взрывчатых веществ; 7 — в медицине и в быту (нашатырный спирт)
Новые слова и понятия
- Строение молекулы аммиака.
- Водородная связь.
- Свойства аммиака: взаимодействие с водой, кислотами и кислородом.
- Донорно-акцепторный механизм образования иона аммония.
- Получение, собирание и распознавание аммиака.
Задания для самостоятельной работы
- Каково электронное и пространственное строение молекулы аммиака?
- Перечислите области применения аммиака. Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
- Какую химическую связь называют водородной? В чём особенности водородной связи? Что можно сказать о прочности водородных связей по сравнению с ковалентными и ионными? Какое значение имеет водородная связь в химии и биологии?
- Приведите примеры веществ, между молекулами которых образуются водородные связи. Как это отражается на физических свойствах этих веществ?
- На примере образования катиона аммония из молекулы аммиака объясните принцип образования ковалентной связи по донорно-акцепторному механизму.
Является ли связь, образованная по донорно-акцепторному механизму, особым типом химической связи? Объясните почему.
- Как изменится окраска фенолфталеина при добавлении его к нашатырному спирту? Объясните ответ, составив уравнение химической реакции.
- Какую степень окисления имеет азот: а) в аммиаке; б) в хлориде аммония; в) в нитрате аммония; г) в сульфате аммония?
- Используя метод электронного баланса, определите коэффициенты в следующей схеме химической реакции:

- Почему азот в аммиаке проявляет только восстановительные свойства?
- Как получают аммиак: а) в промышленности; б) в лабораторных условиях?
