Какие связи содержатся в молекуле ацетилена
| Ацетилен | |||
|---|---|---|---|
| Систематическое наименование | Этин | ||
| Традиционные названия | Ацетилен | ||
| Хим. формула | C2H2 | ||
| Рац. формула | HCCH | ||
| Молярная масса | 26,038[1] г/моль | ||
| Плотность | 1,0896 г/л | ||
| Энергия ионизации | 11,4 ± 0,1 эВ[2] | ||
| Температура | |||
| • плавления | -80,8 1277 мм Hg °C | ||
| • сублимации | −119 ± 1 °F[2] | ||
| • кипения | −83,6 °C | ||
| • самовоспламенения | 335 °C | ||
| Пределы взрываемости | 2,5 ± 0,1 об.%[2] | ||
| Тройная точка | −80,55 | ||
| Критическая точка | 35,2°С; 6,4 МПа | ||
| Мол. теплоёмк. | 44,036 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | +226,88 кДж/моль | ||
| • сгорания | –1302 кДж/моль | ||
| Давление пара | 44,2 ± 0,1 атм[2] | ||
| Константа диссоциации кислоты | 25 | ||
| Растворимость | |||
| • в воде | 10018 мл/100 мл | ||
| • в этаноле | 60018 мл/100 мл | ||
| Гибридизация | sp | ||
| Рег. номер CAS | 74-86-2 | ||
| PubChem | 6326 | ||
| Рег. номер EINECS | 200-816-9 | ||
| SMILES | C#C | ||
| InChI | 1S/C2H2/c1-2/h1-2H HSFWRNGVRCDJHI-UHFFFAOYSA-N | ||
| RTECS | AO9600000 | ||
| ChEBI | 27518 | ||
| Номер ООН | 1001 | ||
| ChemSpider | 6086 | ||
| Пиктограммы ECB | |||
| NFPA 704 | 4 1 3 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Ацетиле́н (по ИЮПАК — этин) — органическое соединение, непредельный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный, очень горючий газ.
Получение[править | править код]
В лаборатории[править | править код]
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[3] (Ф. Вёлер, 1862 год)[4]:
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
В промышленности[править | править код]
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы[5][:стр. 274].
Получение пиролизом[править | править код]
Электрокрекинг[править | править код]
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз[править | править код]
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз[править | править код]
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз[править | править код]
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы[править | править код]
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод[править | править код]
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция (негашёную известь) и кокс в электропечах при 2500—3000 °С:
Негашёную известь получают из карбоната кальция:
Далее карбид кальция обрабатывают водой:
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Физические свойства[править | править код]
Рис.1. Пи-связи в молекуле ацетилена
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом. Технический ацетилен хранится в баллонах с пористым наполнителем, пропитанным ацетоном (т.к. чистый ацетилен при сжатии взрывается), и может содержать другие примеси, которые придают ему резкий запах[6]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[7]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[8].
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[4] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[9].
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства[править | править код]
Ацетилено-кислородное пламя (температура «ядра» 2621 °C)
- Для ацетилена (этина) характерны реакции присоединения:
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60—70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
История[править | править код]
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Применение[править | править код]
Ацетилен используют:
- для газовой сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком)[10]
Безопасность[править | править код]
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5—2,5 МПа.
Примечания[править | править код]
- ↑ ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия
- ↑ 1 2 3 4 https://www.cdc.gov/niosh/npg/npgd0008.html
- ↑ Видео данного процесса
- ↑ 1 2 Хвостов, 1988.
- ↑ Лапидус А. Л., Голубева И. А., Жагфаров Ф. Г. Газохимия. Учебное пособие. — М.: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ Большая энциклопедия нефти и газа. Неприятный запах — ацетилен. Дата обращения 10 октября 2013.
- ↑ Корольченко. Пожаровзрывоопасность веществ, 2004, с. 198.
- ↑ Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72.
- ↑ Ацетилен (недоступная ссылка). Дата обращения 10 октября 2013. Архивировано 1 октября 2013 года.
- ↑ В России разработали ракетный двигатель на аммиаке — Известия
Литература[править | править код]
- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
- Хвостов И. В. Ацетилен // Химическая энциклопедия: в 5 т. / И. Л. Кнунянц (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 226—228. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Ссылки[править | править код]
- Ацетилен // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс «40 шагов к 100 баллам на ЕГЭ по химии«.
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Рассмотрим свойства, способы получения и особенности строения алкинов.
Строение, изомерия и гомологический ряд алкинов
Химические свойства алкинов
Получение алкинов
Гомологический ряд алкинов
Все алкины имеют общие или похожие физические и химические свойства. Схожие по строению алкины, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкины образуют гомологический ряд.
Первый представитель гомологического ряда алкенов – этин (ацетилен) C2H2, или СH≡СH.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
Гомологический ряд алкинов
Общая формула гомологического ряда алкинов CnH2n-2.
Первые три члена гомологического ряда алкинов – газы, начиная с C5Н8 по С16Н30 – жидкости, начиная с С17Н32 — твердые вещества.
Алкины плохо растворимы в воде и хорошо растворимы в органических растворителях.
Строение алкинов
Рассмотрим особенности строения алкинов на примере ацетилена.
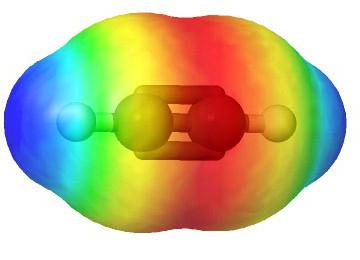
В молекуле ацетилена присутствуют химические связи C–H и С≡С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С≡С – тройная, ковалентная неполярная, одна из связей σ, еще две: π-связи. Атомы углерода при тройной связи образуют по две σ-связи и две π-связи. Следовательно, гибридизация атомов углерода при тройной связи в молекулах алкинов – sp:
sp-Гибридизация
При образовании σ-связи между атомами углерода происходит перекрывание sp-гибридных орбиталей атомов углерода:
Сигма-связь
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Пи-связь
Две sp-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому две гибридные орбитали атомов углерода при тройной связи в алкинах направлены в пространстве под углом 180 градусов друг к другу:
Изображение с сайта orgchem.ru
Это соответствует линейному строению молекулы.
Например, молекуле ацетилена C2H2 соответствует линейное строение.
Изображение с сайта orgchem.ru
Молекулам алкинов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропина присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение.
Изомерия алкинов
Для алкинов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Например. Изомеры с различным углеродным скелетом и с формулой С4Н6 — бутин-1 и бутадиен-1,3
Пентин-1 и 3-метилбутин-1
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкины являются межклассовыми изомерами с алкадиенами. Общая формула алкинов и алкадиенов — CnH2n-2.
Например. Межклассовые изомеры с общей формулой С4Н6 — бутин-1 и бутадиен
Бутин-1 и бутадиен-1,3
Изомеры с различным положением тройной связи отличаются положением тройной связи в углеродном скелете.
Например.
Изомеры положения тройной связи, которые соответствуют формуле С5Н8 — пентин-1 и пентин-2
Пентин-1 и пентин-2
Пространственная изомерия
Для алкенов также характерна оптическая изомерия.
Алкины, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкина должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия для алкинов не характерна, так как по тройной связи вращение возможно.
Номенклатура алкинов
В названиях алкинов для обозначения тройной связи используется суффикс -ИН.
Бутин-2
Для простейших алкинов применяются также исторически сложившиеся (тривиальные) названия:
Тривиальные названия алкинов
Радикалы, содержащие тройную связь, также носят тривиальные названия:
Названия радикалов с тройной связью
Особенности строения ацетилена влияют на его свойства, получение и применение. Условное обозначение состава вещества — С2Н2 — это его простейшая и брутто-формула. Ацетилен образован двумя атомами углерода, между которыми возникает тройная связь. Ее наличие отражают разные виды формул и моделей молекулы этина, позволяющих разобраться в проблеме влияния строения на свойства вещества.
Алкины. Общая формула. Ацетилен
Углеводороды алкины, или ацетиленовые, являются ациклическими, непредельными. Цепочка атомов углерода — не замкнутая, в ней присутствуют простые и кратные связи. Состав алкинов отражает сводная формула CnH2n– 2. В молекулах веществ этого класса присутствует одна или несколько тройных связей. Ацетиленовые соединения относятся к ненасыщенным. Это означает, что только одна валентность углерода реализуется за счет водорода. Оставшиеся три связи используются при взаимодействии с другими атомами углерода.
Первый — и наиболее известный представитель алкинов — ацетилен, или этин. Тривиальное название вещества произошло от латинского слова «acetum» — «уксус» и греческого — «hyle» — «дерево». Родоначальник гомологического ряда был открыт в 1836 году в химических опытах, позже вещество синтезировали из угля и водорода Э. Дэви и М. Бертло (1862 год). При обычной температуре и нормальном атмосферном давлении ацетилен находится в газообразном состоянии. Это бесцветный газ, без запаха, малорастворимый воде. Этин легче растворяется в этаноле и ацетоне.

Молекулярная формула ацетилена
Этин — простейший член своего гомологического ряда, его состав и строение отражают формулы:
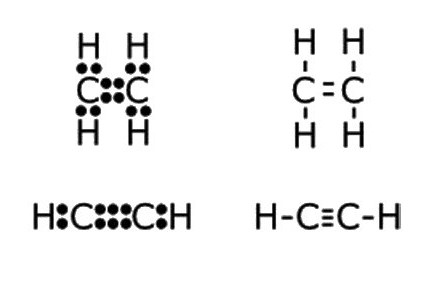
- С2Н2 — молекулярная запись состава этина, которая дает представление о том, что вещество образовано двумя углеродными атомами и таким же числом атомов водорода. По этой формуле можно рассчитать молекулярную и молярную массы соединения. Mr (С2Н2) = 26 а. е. м., М (С2Н2) = 26,04 г/моль.
- Н:С:::С:Н — электронно-точечная формула ацетилена. Подобные изображения, получившие название «структуры Льюиса», отражают электронное строение молекулы. При написании необходимо соблюдать правила: атом водорода стремится при образовании химической связи обладать конфигурацией валентной оболочки гелия, другие элементы — октетом внешних электронов. Каждое двоеточие означает общую для двух атомов или неподеленную пару электронов внешнего энергетического уровня.
- H—C≡C—H — структурная формула ацетилена, отражающая порядок и кратность связей между атомами. Одна черточка заменяет собой одну пару электронов.
Модели молекулы ацетилена
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических). Еще в конце XVIII века получили распространение шаростержневые модели — например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен. Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
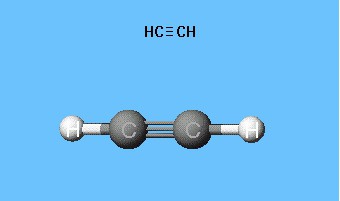
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.
Гибридные атомные орбитали ацетилена
Углерод в возбужденном состоянии содержит три р-орбитали и одну s с неспаренными электронами. При образовании метана (СН4) они принимают участие в создании равноценных связей с атомами водорода. Известный американский исследователь Л. Полинг разработал учение о гибридном состоянии атомных орбиталей (АО). Объяснение поведения углерода в химических реакциях заключается в выравнивании АО по форме и энергии, образовании новых облаков. Гибридные орбитали дают более прочные связи, становится устойчивее формула.
Атомы углерода в молекуле ацетилена, в отличие от метана, подвергаются sp-гибридизации. По форме и энергии смешиваются s- и р электроны. Появляются две sp-орбитали, лежащие под углом 180°, направленные по разные стороны от ядра.
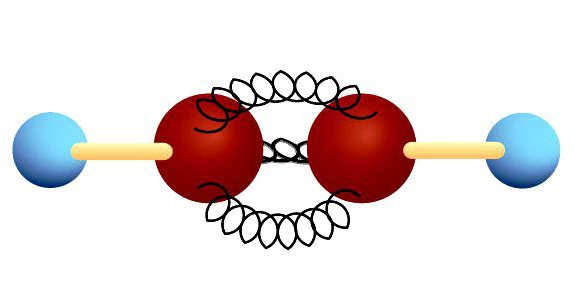
Тройная связь
В ацетилене гибридные электронные облака углерода участвуют в создании σ-связей с такими же соседними атомами и с водородом в парах С—Н. Остаются две перпендикулярные друг другу негибридные p-орбитали. В молекуле этина они участвуют в образовании двух π-связей. Вместе с σ возникает тройная связь, которую отражает структурная формула. Ацетилен отличается от этана и этилена расстоянием между атомами. Тройная связь короче двойной, но обладает большим запасом энергии, является более прочной. Максимальная плотность σ- и π-связей расположена в перпендикулярных областях, что приводит к образованию цилиндрического электронного облака.
Особенности химической связи в ацетилене
Молекула этина имеет линейную форму, что удачно отражает химическая формула ацетилена — H—C≡C—H. Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
- количество пар электронов, связывающих два атома углерода, — 3;
- длина — 0,120 нм;
- энергия разрыва — 836 кДж/моль.
Для сравнения: в молекулах этана и этилена длина одинарной и двойной химической связи — 1,54 и 1,34 нм соответственно, энергия разрыва С—С составляет 348 кДж/моль, C=C — 614 кДж/моль.
Гомологи ацетилена
Ацетилен — простейший представитель алкинов, в молекулах которых также присутствует тройная связь. Пропин СН3С≡СН — гомолог ацетилена. Формула третьего представителя алкинов — бутина-1 — СН3СН2С≡СН. Ацетилен — тривиальное название этина. Систематическая номенклатура алкинов подчиняется правилам ИЮПАК:
- в линейных молекулах указывается название основной цепи, возникшее от греческого числительного, к которому добавляется суффикс -ин и номер атома при тройной связи, например, этин, пропин, бутин-1;
- нумерацию главной цепочки атомов начинают с конца молекулы, ближайшего к тройной связи;
- для разветвленных углеводородов сначала идет наименование бокового ответвления, затем следует название главной цепочки атомов с суффиксом -ин.
- заключительная часть наименования — цифра, указывающая расположение в молекуле тройной связи, например, бутин-2.
Изомерия алкинов. Зависимость свойств от строения
Этин и пропин не имеют изомеров положения тройной связи, они появляются, начиная с бутина. Изомеры углеродного скелета есть у пентина и следующих за ним гомологов. Относительно тройной связи не проявляется пространственная изомерия ацетиленовых углеводородов.
Первые 4 гомолога этина — газы, плохо растворимые в воде. Ацетиленовые углеводороды C5 – C15 — жидкости. Твердыми веществами являются гомологи этина, начиная с углеводорода C17. Химическая природа алкинов испытывает значительное влияние тройной связи. Углеводороды этого типа активнее, чем этиленовые, присоединяют различные частицы. На этом свойстве основано широкое применение этина в промышленности и технике. При горении ацетилена выделяется большое количество теплоты, что находит применение в газовой резке и сварке металлов.
