Какие соединения могут проявлять только восстановительные свойства
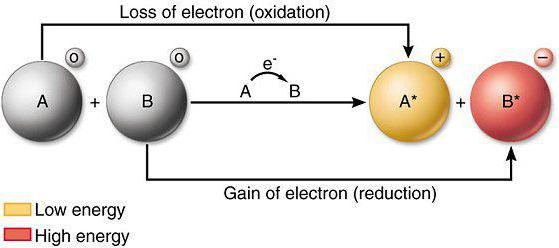
Окислительно-восстановительные свойства отдельных атомов, а также ионов являются важным вопросом современной химии. Данный материал помогает объяснять активность элементов и веществ, проводить детальное сравнение химических свойств у разных атомов.

Что такое окислитель
Многие задачи по химии, включая тестовые вопросы единого государственного экзамена в 11 классе, и ОГЭ в 9 классе, связаны с данным понятием. Окислителем считают атомы либо ионы, которые в процессе химического взаимодействия принимают электроны от другого иона либо атома. Если анализировать окислительные свойства атомов, нужна периодическая система Менделеева. В периодах, располагающихся в таблице слева направо, окислительная способность атомов возрастает, то есть меняется аналогично неметаллическим свойствам. В основных подгруппах подобный параметр уменьшается сверху вниз. Среди самых сильных простых веществ, обладающих окислительной способностью, лидирует фтор. Такой термин, как «электроотрицательность», то есть возможность атома принимать в случае химического взаимодействия электроны, можно считать синонимом окислительных свойств. Среди сложных веществ, которые состоят из двух и больше химических элементов, яркими окислителями можно считать: перманганат калия, хлорат калия, озон.

Что такое восстановитель
Восстановительные свойства атомов характерны для простых веществ, проявляющих металлические свойства. В таблице Менделеева в периодах металлические свойства слева направо ослабевают, а в основных подгруппах (вертикально) они усиливаются. Суть восстановления в отдаче электронов, которые располагаются на внешнем энергетическом уровне. Чем большее количество электронных оболочек (уровней), тем легче отдать во время химического взаимодействия «лишние» электроны.
Отличными восстановительными свойствами обладают активные (щелочные, щелочно-земельные) металлы. Кроме того, веществ, проявляющих подобные параметры, выделим оксид серы (6), угарный газ. Для того чтобы приобрести максимальную степень окисления, данные соединения вынуждены проявлять восстановительные свойства.
Процесс окисления
Если во время химического взаимодействия атом либо ион отдает электроны иному атому (иону), идет речь о процессе окисления. Для анализа того, как меняются восстановительные свойства и окислительная способность, потребуется таблица элементов Менделеева, а также знание современных законов физики.

Процесс восстановления
Восстановительные процессы предполагают принятие ионами либо атомами электронов от других атомов (ионов) во время непосредственного химического взаимодействия. Отличными восстановителями являются нитриты, сульфиты щелочных металлов. Восстановительные свойства в системе элементов меняются аналогично металлическим свойствам простых веществ.
Алгоритм разбора ОВР
Для того чтобы в готовой химической реакции учащийся мог расставить коэффициенты, необходимо воспользоваться специальным алгоритмом. Окислительно-восстановительные свойства помогают решать и разнообразные расчетные задачи в аналитической, органической, общей химии. Предлагаем порядок разбора любой реакции:
- Сначала важно определить у каждого имеющегося элемента степень окисления, используя правила.
- Далее определяют те атомы либо ионы, которые поменяли свою степень окисления, будут участвовать в реакции.
- Знаками «минус» и «плюс» указывают число отданных и принятых в ходе химической реакции свободных электронов.
- Далее между числом всех электронов определяется минимальное общее кратное, то есть целое число, которое без остатка делится на принятые и отданные электроны.
- Затем его делят на электроны, участвовавшие в химической реакции.
- Далее определяем, какие именно ионы либо атомы восстановительными свойствами обладают, а также определяют окислители.
- На завершающем этапе ставят коэффициенты в уравнении.
Применяя способ электронного баланса, расставим коэффициенты в данной схеме реакции:
NaMnO4 + сероводород + серная кислота= S + Mn SO4 +…+…
Алгоритм решения поставленной задачи
Выясним, какие именно должны после взаимодействия образоваться вещества. Так как в реакции уже есть окислитель (им будет марганец) и определен восстановитель (им будет сера), образуются вещества, в которых уже не меняются степени окисления. Так как основная реакция протекала между солью и сильной кислородсодержащей кислотой, то одним из конечных веществ станет вода, а вторым — соль натрия, точнее, сульфат натрия.
Составим теперь схему отдачи и принятия электронов:
— Mn+7 берет 5 e= Mn+2.
Вторая часть схемы:
— S-2 отдает2e= S0
Ставим в исходную реакцию коэффициенты, не забывая при этом суммировать все атомы серы в частях уравнения.
2NaMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + 8H2O + Na2SO4.
Разбор ОВР с участием перекиси водорода
Применяя алгоритм разбора ОВР, можно составить уравнение протекающей реакции:
перекись водорода + серная кислота + пермагнанат калия = Mn SO4 + кислород + …+…
Степени окисления изменили ион кислорода (в перекиси водорода) и катион марганца в перманганате калия. То есть восстановитель, а также окислитель у нас присутствуют.
Определим, что за вещества еще могут получиться после взаимодействия. Одно из них будет водой, что вполне очевидно, представлена реакция между кислотой и солью. Калий не образовал нового вещества, вторым продуктом станет соль калия, а именно сульфат, так как реакция шла с серной кислотой.
Схема:
2O – отдает 2 электрона и превращается в O20 5
Mn+7 принимает 5 электронов и становится ионом Mn+2 2
Поставим коэффициенты.
5H2O2 + 3H2SO4 + 2KMnO4 = 5O2 + 2Mn SO4 + 8H2O + K2SO4

Пример разбора ОВР с участием хромата калия
Используя способ электронного баланса, составим уравнение с коэффициентами:
FeCl2 + соляная кислота + хромат калия = FeCl3+ CrCl3 + …+…
Степени окисления поменяли железо (в хлориде железа II) и ион хрома в бихромате калия.
Теперь постараемся выяснить, какие еще вещества образуются. Одно может быть солью. Поскольку калий не образовал никакого соединения, следовательно, вторым продуктом будет соль калия, точнее, хлорид, ведь реакция проходила с соляной кислотой.
Составим схему:
Fe+2 отдает e =Fe+3 6 восстановитель,
2Cr+6 принимает 6 e = 2Cr +3 1 окислитель.
Поставим коэффициенты в начальную реакцию:
6K2Cr2O7 + FeCl2 + 14HCl = 7H2O + 6FeCl3 + 2CrCl3 + 2KCl

Пример разбора ОВР с участием иодида калия
Вооружившись правилами, составим уравнение:
перманганат калия + серная кислота + иодид калия…сульфат марганца + йод +…+…
Степени окисления изменили марганец и йод. То есть восстановитель и окислитель присутствуют.
Теперь выясним,что в итоге у нас образуется. Соединение будет у калия, то есть получим сульфат калия.
Восстановительные процессы протекают у ионов йода.
Составим схему передачи электронов:
— Mn+7 принимает 5 e = Mn+2 2 является окислителем,
— 2I- отдает2 e = I20 5 является восстановителем.
Расставляем коэффициенты в начальную реакцию, не забываем при этом суммировать все атомы серы в данном уравнении.
210KI + KMnO4 + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
Пример разбора ОВР с участием сульфита натрия
Используя классический метод, составим для схемы уравнение:
— серная кислота + KMnO4 + сульфит натрия… сульфат натрия + сульфат марганца +…+…
После взаимодействия получим соль натрия, воду.
Составим схему:
— Mn+7 принимает 5 e= Mn+2 2,
— S+4 отдает 2 e = S+6 5.
Расставляем коэффициенты в рассматриваемую реакцию, не забываем складывать атомы серы при расстановке коэффициентов.
3H2SO4 + 2KMnO4 + 5Na2SO3 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Пример разбора ОВР с участием азота
Выполним следующее задание. Пользуясь алгоритмом, составим полное уравнение реакции:
— нитрат марганца +азотная кислота+PbO2=HMnO4+Pb(NO3) 2+
Проанализируем, какое вещество еще образуется. Так как реакция проходила между сильным окислителем и солью, значит, веществом будет вода.
Покажем изменение числа электронов:
— Mn+2 отдает 5 e = Mn+7 2 проявляет свойства восстановителя,
— Pb+4 принимает 2 e = Pb+2 5 окислителем.
3. Расставляем коэффициенты в исходную реакцию, обязательно складываем весь азот, имеющийся в левой части исходного уравнения:
— 2Mn(NO3)2 + 6HNO3 + 5PbO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O.
В данной реакции не проявляются восстановительные свойства азота.
Второй образец окислительно-восстановительной реакции с азотом:
Zn + серная кислота + HNO3= ZnSO4 + NO+…
— Zn0 отдает 2 e = Zn+2 3 будет восстановителем,
N+5принимает 3 e = N+2 2 является окислителем.
Расставляем коэффициенты в заданную реакцию:
3Zn + 3H2SO4 + 2HNO3 = 3ZnSO4 + 2NO + 4H2O.
Значимость окислительно-восстановительных реакций
Самые известные восстановительные реакции — фотосинтез, характерный для растений. Как изменяются восстановительные свойства? Процесс происходит в биосфере, приводит к повышению энергии с помощью внешнего источника. Именно эту энергию и использует для своих нужд человечество. Среди примеров окислительных и восстановительных реакций, связанных с химическими элементами, особое значение имеют превращения соединений азота, углерода, кислорода. Благодаря фотосинтезу земная атмосфера имеет такой состав, который необходим для развития живых организмов. Благодаря фотосинтезу не увеличивается количество углекислого газа в воздушной оболочке, поверхность Земли не перегревается. Растение не только развивается с помощью окислительно-восстановительной реакции, но и образует такие нужные для человека вещества, как кислород, глюкоза. Без данной химической реакции невозможен полноценный круговорот веществ в природе, а также существование органической жизни.
Практическое применение ОВР
Для того чтобы сохранить поверхность металла, необходимо знать, что восстановительными свойствами обладают активные металлы, поэтому можно покрывать поверхность слоем более активного элемента, замедляя при этом процесс химической коррозии. Благодаря наличию окислительно-восстановительных свойств осуществляется очистка и дезинфекция питьевой воды. Ни одну задачу нельзя решить, не расставив правильно в уравнении коэффициенты. Для того чтобы избежать ошибок, важно иметь представление обо всех окислительно-восстановительных параметрах.
Защита от химической коррозии
Особую проблему для жизни и деятельности человека представляет коррозия. В результате данного химического превращения происходит разрушение металла, теряют свои эксплуатационные характеристики детали автомобиля, станков. Для того чтобы исправить подобную проблему, используется протекторная защита, покрытие металла слоем лака либо краски, применение антикоррозионных сплавов. Например, железная поверхность покрывается слоем активного металла — алюминия.
Заключение
Разнообразные восстановительные реакции происходят и в организме человека, обеспечивают нормальную работу пищеварительной системы. Такие основные процессы жизнедеятельности, как брожение, гниение, дыхание, также связаны с восстановительными свойствами. Обладают подобными возможностями все живые существа на нашей планете. Без реакций с отдачей и принятием электронов невозможна добыча полезных ископаемых, промышленное производство аммиака, щелочей, кислот. В аналитической химии все методы объемного анализа основаны именно на окислительно-восстановительных процессах. Борьба с таким неприятным явлением, как химическая коррозия, также основывается на знании этих процессов.
Какие из указанных ниже веществ могут проявлять только окислительные свойства только восстановительные свойства как окислительные, так и восстановительные свойства [c.91]
Укажите, какие из указанных веществ могут проявлять только окислительные свойства только восстановительные свойства проявляют окислительно-восстановительную двойственность [c.149]
Укажите, в каких из приведенных ниже веществ сера может проявлять только восстановительные свойства, только окислительные, те и другие S, HaS, HaSOa, SO3, FeS, SO2, H2SO4, NaaSaOg. [c.72]
Химические свойства серы. Сера — типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может Сыть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислителя при взаимодействии с простыми веществами — восстановителями (металлами, водородом, некоторыми неметаллами, имеющими меньшую ЭО). Восстановителем сера является по отношению к более сильным окис/штелям (кислороду, галогенам и кислотам-окислителям). [c.363]
Водород проявляет и восстановительные, и окислительные свойства. В обычных условиях благодаря прочности молекул он сравнительно мало активен и непосредственно взаимодействует лишь со фтором. При нагревании же вступает во взаимодействие с многими неметаллами — хлором, бромом, кислородом и пр. Восстановительная способность водорода используется для получения некоторых простых веществ из оксидов и галидов [c.274]
Иными словами, вещества, содержащие атомы элемента в промежуточной степени окисления, проявляют окислительно-восстановительную двойственность с сильными восстановителями они проявляют свойства окислителя, а с [c.82]
Какие из перечисленных веществ и за счет каких элементов проявляют обычно окислительные свойства и какие — восстановительные Указать те из них, которые обладают окислительно-восстановительной двойственностью ИаЗ, ЗОг, СО, 2п, Рг, NaN02, КМп04, Н0С1, НзЗЬОз. [c.166]
Пероксид водорода и азотистая кислота проявляют и окислительные и восстановительные свойства. Обсудите, какая реакция возможна при смешении растворов этих веществ, и проверьте предсказания опытом. Как влияет среда раствора на окислительно-восстановительные свойства веществ [c.285]
В каких из перечисленных ниже веществ хром может проявлять только восстановительные свойства, только окислительные или те и др>тие Сг2(804)з, СгОз, К2СЮ4, Сг, СгС12, К2СГ2О7 [c.87]
Какой элемент и в какой степени окисления определяет возможность для указатн.5х ниже веществ проявлять окислительные или восстановительные свойства РЬО,, ВаОа, КН, Н2О2, СО, N H., Na-.S.O,, Са(0С1)С1, Na.S O [c.248]
Обнаружение анионов. Содовая вытяжка. Иногда обнаружение анионов требует специальной подготовки сухого вещества беспрепятственное обнаружение возможно лишь в присутствии катионов калия, натрия и аммония. Что же касается катионов 2—5-й групп вместе с магнием (П), то они мешают обнаружению анионов (дают осадки, проявляют окислительно-восстановительные свойства и т.п.). Чтобы удалить катионы «тяжелых металлов» и перевести все соли в натриевые, анализируемое вещество кипятят с карбонатом натрия (содой). [c.155]
Химические свойства простых веществ. В химических реакциях металлы обычно выступают как восстановители. Неметаллы, кроме фтора, могут проявлять как окислительные, так и восстановительные свойства. При этом характер изменения восстановительной и окислительной активности простых веществ в группах и подгруппах существенно зависит от природы партнера по реакции и условий осуществления реакции. Обычно в главных подгруппах проявляется общая тенденция с увеличением порядкового номера элемента окислительные свойства неметаллов ослабевают, а восстановительные свойства металлов усиливаются. Об этом, в частности, свидетельствует характер изменения стандартных изобарных потенциалов образования однотипных соединений. Например, в реакции окисления хлором металлов главной подгруппы П группы [c.260]
Атомы элементов в разных веществах имеют большую или меньшую степень окисления и поэтому проявляют различные окислительно-восстановительные свойства. По этим свойствам атомы элементов в разных веществах могут быть разделены на три группы [c.223]
Обнаружение анионов требует специальной подготовки сухого вещества. Дело в том, что беспрепятственное открытие их возможно лишь в присутствии катионов К+, Na+ и NHJ. Что же касается катионов тяжелых металлов , т. е. ионов 2—5 групп вместе с Mg2+, то они мешают обнаружению анионов (образуют осадки, проявляют окислительно-восстановительные свойства и т. п.). Поэтому для удаления катионов тяжелых металлов и перевода всех солей в натриевые анализируемое вещество кипятят с раствором карбоната натрия Na. 03. При этом катионы 2—5 групп осаждаются в виде карбонатов (иногда — основных карбонатов) или гидроокисей [c.231]
Таким образом, по отношению к воде простые вещества могут выступать или как восстановители (случаи 1, 2 и 4), или как окислители (случай 6), или как окислители-восстановители (случай 5), или же окислительно-восстановительных свойств не проявляют вообще (случай 3 и 7). [c.216]
В рассматриваемой реакции участвуют те же исходные вещества, но уже в щелочной среде, поэтому они проявляют несколько иные окислительно-восстановительные свойства. [c.202]
Ионно-молекулярные реакции с участием молекул исследуемого вещества и вторичных ионов. При введении паров исследуемого вещества в количестве до 0,1% в зону газа-реаген-та происходит взаимодействие его молекул со вторичными ионами. Последние в зависимости от природы газа-реагента могут проявлять кислотно-основные или окислительно-восстановительные свойства. В результате этого при ХИ имеют место перенос протона, отщепление гидрид-иона или перезарядка. На схеме показаны следующие процессы а) перенос протона от вторичного иона к молекуле исследуемого вещества, б) отщепление гидрид-иона от исходной молекулы и перенос его на вторичный ион [c.24]
Степень окисления азота в гидроксиламине равна -1. Поэтому он проявляет как восстановительные, так и окислительные свойства. Однако более характерна восстановительная способность гидроксиламина. В частности, он применяется как восстановитель (главным образом в виде солей) в лабораторной практике. Кроме того, его используют в производстве некоторых органических веществ. [c.435]
В соответствии с принятым определением редоксита, как фазы переменного состава, способной к обратимому окислительно-вос-становительному взаимодействию с водным раствором, твердый редоксит можно рассматривать как твердый раствор. Последний образован рабочим веществом и матрицей, играющей роль растворителя. Свойства редоксита зависят от природы рабочего вещества, его концентрации, т. е. окислительно-восстановительной емкости, и от взаимодействия функциональных групп рабочего вещества друг с другом и матрицей. Последнее проявляется в полифункциональности редоксита, как различии в окислительно-восстановительных свойствах отдельных функциональных групп [296, 328, 329]. [c.242]
Окислительно-восстановительные свойства высокомолекулярных твердых нерастворимых в воде и некоторых растворителях веществ проявляются за счет отдельных атомов или групп атомов, валентность которых может быть переменной. Наличие подобных групп, способных отдавать (восстановители) или принимать (окислители) электроны, на первый взгляд, даже невыгодно отличает рассматриваемые соединения от низкомолекулярных растворимых аналогов, так как снижает количество активных групп, приходящихся на единицу объема или массы реагента. Однако высокомолекулярные твердые окислительно-восстановительные соединения очень удобны в лабораторной и промышленной практике. [c.9]
В последние годы начинает развиваться и химия полупроводников. В частности, это проявляется в разработке новых методов получения и анализа индивидуальных веществ исключительно высокой степени чистоты и правильной кристаллической структуры, что необходимо для получения некоторых полупроводниковых материалов с заданными свойствами. Кроме того, за последние годы отчетливо выявилось, что внутренняя структура, характерная для полупроводников, определяет также и химические свойства некоторых соединений, в частности свойства некоторых катализаторов окислительно-восстановительных реакций. [c.145]
Гуминовые кислоты как окислительно-восстановительная система близки йо свойствам веществам, определяющим протекание процессов дыхания и фотосинтеза в растительной клетке. Они также проявляют ярко выраженную биологическую активность. Под биологической активностью понимают способность вещества усиливать процессы вегетации (роста) растений. [c.24]
Наряду с химическими соединениями, способными в зависимости от конкретных условий проявлять и окислительные и восстановительные свойства, существуют вещества, которые могут быть или только окислителями или исключительно восстановителями. [c.53]
Определим восстановитель и окислитель и коэффициенты для них. Мы уже выяснили раньше окислительно-восстановительные свойства сульфита натрия и перманганата калия в кислой среде. В рассматриваемой теперь реакции участвуют те же исходные вещества (ЫааЗОз и КМГ1О4), но только в сильно концентрированной щелочной среде. В связи с этим они проявляет несколько иные окислительно-восстановительные свойства. [c.124]
Перманганатометрня. Метод основан на реакциях окисления различных веществ перманганатом калия. Окисление проводят в кислой среде, в которой перманганат-ион проявляет наиболее сильные окислительные свойства и способен реагировать с большинством восстановителей. Стандартный окислительно-восстановительный потенциал пары Мп04/Мп + составляет 1,52 В. Продуктом восстановления перманганата калня является почти бесцветный ион Мп + [c.136]
Пероксид водорода и пероксиды проявляют окислительно-восстановительные свойства (см. 11.2 и 12.2). Н2О2 может окислять вещества, у которых стандартный потенциал ( «) не превышает [c.249]
У элементов главных подгрупп по мере увеличения порядкового номера энергия ионизации уменьшается. Уменьшается также и сродство к электрону. В результате в каждой главной подгруппе с повышением порядкового номера увеличиваются восстановительные свойства простых веществ и уменьшаются окислительные. Например, из элементов главной подгруппы II группы наиболее активные восстановители — барий и радий, а из элементов главной подгруппы VII группы (галогенов) самый активный окислитель — фтор. В одной и той же главной подгруппе могут находиться элементы с резко различньши окислительно-восстановительными свойствами. Так, в главной подгруппе VI группы кислород проявляет только окислительные свойства, а полоний — в основном только восстановительные. [c.151]
Растворив вещество, обнаруживают сначала катионы, так как по составу их можно судить об отсутствии некоторых анионов (стр. 412). Открытие анионов иногда требует специальной подготовки сухого вещества беспрепятственное обнаружение их возможно лишь в присутствии катионов Na+, и NHj. Катионы второй-пятой групп мешают обнаружению анионов (образуют осадки, проявляют окислительно-восстановительные свойства и т. п.). Поэтому для удаления этих катионов и перевода всех солей в натриевые вещество кипятят с раствором Nag Og. Затем анализируют содовую вытяжку на содержание анионов (стр. 419). [c.421]
Обнаружение аниона облегчается тем, что катион соли уже известен. Во-первых, наличие определенных катионов, согласно таблице растворимости, исключает присутствие некоторых анионов (например, хорошо растворимая соль бария исключает наличие в нейтральном водном растворе анионов SO/, SOg , S Og «, Og «). Во-вторых, при подкислении раствора в ходе анализа катионов по выделению газов можно сразу сделать предположение о присутствии в исследуемом растворе анионов S , SOg , SjOg , Og , NO . Это предположение обычно подтверждается результатами предварительных испытаний. В-третьих, если в анализируемом растворе открыты катионы тяжелых металлов, мешающие обнаружению анионов (проявляют окислительно-восстановительные свойства, образуют осадки и т. п.), исследуемое вещество кипятят с карбонатом натрия (содой). В результате анализируемые анионы остаются в растворе в виде растворимых солей натрия, а катионы тяжелых металлов выпадают в осадок. Полученный раствор, называемый содовой вытяжкой , нейтрализуют уксусной кислотой для удаления избытка карбоната натрия. Затем, с помощью групповых реактивов, определяют, к какой аналитической группе относятся присутствующие анионы и открывают их соответствующими характерными реакциями. [c.184]
Иными словами, вещества, содержащие атомы элемента в промежуточной степени окисления, проявляют окислительно-восстановительную двойственность с сильными восстановптелями они проявляют свойства окислителя, а с сильными окислителями — свойства восстановителя [c.101]
Особый интерес представляют способы адсорбционного концентрирования, связанные с применением электродов с модифицированной поверхностью. Заметим, что придание поверхности электрода специфических свойств путем соответствующей обработки (нанесение полимерной пленки, пришивка функциональных групп или ферментов и т.п.) существенно повышает селективность определений методом ИВА. Модифицирование электродной поверхности зачастую обеспечивает избирательное определение соединений с близкими окислительно-восстановительными свойствами либо электрохимически инертных на обычных электродах, когда прямое детектирование требует высоких потенциалов. Так, нанесение на поверхность графитового электрода порфириновых комплексов кобальта облегчает восстановление кислородсодержащих органических соединений. Аналогичные эффекты наблюдаются при модифицировании электродной поверхности сорбентами, фенантролиновыми и дипиридильными комплексами кобальта и железа, макроциклами, К4-комплексами, которые необратимо адсорбируются на углеродных материалах. Такие электроды проявляют высокую селективность к определяемым веществам и имеют низкие пределы обнаружения. [c.434]
Если рассматривать окислительно-восстановительные свойства простых веществ, то водород более закономерно поместить в I группу, а ие в VII. Действительно, подобно щелочным металлам водород является довольно сильным восстановителем. Восстановительные свойства щелочных металлов ослабевают от тяжелых металлов к более легким. У водорода оии более слабые, чем у остальных элементов этой подгруппы. Как видим, отмеченная выше закономерность соблюдается. Свободные галогены — сильные окпс-лктели, приче.м пх окислительные свойства усиливаются от иода к фтору.. Значит, с точки зрения окислительно-восстановительных свойств простых веществ считать водород полноправным членом подгруппы галогенов можио ыло бы только в том случае, если бы он проявлял еще более сильные окислительные свойства, чем свободный фтор [c.218]
Вообще же разделение веществ на окислители и восстановители не является очень строгим. Некоторые соединения, в зависимости от того, с каким веществом реагируют, могут проявлять либо восстановительные свойства, либо окислительные. Например сернистая кислота при взаргмодействии с хлором проявляет восстановительные свойства она восстанавливает хлор в хлорид-анионы, окисляясь при этом в серную кислоту [c.319]
Взаимодействие простых веществ с кислотами — окислительно-восстановительный процесс, в котором кис- ота выступает в качестве окислителя, а простое вещество — в роли восстановителя. Характер протекания процесса зависит рт а) природы кислоты и ее концентрации б) температуры с) природы простого вещества. Разбавленные кислоты, как правило, проявляют окислительные свойства за счет иона водорода, а концентрированные — за счет элемента (не водорода и не кислорода) в высшей степени окисления. НС1 и в разбавленном и в концентрированном виде в реакциях с металлами проявляет окислительные свойства за счет иона водорода . HNO3 и в разбавленном и в концентрированном виде проявляет окислительные свойства только за счет азота (в степени окисления -1-5). [c.107]
Запись данных опыта. Написать уравнение реакции взаимодействия серы с цинком. Какова степень окисления серы в полученном соединении Известно, что сера горит на воздухе с образованием диоксида серы. Какова степень окислення серы в 8С>2 Окислительные или восстановительные свойства проявляет сро-бодная сера в каждом случае Обратить внимание на окнслитель-но-восстановительиую двойственность р-элементов в виде простых веществ. [c.96]
