Какие простые и сложные вещества содержаться в воздухе
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В химии кроме терминов “атом” и “молекула”
часто употребляется понятие “элемент”. Что общего и чем эти понятия
различаются?
Химический элемент – это атомы одного
и того же вида. Так,
например, все атомы водорода – это элемент водород; все атомы кислорода и ртути
– соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то
есть более 107 химических элементов. Нужно различать понятия “химический
элемент”, “атом” и “простое вещество”
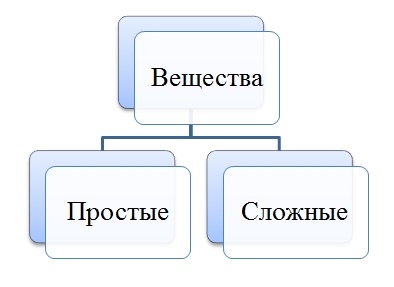
Простые и
сложные вещества
По
элементному составу различают простые вещества, состоящие из атомов
одного элемента (H2, O2,Cl2, P4,
Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3,
OF2, H2SO4, MgCl2,K2SO4).
В настоящее
время известно 115 химических элементов, которые образуют около 500простых
веществ.

Самородное золото — простое
вещество.
Способность
одного элемента существовать в виде различных простых веществ, отличающихся по
свойствам, называется аллотропией.Например, элемент кислород O имеет две
аллотропные формы — дикислород O2 и озон O3с различным
числом атомов в молекулах.
Аллотропные
формы элемента углерод C — алмаз и графит — отличаются строение их
кристаллов.Существуют и другие причины аллотропии.
Название | Аллотропные формы |
Углерод С | Графит
|
Алмаз
|
Сложные
вещества часто называют химическими соединениями, например оксид
ртути(II) HgO (получается путем соединения атомов простых веществ — ртути Hg и
кислорода O2), бромид натрия(получается путем соединения атомов
простых веществ — натрия Na и брома Br2).
Итак,
подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые
– молекулы таких веществ состоят из атомов одного вида. В химических
реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные
– молекулы таких веществ состоят из атомов разного вида. В химических
реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и
“простое вещество”
Отличить понятия “химический элемент” и “простое
вещество” можно при сравнении свойств простых и сложных веществ. Например,
простое вещество – кислород – бесцветный газ, необходимый для дыхания,
поддерживающий горение. Мельчайшая частица простого вещества кислорода –
молекула, которая состоит из двух атомов. Кислород входит также всостав оксида
углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит
химически связанный кислород, который не обладает свойствами простого вещества,
в частности он не может быть использован для дыхания. Рыбы, например, дышат не
химически связанным кислородом, входящим в состав молекулы воды, а свободным,
растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических
соединений, следует понимать, что в эти соединения входят не простые вещества,
а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться
в свободном состоянии и соединяясь, образовывать простые вещества. Простые
вещества состоят из атомов одного элемента. Различие понятий «химический
элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент
может образовывать несколько простых веществ. Например, атомы элемента
кислорода могут образовать двухатомные молекулы кислорода и трехатомные –
озона. Кислород и озон – совершенно различные простые вещества. Этим
объясняется тот факт, что простых веществ известно гораздо больше, чем
химических элементов.
Пользуясь понятием «химический элемент», можно дать
такое определение простым и сложным веществам:
Простыми называют такие вещества, которые
состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые
состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое
соединение»
Сложные
вещества часто называют химическими соединениями.
Осуществите
переход по ссылке и просмотрите опыт
взаимодействия простых веществ железа и серы.
Попробуйте ответить
на вопросы:
1.Чем отличаются по
составу смеси от химических соединений?
2. Сопоставьте
свойства смесей и химических соединений?
3. Какими
способами можно разделить на составляющие компоненты смеси и химического
соединения?
4. Можно
ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная
характеристика смесей и химических
Вопросы для сопоставления смесей с | Сопоставление | |
Смеси | Химические соединения | |
Чем отличаются по составу смеси от | Вещества можно смешивать в любых соотношениях, т.е. | Состав химических соединений постоянный. |
Сопоставьте свойства смесей и | Вещества в составе смесей сохраняют свои свойства | Вещества, образующие соединения, свои свойства не |
Какими способами можно разделить | Вещества можно разделить физическими способами | Химические соединения можно разложить только с |
Можно ли судить по внешним | Механическое смешивание не сопровождается выделением | Об образовании химического соединения можно судить |
Задания для закрепления
I. Поработайте с тренажёрами
Тренажёр №1
Тренажёр №2
Тренажёр №3
Тренажёр №4
Тренажёр №5
II. Решите задание
Из предложенного списка веществ выпишите отдельно простые и сложные вещества:
NaCl, H2SO4, K, S8, CO2, O3, H3PO4, N2, Fe.
Объясните ваш выбор, в каждом из случаев.
III. Ответьте на вопросы
№1
Сколько
простых веществ записано в ряду формул:
H2O, N2, O3, HNO3, P2O5,
S, Fe, CO2, KOH.
№2
К
сложным относятся оба вещества:
А) С (уголь) и S (сера);
Б) CO2 (углекислый газ)и H2O (вода);
В) Fe (железо) и CH4 (метан);
Г) H2SO4 (серная кислота) и H2 (водород).
№3
Выберите
правильное утверждение:
Простые вещества состоят из атомов одного вида.
А) Верно
Б)
Неверно
№4
Для
смесей характерно то, что
А) Они имеют постоянный состав;
Б) Вещества в составе «смеси» не сохраняют свои индивидуальные
свойства;
В) Вещества в «смесях» можно разделить физическими свойствами;
Г) Вещества в «смесях» можно разделить при помощи химической реакции.
№5
Для
«химических соединений» характерно следующее:
А) Переменный состав;
Б) Вещества, в составе «химического соединения»можно разделить
физическими способами;
В) Об образовании химического соединения можно судить по признакам химических
реакций;
Г) Постоянный состав.
№6
В каком
случае идёт речь о железе как о химическом элементе?
А) Железо — это металл, который притягивается магнитом;
Б) Железо входит с состав ржавчины;
В) Для железа характерен металлический блеск;
Г) В состав сульфида железа входит один атом железа.
№7
В каком
случае идёт речь о кислороде как о простом веществе?
А) Кислород — это газ, поддерживает дыхание и горение;
Б) Рыбы дышат кислородом, растворённым в воде;
В) Атом кислород входит в состав молекулы воды;
Г) Кислород входит в состав воздуха.

Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
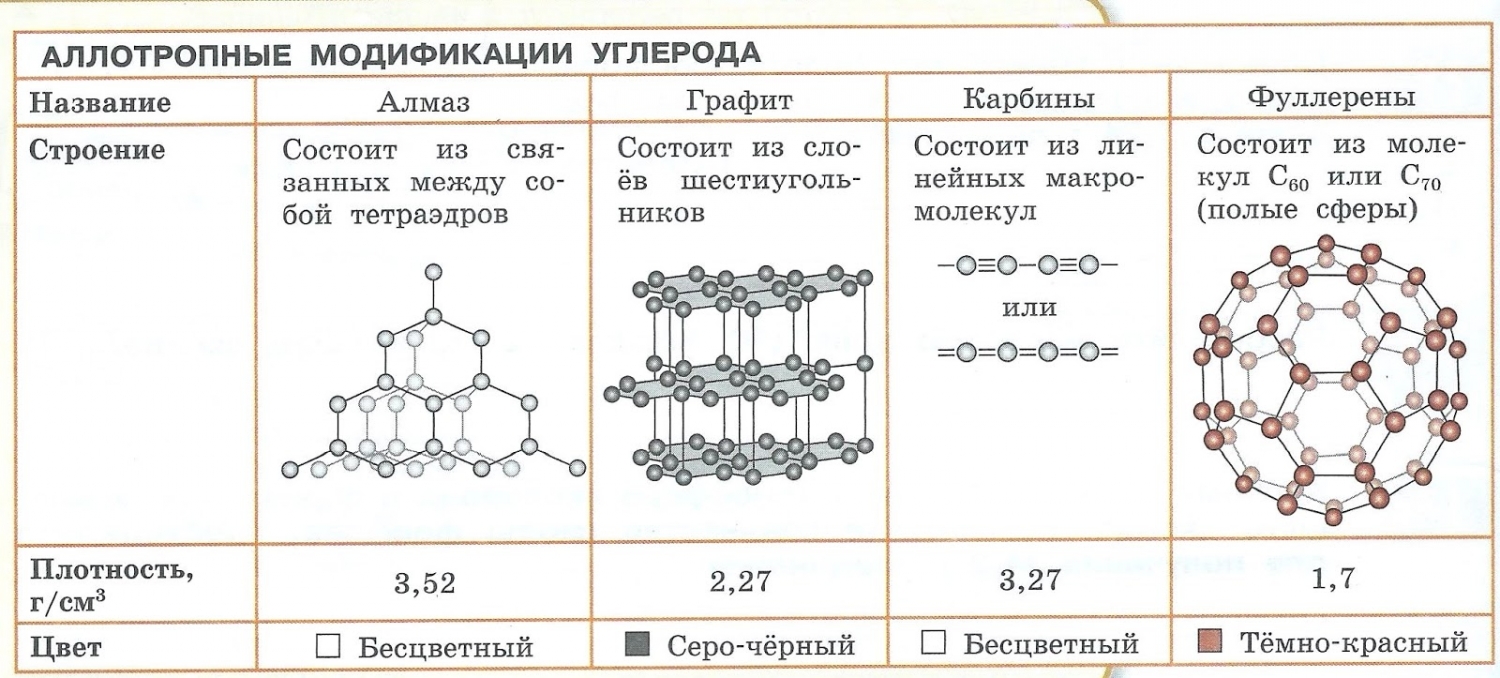
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
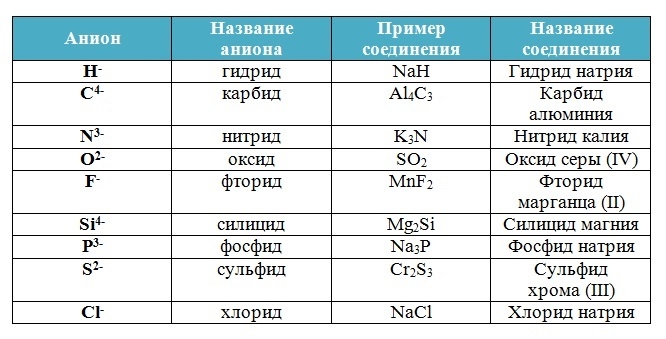
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
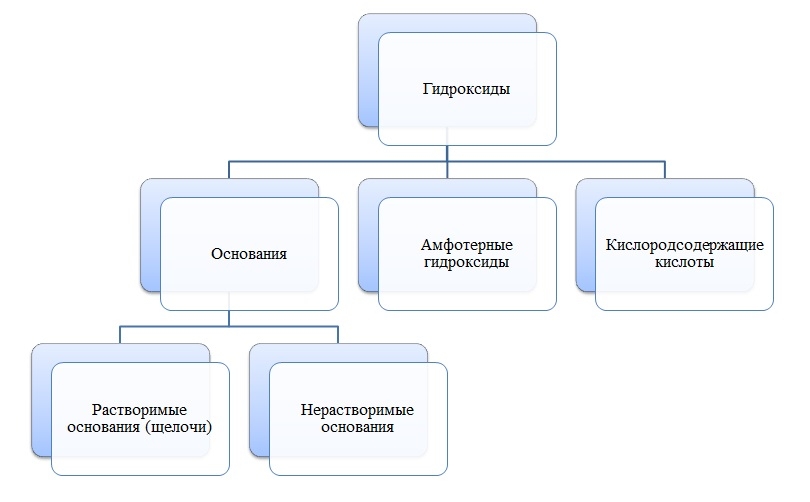
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Все вещества делятся на простые и сложные.
Простые вещества — это вещества, которые состоят из атомов одного элемента.
В некоторых простых веществах атомы одного элемента соединяются друг с другом и образуют молекулы. Такие простые вещества имеют молекулярное строение. К ним относятся: водород H2, кислород O2, азот N2, фтор F2, хлор Cl2, бром Br2, йод I2. Все эти вещества состоят из двухатомных молекул. (Обратите внимание, что названия простых веществ совпадают с названиями элементов!)
Другие простые вещества имеют атомное строение, т. е. состоят из атомов, между которыми существуют определенные связи. Примерами таких простых веществ являются все металлы (железо Fe, медь Сu, натрий Na и т. д.) и некоторые неметаллы (углерод С, кремний Si и др.). Не только названия, но и формулы этих простых веществ совпадают с символами элементов.
Существует также группа простых веществ, которые называются благородными газами. К ним относятся: гелий Не, неон Ne, аргон Аr, криптон Kr, ксенон Хе, радон Rn. Эти простые вещества состоят из не связанных друг с другом атомов.
Каждый элемент образует как минимум одно простое вещество. Некоторые элементы могут образовывать не одно, а два или несколько простых веществ. Это явление называется аллотропией.
Аллотропия — это явление образования нескольких простых веществ одним элементом.
Разные простые вещества, которые образуются одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Аллотропные модификации могут отличаться друг от друга составом молекул. Например, элемент кислород образует два простых вещества. Одно из них состоит из двухатомных молекул О2 и имеет такое же название, как и элемент— кислород. Другое простое вещество состоит из трехатомных молекул О3 и имеет собственное название — озон.
Кислород О2 и озон О3 имеют различные физические и химические свойства.
Аллотропные модификации могут представлять собой твердые вещества, которые имеют различное строение кристаллов. Примером являются аллотропные модификации углерода С — алмаз и графит.
Число известных простых веществ (примерно 400) значительно больше, чем число химических элементов, так как многие элементы могут образовывать две или несколько аллотропных модификаций.
Сложные вещества — это вещества, которые состоят из атомов разных элементов.
Примеры сложных веществ: НCl, Н2O, NaCl, СО2, H2SO4 и т. д.
Сложные вещества часто называют химическими соединениями. В химических соединениях свойства простых веществ, из которых образуются эти соединения, не сохраняются. Свойства сложного вещества отличаются от свойств простых веществ, из которых оно образуется.
Например, хлорид натрия NaCl может образоваться из простых веществ — металлического натрия Na и газообразного хлора Сl Физические и химические свойства NaCl отличаются от свойств Na и Cl2.
В природе, как правило, встречаются не чистые вещества, а смеси веществ. В практической деятельности мы также обычно используем смеси веществ. Любая смесь состоит из двух или большего числа веществ, которые называются компонентами смеси.
Например, воздух представляет собой смесь нескольких газообразных веществ: кислорода О2 (21 % по объему), азота N2 (78%), углекислого газа СО2 и др. Смесями являются растворы многих веществ, сплавы некоторых металлов и т. д.
Смеси веществ бывают гомогенными (однородными) и гетерогенными (неоднородными).
Гомогенные смеси — это смеси, в которых между компонентами нет поверхности раздела.
Гомогенными являются смеси газов (в частности, воздух), жидкие растворы (например, раствор сахара в воде).
Гетерогенные смеси — это смеси, в которых компоненты разделяются поверхностью раздела.
К гетерогенным относятся смеси твердых веществ (песок + порошок мела), смеси нерастворимых друг в друге жидкостей (вода + масло), смеси жидкостей и нерастворимых в нем твердых веществ (вода + мел).
Важнейшие отличия смесей от химических соединений:
- В смесях свойства отдельных веществ (компонентов) сохраняются.
- Состав смесей не является постоянным.
Просты́е вещества́ — химические вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, химические элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Аллотропные модификации[править | править код]
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов[2].
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена)[4].
Агрегатное состояние[править | править код]
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
- Ртуть (−39 °C)
- Франций (27 °C)
- Цезий (28 °C)
- Галлий (30 °C)
- Рубидий (39 °C)
Отношение понятий[править | править код]
Понятия «атом», «химический элемент» и «простое вещество» имеют каждый своё индивидуальное смысловое значение. Применение этих понятий возможно только в учебных целях. В научной и практической работе эта информация крайне недостаточна.
В таблице приведена классификация материальных объектов, в части масса-габаритных размеров и их вероятные соответствующие характеристики, см. таблицу ниже[4]:
Широта и правильность применения этих понятий базируется на знании русского языка и предмета Вашего изучения.
См. также[править | править код]
- Сложные вещества
Примечания[править | править код]
- ↑ 1 2 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1987. — Т. 1. — С. 361. — 623 с. — 100 000 экз.
- ↑ 1 2 3 4 Ахметов Н. С. Общая и неорганическая химия. — 4 изд., испр. — М.: Высшая школа, Издательский центр «Академия», 2001. — С. 253-269. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, ISBN 5-7695-0704-7.
- ↑ 1 2 Глинка Н. Л. Общая химия. — 24 изд., испр. — Л.: Химия, 1985. — С. 18-19. — 702 с.
- ↑ 1 2 Врублевский А. И. Химия: базовый школьный курс. — Мн.: Юнипресс, 2009. — С. 11-12. — 576 с. — 3100 экз. — ISBN 978-985-507-813-6.
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — 4 изд., испр. — М.: Высшая школа, Издательский центр «Академия», 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, ISBN 5-7695-0704-7.
- Врублевский А. И. Химия: базовый школьный курс. — Мн.: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6.
Ссылки[править | править код]
- Простые и сложные вещества. Аллотропия



