Какие продукты выделяются на аноде при электролизе

Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
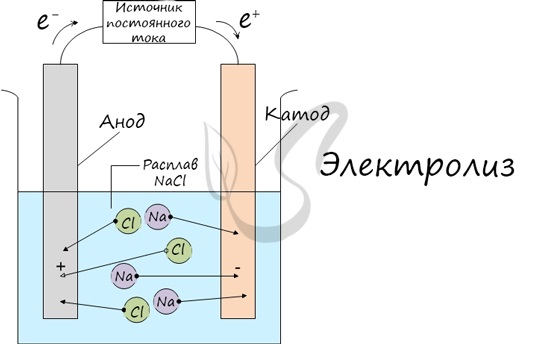
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
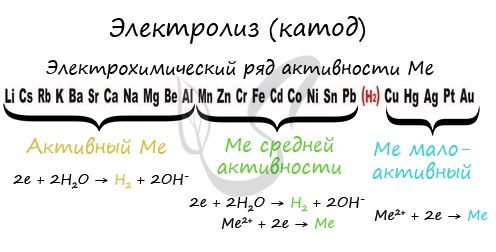
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-,
I-, F-, S2-, CH3COO-.

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
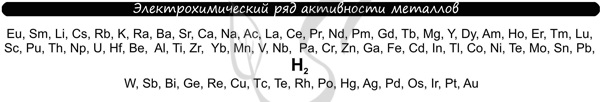
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
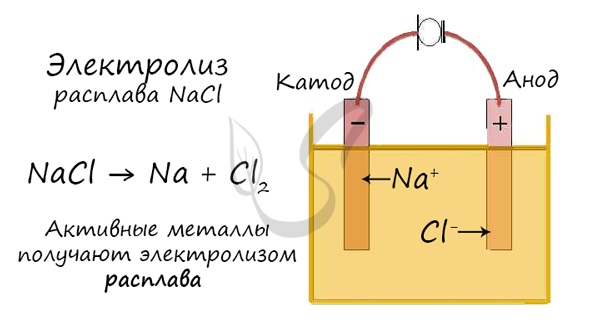
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
12-Окт-2012 | комментариев 59 | Лолита Окольнова
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
Для начала давайте представим себе систему, в которой происходит электролиз.
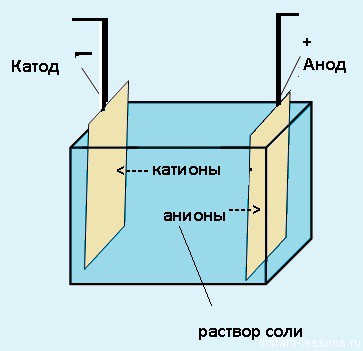
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
Для этого нам понадобится ряд активности металлов электрохимический ряд напряжений:
![]()
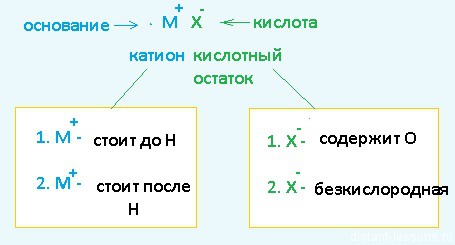
Разберем сначала катионы:
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2е = H2 + 2OH– Образовавшийся водород H2 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:
Cu2+ + 2е = Cu0 Медь осаждается на катоде - Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды:
2Н2О + 2е = Н2 + 2ОН—Zn2+ + 2e = Zn0

Теперь анионы-кислотные остатки:
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H+ Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl− — 1e = Cl20 Хлор выделяется на аноде - Исключение: F− — вместо него будет выделяться кислород.
Примеры:
1.1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
K2SO4↔2K++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
2H2O (электролиз) → 2H2 + O2
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
LiCl ↔ Li+ + Cl−
катод (-): 2H2O + 2e = H2 + 2OH−
анод (+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
2LiCl + 2H2O(электролиз) → H2 + Cl2 +2LiOH
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
СuSO4 ↔ Cu2++SO42−
K(-): Cu2+ + 2e = Cu0
A(+): 2H2O — 4e = O2 + 4Н+
2CuSO4 + 2H2O(электролиз) → 2Cu + 2H2SO4 + O2
2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu2+ + 2e = Cu0
анод (+): 2Cl− — 2e = 2Cl0
CuCl2 (электролиз) →Cu + Cl2

Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
- ЕГЭ это вопрос Части B № 3
Тест «Электролиз»
1. Щелочь образуется при электролизе водного раствора:
хлорида калия
хлорида меди
хлорида цинка
хлорида алюминия
2. При электролизе водного раствора сульфата натрия на катоде и аноде выделяются, соответственно:
натрий и кислород
водород и кислород
водород и оксид серы
натрий и оксид серы
3. Металл выделяется при электролизе водного раствора:
ацетата калия
хлорида цинка
нитрата серебра
гидроксида магния
4. Лакмус становится красным при электролизе раствора:
нитрата серебра
хлорида серебра
нитрата натрия
сульфата натрия
5. При электролизе раствора KF на катоде и аноде выделятся, соответственно:
калий и фтор
калий и кислород
водород и фтор
водород и кислород
6. На катоде — восстановление воды, на аноде — окисление кислотного остатка при электролизе раствора:
Na2S
Na2SO3
NaF
NaNO3
7. Этан можно получить электролизом:
водного раствора метанола
водного раствора ацетата натрия
водного раствора этилата натрия
водного раствора бутанола
8. При электролизе водного раствора KF на аноде выделяется:
фтор
фтороводород
кислород
калий
9. При электролизе 400 г 20 %-ого раствора NaCl на катоде выделилось 11,2 л (н.у.) газа. Степень разложения NaCl:
25%
73%
24%
50%
10. Уравнение анодного процесса электролиза раствора AgNO3 соответствует реакции:
2NO3(-) -2e → 2NO2 + O2
2H2O + 2e → H2 + 2OH(-)
2H2O – 4e → O2 + 4H(+)
2NO3(-) -2e → 2NO + 2O2
Категории:
|
Обсуждение: «Электролиз водных растворов солей»
(Правила комментирования)
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза.
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав соли или ее водный раствор. Источник электрического тока передает электроны в один из электродов и удаляет их с другого. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
 Электролизер
Электролизер
При электролизе расплава NaCl на отрицательном электроде, происходит присоединение электронов ионом натрия Na+ и его восстановление. При этом вблизи электрода концентрация ионов Na+ уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na+. Аналогично происходит миграция ионов Cl— к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2Na+ + 2e— → 2Na0 |
| 2Na+ + 2Cl— → 2Na0 + Cl20 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
 электролизер Даунса
электролизер Даунса
Сложнее протекает электролиз водных растворов электролитов.
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2H2O + 2e— → H20 +2OH— |
| 2H2O + 2Cl— → H20 + Cl20 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu2+, Hg22+, Ag+, Hg2+, Pt2+ до Pt4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li+, Na+ … до Al3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn2+, Zn2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu2+, Ag+, Zn2+ сначала восстановится Ag+ (E = +0,79 В), затем Cu2+ (E = +0,337 В) и только потом Zn2+ (E = +0,76 В).
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизе бескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl— -2e— = Cl2
- При электролизе кислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e— = O2 + 4H+
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO32- + H2O -2e— = SO42- + 2H+
Ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu2+ + 2e— = Cu A: 2Br— -2e— = Br2 |
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 K: 2H2O +2e— = H2 + 2OH— A: 2H2O -4e— = O2 + 4H+ Т.е. происходит разложение воды |
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 K: 2H2O +2e— = H2 + 2OH— A: 2I— -2e— = I2 |
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu2+ + 2e— = Cu A: Cu — 2e— = Cu2+ |
Количественные аспекты электролиза
Связь между количеством вещества, выделившегося при электролизе и количеством прошедшего через него электричества отражена в законах Фарадея.
I закон Фарадея Массы веществ (m), выделившихся на катоде или аноде (или образовавшиеся в катодном и анодном пространстве), пропорциональны количеству прошедшего через раствор или расплав электричества (Q):
m=kQ
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества.
II закон Фарадея Равные количества электричества в процессе электролиза выделяют эквивалентные количества различных веществ. Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея.
m = ЭIt/F = ЭIt/96484,56, где
m – масса вещества,
Э – электрохимический эквивалент,
I – сила тока,
t – время электролиза.
Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом.
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну.
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы. Положительно заряженный электрод (анод) притягивает отрицательно заряженные частицы (анионы). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины, или графита.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) водород, т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH—, среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH—
Например, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Men+ + nē → Me0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
2H+ + 2ē → H20
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H2O-2).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl— – 2ē = Cl20
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение. Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
2H2O-2 – 4ē → O20+ 4H+
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2O-2 – 4ē → O20 + 4H+
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например, электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются молекулы воды:
Анод (+): 2H2O-2 – 4ē → O2 + 4H+
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются хлорид-ионы:
Анод (+): 2Cl– – 2ē → Cl20
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия:
2H+2O +2NaCl– → H20 + 2NaOH + Cl20
Следующий пример: электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2O-2 – 4ē → O20 + 4H+
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H2+O-2 → 2H20 + O20
Еще один пример: электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2Cl– – 2ē → Cl20
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu2+Cl2– → Cu0 + Cl20
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4O-2H– – 4ē → O20 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H2+O-2 → 2H20 + O20
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются анионы хлора:
Анод (+): 2Cl– – 2ē → Cl20
Суммарное уравнение электролиза расплава хлорида натрия:
2Na+Cl– → 2Na0 + Cl20

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются гидроксид-ионы:
Анод (+): 4OH– – 4ē → O20 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4Na+OH– → 4Na0 + O20+ 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al3+ + 3ē → Al0
На аноде окисляются алюминат-ионы:
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O20
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al2О3 = 4Al0 + 3О20

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C0 + О20 = C+4O2-2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются частицы меди из электрода:
Анод (+): Cu – 2ē → Cu2+
