Какие продукты получаются при электролизе расплава cucl2
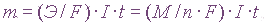
Электролиз расплавов солей
Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей или оксидов:
Электродные процессы могут быть выражены полуреакциями:
на катоде K(-): Сu2+ + 2e = Cu0
— катодное восстановление
на аноде A(+): 2Cl– — 2e = Cl2
— анодное окисление
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением:
Cu2+ + 2 Cl– = Cu + Cl2
При электролизе щелочей и солей оксокислот на аноде выделяется кислород:
4OH– — 4e = 2H2O + O2
2SO42– — 4e = 2SO3 + O2
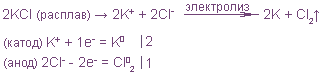
Электролиз растворов
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
На катоде «-»
источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем».
На аноде «+»
происходит отдача электронов анионами, поэтому анод является «окислителем».
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде
— окисление анионов и гидроксид-ионов,
на катоде
— восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются:
на аноде
— окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
на катоде
— восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
а) при электролизе растворов, содержащих в своем составе анионы SO42-, NО-3, РО43-, а также растворов щелочей на аноде окисляется вода и выделяется кислород;
А+ 2H2O — 4e- = 4H+ + O2
б) при окислении анионов Сl-, Вr-, I- выделяются соответственно хлор, бром, иод;
А+ Cl- +e- = Cl0
а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде восстанавливается вода и выделяется водород;
К- 2H2O + 2e- = H2 + 2OH-
б) если ион металла расположен в ряду напряжений правее водорода, то на катоде выделяется металл.
К- Men+ + ne- = Me0
в) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al+ и Н+ , на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода.
Диссоциация нитрата серебра:
АgNО3 = Аg+ + NO3-
При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg+, а на аноде — окисление молекул воды:
Катод: Аg+ + е = А g
Анод: 2Н2О — 4е = 4Н+ + О2
Суммарное уравнение:______________________________________________
4AgNО3 + 2Н2О = 4Ag + 4НNО3 + О2
Составьте схемы электролиза водных растворов: а) сульфата меди; б) хлорида магния; в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
Диссоциация хлорида меди:
CuCl2 ↔ Сu2+ + 2Cl-
В растворе находятся ионы Си2+ и 2Сl-, которые под действием электрического тока направляются к соответствующим электродам:
Катод- Cu2+ + 2e = Cu0
Анод+ 2Cl- — 2e = Cl2
_______________________________
CuCl2 = Cu + Cl2
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl0 и выделения хлора протекает окисление анода (меди).
В этом случае происходит растворение самого анода, и в виде ионов Сu2+ он переходит в раствор.
Электролиз CuCl2 с растворимым анодом можно записать так:
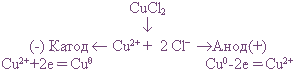
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Диссоциация хлорида магния в водном растворе:
MgCl2 ↔ Mg2++2Сl-
Ионы магния не могут восстанавливаться в водном растворе (идет восстановление воды), хлорид-ионы — окисляются.
Схема электролиза:

В растворе сульфат меди диссоциирует на ионы:
СuSО4 = Сu2+ + SO42-
Ионы меди могут восстанавливаться на катоде в водном растворе.
Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды.
Схема электролиза:
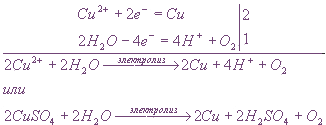
Электролиз водного раствора соли активного металла и кислородсодержащей кислоты (К2SО4) на инертных электродах
К2SО4 = 2К+ + SO42-
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно, на катоде будет протекать восстановление, а на аноде — окисление воды.
Схема электролиза:
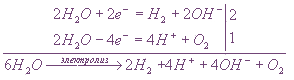
или, учитывая, что 4Н+ + 4ОН- = 4Н2О (осуществляется при перемешивании),
H2O ![]() 2H2 + O2
2H2 + O2
Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются.
На катоде выделяется водород, а на аноде — кислород, и электролиз сводится к электролитическому разложению воды.

Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита — воды):
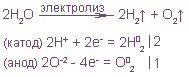
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
![]()
где m
— масса образовавшегося при электролизе вещества (г);
Э
— эквивалентная масса вещества (г/моль);
М
— молярная масса вещества (г/моль);
n
— количество отдаваемых или принимаемых электронов;
I
— сила тока (А);
t
— продолжительность процесса (с);
F
— константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества
(F = 96 500 Кл/моль = 26,8 Ач/моль).
Гидролиз неорганических соединений
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей.
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
1. Соль, образованная сильным основанием и сильной кислотой KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
2. В соли, образованной слабым основанием и сильной кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион:
FeCl2 + HOH → Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- → FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора < 7 ( раствор приобретает кислую реакцию).
3. Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
K2SiO3 + НОH → KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH- → НSiO3- + 2K+ + ОН-
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
4. Соль, образованная слабым основанием и слабой кислотой ( СН3СООNН4, (NН4)2СО3, Al2S3) гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания.
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания: (CH3COONa, KCN, Na2CO3).
Пример 1. Гидролиз ацетата натрия.
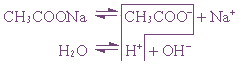
или CH3COO– + Na+ + H2O ↔ CH3COOH + Na+ + OH–
CH3COO– + H2O ↔ CH3COOH + OH–
Так как уксусная кислота слабо диссоциирует, ацетат-ион связывает ион H+, и равновесие диссоциации воды смещается вправо согласно принципу Ле Шателье.
В растворе накапливаются ионы OH- ( pH >7)
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Например, гидролиз карбоната: Na2CO3
I ступень: CO32– + H2O ↔ HCO3– + OH–
II ступень: HCO3– + H2O ↔ H2CO3 + OH–
Na2CO3 + Н2О = NaHCO3 + NaOH
( pH >7)
Практическое значение обычно имеет только процесс, идущий по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей.
Равновесие гидролиза по второй ступени значительно смешено влево по сравнению с равновесием первой ступени, поскольку на первой ступени образуется более слабый электролит (HCO3–), чем на второй (H2CO3)
Пример 2 . Гидролиз ортофосфата рубидия.
1. Определяем тип гидролиза:
Rb3PO4 ↔ 3Rb+ + PO43–
Рубидий – щелочной металл, его гидроксид — сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, — слабая кислота.
Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:
PO3-4+ H–OH ↔ HPO2-4 + OH–.
Продукты — гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Rb3PO4 + H2O ↔ Rb2HPO4 + RbOH.
Получили кислую соль – гидрофосфат рубидия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
2. Гидролиз соли сильной кислоты и слабого основания: NH4NO3, AlCl3, Fe2(SO4)3.
Пример 1. Гидролиз нитрата аммония.
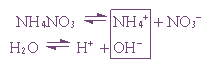
NH4+ + NO3– + H2O ↔ NH4OH + NO3– + H+
NH4+ + H2O ↔ NH4OH + H+
(pH<7)
В случае многозарядного катиона гидролиз протекает ступенчато, например:
I ступень : Cu2+ + HOH ↔ CuOH+ + H+
II ступень : CuOH+ + HOH ↔ Cu(OH)2 + H+
СuСl2 + Н2О = CuOHCl + HCl
( pH <7)
При этом концентрация ионов водорода и pH среды в растворе также определяются главным образом первой ступенью гидролиза.
Пример 2. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза. На этом этапе необходимо написать уравнение диссоциации соли:
CuSO4 ↔ Cu2+ + SO2-4.
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu2+ + H-OH ↔ CuOH+ + H+.
Образуется катион гидроксомеди(II) и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение.
Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два.
Получаем:
2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4.
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль назовем «сульфат гидроксомеди(II)».
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
3. Гидролиз соли слабой кислоты и слабого основания:
Пример 1. Гидролиз ацетата аммония.
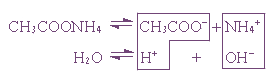
CH3COO– + NH4+ + H2O ↔ CH3COOH + NH4OH
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Если продукты гидролиза могут удаляться из раствора, например, в виде осадка или газообразного вещества, то гидролиз протекает до конца.
Пример 2. Гидролиз сульфида алюминия.
Al2S3 + 6H2O = 2Al(OН)3 + 3H2S
2А l3+ + 3 S2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S (газ)
Пример 3. Гидролиз ацетата алюминия
1. Определяем тип гидролиза:
Al(CH3COO)3 = Al3+ + 3CH3COO–.
Соль образована катионом слабого основания и анионами слабой кислоты.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al3+ + H–OH ↔ AlOH2+ + H+,
CH3COO– + H–OH ↔ CH3COOH + OH–.
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону. Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3 . Составляем молекулярное уравнение:
Al(CH3COO)3 + H2O = AlOH(CH3COO)2 + CH3COOH.
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
4. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O.
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn2+ +2e → Zn0.
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H20 + 2OH–.
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H+ +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F–), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl– – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления.
4OH– – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H+.
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO– – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na+ + Cl–
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2Cl– – 2e → Cl2
Коэффициент 2 перед Na+ появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na+ + 2Cl– + 2H2O → H20 + 2Na+ + 2OH– + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H20 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO42–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H20 + 2OH–
А: 2H2O – 4e → O20 + 4H+.
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H20 + 4OH–
А: 2H2O – 4e → O20 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H20 + 4OH– + 4H+ + O20.
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H20 + 4H2O + O20.
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H20 + O20.
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu2+ + 2e → Cu0
A: 2Cl– – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu2+ + SO42–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu2+ + 2e → Cu0
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu2+ и SO42– 1:1.
К: 2Cu2+ + 4e → 2Cu0
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Записываем суммарное уравнение:
2Cu2+ + 2SO42– + 2H2O → 2Cu0 + O2 + 4H+ + 2SO42–.
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni2+ + 2Cl–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: 2Cl– – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 4Cl– – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 4Cl– + 2H2O → Ni0 + H20 + 2OH– + Ni2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni0 + H20 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni2+ + SO42–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni2+. Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 2SO42– + 2H2O + 2H2O → Ni0 + Ni2+ + 2OH– + H20 + O20 + 2SO42– + 4H+.
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni0 + Ni(OH)2 + H20 + O20 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H+ и OH– с образованием двух молекул воды. Оставшиеся 2H+ расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni2+ + SO42– + 2H2O + 2H2O → Ni0 + 2OH– + H20 + O20 + SO42– + 4H+.
Ni2+ + SO42– + 4H2O → Ni0 + H20 + O20 + SO42– + 2H+ + 2H2O.
Итоговое уравнение:
NiSO4 + 2H2O → Ni0 + H20 + O20 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO– + Na+
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2CH3COO– – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na+ + 2CH3COO– + 2H2O → 2Na+ + 2OH– + H20 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H20 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H+ + SO42–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H+ +2e → H2
A: 2H2O – 4e → O2 + 4H+
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H+ +4e → 2H2
A: 2H2O – 4e → O2 + 4H+
Суммируем левые и правые части уравнений:
4H+ + 2H2O → 2H2 + O2 + 4H+
Катионы H+ находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na+ + OH–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 4OH– – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na+ (в растворе)
4H2O + 4e → 2H20 + 4OH–
А: 4OH– – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH– → 2H20 + 4OH– + O20 + 2H2O
Сокращая 2H2O и ионы OH–, получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
