Какие продукты образуются при каталитическом окислении аммиака
Пример Каталитическое окисление аммиака. Этой реакцией пользуются в производстве азотной кислоты (см. 143). Ее осуществляют при температуре около 750 °С. Схема реакции [c.269]
Газообразные парафиновые углеводороды, как метан, этан, пронан и бутаны, имеются в большом количестве в природных газах, а также в отходящих газах нефтепереработки и установок гидрирования угля азотная кислота может быть просто и в любом количестве получена путем каталитического окисления аммиака. [c.278]
Каталитическое окисление аммиака имеет ряд преимуществ перед другими способами. Состав продуктов окисления, скорость процесса и температура начала окисления зависят от применяемого катализатора. [c.155]
Оксид азота (И) N0 (окись азота) получают в больших количествах в производстве ННОз каталитическим окислением аммиака [c.403]
Промышленное получение азотной кислоты. Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При описании свойств аммиака (см. разд. 17.1.2) было указано, что он горит в кислороде, причем продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение NH3 в N0 [c.441]
Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий [c.215]
I. Первая стадия производства азотной кислоты каталитическое окисление аммиака кислородом [c.129]
Можно провести реакцию каталитического окисления аммиака до оксидов азота и далее при помощи последовательных реакций диспропорционирования и окисления получить азотную, кислоту. [c.545]
Определяющей стадией всего процесса окисления является скорость диффузии кислорода к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, в отличие от окисления на окисном катализаторе, которое идет в кинетической области. [c.215]
Другое важнейшее соединение азота — азотная кислота. В настоящее время ее получают либо в результате каталитического окисления аммиака кислородом воздуха, либо так называемым дуговым способом [c.89]
Время контактирования. Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,97— [c.218]
Скорость каталитического окисления аммиака на платине кислородом воздуха при получении азотной кислоты уменьшается даже при очень малом содержании в газовой смеси фосфористого водорода, сероводорода или ацетилена. Например, выход продуктов реакции окисления аммиака (окислов азота) на платиновом катализаторе при 750° равен 93,8%, если применяются чистый аммиак, чистый воздух, свежий катализатор и т. д. Если в газовой смеси содержится [c.430]
Опыт 241. Получение оксидов азота (И) каталитическим окислением аммиака [c.133]
Каталитическое окисление аммиака. 1. Смочите стенки большой плоскодонной колбы 25 %-м раствором аммиака. Колбу закройте на время пробкой. Наберите в железную ложечку оксид хрома (III), полученный в предыдущем опыте, п сильно прогрейте его в газовом пламени. Откройте колбу и быстро внесите в нее ложечку с оксидом хрома [c.165]
Основную массу азотной кислоты в настоящее время готовят контактным (каталитическим) окислением аммиака, полученного из азота воздуха. Уравнение реакции [c.472]
III), встряхивая ее и рассыпая оксид хрома (III). На раскаленных частичках оксида хрома (III) происходит каталитическое окисление аммиака до оксида азота (I). Вследствие выделения теплоты в этой реакции частички оксида хрома вспыхивают. [c.165]
Возможный механизм каталитического окисления аммиака на платине [c.174]
Опыт 91. Каталитическое окисление аммиака на поверхности оксида хрома [c.59]
Каталитическое окисление аммиака выражается общим уравнением [c.83]
При каталитическом окислении аммиака ЫНз кислородом О2 образуется оксид азота N0 и вода Н2О. Запишем схему процесса с помощью формулы [c.102]
Азотная кислота и ее соли. При описании свойств аммиака в 3 было отмечено, что он горит в кислороде с образованием воды и молекулярного азота. Однако в присутствии специального катализатора окисление аммиака кислородом может протекать с образованием воды и окиси азота. Современные промышленные способы получения азотной кислоты основаны именно па каталитическом окислении аммиака кислородом воздуха. Обычно смесь аммиака с воздухом, нагретую до 1- 700°, пропускают над катализатором (в качестве катализаторов используются сплавы на основе платины) [c.301]
Аммиак. Каталитическое окисление аммиака пад платиновым катализатором даино известно. По однолгу из патентов на получение цианистоводородной кислоты из аммиака, воздуха и метана сначала получается смссь N0, Н2О и воздуха путем каталитического окисления аммиака на платиновом катализаторе, а затем эта смесь реагирует с метаном [26]. Весь процесс каталитического препращения, приблизительно выражаемого уравнением [c.100]
Оксид азота (И) NO в промышленности получают при каталитическом окислении аммиака [c.202]
Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха. Этот метод состоит из нескольких стадий. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800 °С. Аммиак окисляется до оксида азота (II) [c.204]
Производство разбавленной азотной кпслок.г состоит из трех стадий каталитическое окисление аммиака в ОКСИД азота (И) окисление оксида азота (П) в оксид азота (IV) абсорбция оксида азота (IV) водой с образованием кислоты. [c.159]
ЗОг), при синтезе аммиака (конвертор Фаузера — Монтекатини— рис. 1Х-55, в котором вода под давлением 300 ат движется в замкнутом цикле и отдает теплоту воде, кипящей в котле), при каталитическом окислении аммиака до окиси азота (рис. 1Х-56), при сжигании сероводорода по методу Клауса и т. д. Такой способ приводит не только к рациональному использованию тепловой энергии, но в некоторых случаях и к наиболее выгодному для повышения выхода реакции распределению температур (синтез МНз, сгорание [c.402]
Разработка основ технологии производства азотной кислоты каталитическим окислением аммиака немецким физикохими-ком Вильгельмом Оствальдом (1853-1932 гг., лауреат Нобелевской премии 1909 г.). [c.282]
Пример 11. 15, с. 302—307] . Процесс каталитического окисления аммиака происходит в реакторе поверхностного контакта при давлении Р = 0,1 МПа. Определить необходимую высоту слоя катализатора (пакеты сеток из платины) в реакторе для следующих исходных дадных. Состав исходндгд газа [%(об.)] NH3 — [c.128]
Метод обеспечения взрывобезопасности путем такого регулирования состава, при котором концентрация горючего всегда остается меньшей нижнего предела взрываемости, широко используется на практике. Однако, как правило, он реализуется только в отношении допустимого содержания горючего в атмосфере производственного помещения на случай утечек из аппаратов и газапроводов. Значительно реже применяется такая регламентация в отношении технологических смесей, поскольку величина Ящь для этого слишком мала. Помимо процесса окисления этилена до окиси этилена, бедные смеси перерабатываются в технологических процессах лишь при каталитическом окислении аммиака воздухом, для которого Ят1п=15%, обычно перерабзтываются смеси, содержащие 9,5—11,5% NHз. [c.62]
Первые исследования процесса синтеза азотной кислоты из аммиака относятся к началу XIX века. В1800 году А. Фуркруа наблюдал образование оксидов азота при пропускании смеси аммиака с воздухом через раскаленную трубку. В 1839 году Кюльман получил оксиды азота окислением аммиака на платиновом катализаторе, высказав при этом предположение, что могут наступить времена, когда это превращение в экономическом отношении станет возможным . В начале XX века условия окисления аммиака детально изучаются В. Оствальдом и И.И. Андреевым и делаются попытки освоить этот метод в промышленных условиях. В1907 году В. Оствальд создает промышленную опытную установку для получения азотной кислоты каталитическим окислением аммиака. В 1916 году, на основе теоретических исследований И.И. Андреева, создается опытная установка, а в 1917 году был введен в строй первый завод по производству азотной кислоты из аммиака коксового газа мощностью 10 ООО тонн в год в г. Юзовка. [c.211]
Какое К Оличество бертолето-в ой соли потребуется для получе-Н ия кислкаталитического окисления аммиака, образующегося при иагреваиии 500 г 13,2%-Horoi раствора сульфата -аммония и 100 г гашеной извести, содержащей 3,5% примеси карбоната кальция. [c.29]
Оксид азога (11) получают в иро% ьинленности каталитическим окислением аммиака, образуется он также из простых веществ иод действием электрического разряда иль при очень высокой температуре (3000—4000 «С), В лаборатории МО получают действием 30 %Л 0Й азотной кислот л на металлическую медь. Образующиеся ири этом иримсси оксида азота (IV) по -лощают водой, а N0 малорастворим в воде и химически с ицй ие взаи.модействует. [c.161]
Азотная кислота HNO3 относится к наиболее сильным кислотам. В промышленности ее получают преимущественно каталитическим окислением аммиака. [c.133]
Монооксид азота N»0. арак1сризус1ся 1ем, чк/ ек/ ук/.ю-кула содержит один неспаренный электрон и фактически является радикалом нитрозилом известен также катион нитрозила N0 в солях типа (Ы0)Н501. В промышленности N0 получают каталитическим окислением аммиака [c.210]
Получение азотной кислоты осуществляется в настоящее время каталитическим окислением аммиака. Как было выяснено еще в 1900 г., прй быстром пропускании смеси NH3 с избытком воздуха над нагретым до 800 °С плапиновым катализатором по реакции [c.416]
Принципиальная схема установки для каталитического окисления аммиака показана на рис. 1Х-24. Одновременно с приведенной в основном тексте реакцией могут протекать различные побочные процессы (в частности, 4ЫНз + ЗОг = бНгО + + 2N2). Для нх предупреждения время контакта газовой смеси с катализатором должно быть очень малым (порядка 0,0001 сек). Катализатор из сплава платины с 5—10% родия оформляют в виде тонких сеток, сквозь которые и продувается смесь исходных газов. На практике пользуются смесью аммиака с воздухом, содержащей не более 12 объемн.% NHз. Максимальный выход окиси азота составляет около 98% от теоретического. [c.426]
В промышленности азотная кислота получается каталитическим окислением аммиака. Открытие промышленного способа окисления аммиака в азотную кислоту принадлежит ннженеру-химику И. И. Андрееву — основателю азотной промышленности в России. Андреев предложил применять при окислении аммиака кислородом воздуха катализатор — платиновую сетку — и реализовал этот способ сначала на опытной установке в Макеевке (1916), а затем на заводе в Донецке (1917). [c.114]
Технология неорганических веществ и минеральных удобрений (1983) — [
c.140
]
4NH3 + 5O2 = 4NO + 6H2O +Q (3.1)
4NH3 + 3O2 = 2N2 + 6H2O +Q (3.2)
4NH3 + 4O2 = 2N2O + 6H2O +Q (3.3)
Кроме реакций (1-3) в контактном аппарате возможно протекание других побочных реакций, снижающих селективность процесса. Так, например, при повышении времени контактирования больше оптимального, возможна термическая диссоциация аммиака:
2NH3 N2 + 3H2 – Q (3.4)
При повышении линейной скорости аммиачно-воздушной смеси, низкой температуре, отравлении катализатора происходит проскок аммиака, что приводит к образованию элементарного азота:
4NH3 + 6NO = 5N2 + 6H2O +Q (3.5)
Таким образом, процесс окисления аммиака до оксида азота (II) является сложным, т.к. наряду с целевым получаются побочные продукты.
О равновесном состоянии основной реакции (1) можно судить по величине константы равновесия, которая при температуре 9000С равна 1053. Известно, что для обратимых реакций константы равновесия имеют значения в пределах 10-2 – 102. Наиболее вероятные побочные реакции 2-3 также имеют значения констант равновесия намного превышающие величину 102. Поэтому процесс окисления аммиака до оксида азота (II) – необратимый.
Энергетическая характеристика: процесс окисления аммиака до оксида азота (II) имеет отрицательный тепловой эффект, идет с выделением теплоты, т.е. является экзотермическим.
Выбор оптимальных условий проведения процесса.
Катализатор.
Реакция (11.1) в объеме не идет даже при высоких температурах из-за большой величины энергии активации. Для реализации этой реакции необходимы катализаторы, активно адсорбирующие кислород. В промышленности чаще всего применяют платиново-родиевые катализаторы. Окисление аммиака на этих катализаторах протекает очень быстро, время контактирования – 10-4 сек, выход при этом составляет 98%.
Неплатиновые катализаторы, состоящие из оксидов железа и хрома, также дают высокие выходы (около 96%), но скорость реакции уменьшается в 100 раз.
Таким образом, процесс окисления аммиака до оксида азота (II) является гетерогенно-каталитическим, идет во внешнедиффузионной области. Лимитирующая стадия – диффузия аммиака к поверхности катализатора.
Помимо активности, катализатор должен обладать селективностью, так как состав конечных продуктов будет определяться соотношением скоростей реакций 3.1 – 3.3.
Температура.
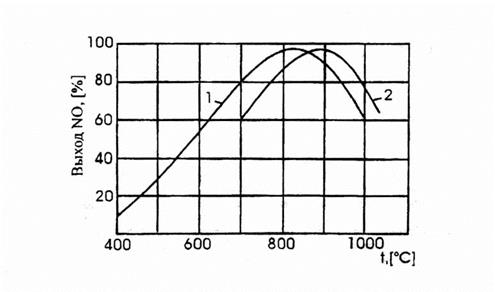
На платиновом катализаторе зависимость выхода NO от температуры имеет максимум, рис. 3.1.
Рис. 3.1. Зависимость практического выхода оксида азота (II) от темепартуры:
1 –при давлении 0,1 МПа, 2 –п 
ри давлении 0,8 МПа.
Такой характер кривой определяется влиянием температуры на возможность протекания побочных реакций.
При низких температурах, примерно до 5000С, когда количество адсорбированного кислорода сравнительно невелико, окисление аммиака протекает в основном с образованием элементарного азота. С повышением температуры до 700-8000С выход NO возрастает, так как увеличивается доля активных центров катализатора, занятых кислородом, и растет скорость диффузии исходных веществ к поверхности катализатора. При дальнейшем повышении температуры происходит десорбция кислорода и резко возрастают скорости побочных реакций.
Давление.
Давление в процессе окисления аммиака связано с температурой. Чем выше давление, тем требуется более высокая температура для достижения одного и того же выхода (рис.11.1.).
Проведение процесса под давлением имеет ряд преимуществ: повышается скорость процесса, увеличивается интенсивность катализатора, значительно возрастает скорость реакции:
NO +0,5O2 =NO2 (3.6.),
которая является лимитирующей в производстве азотной кислоты.
В промышленности процесс окисления аммиака до оксида азота (II) проводят при давлении – 0,8 МПа.
4. Соотношение исходных компонентов.
При стехиометрическом соотношении кислорода к аммиаку равном 1,25 в смеси будет содержаться 14,4 об.% аммиака, что соответствует области взрывоопасных концентраций. Кроме этого, при таком соотношении часть активных центров катализатора не заполняется кислородом, что будет способствовать протеканию побочных реакций с образованием элементарного азота.
Пример производстве азотной кислоты (см. 143). Ее осуществляют при температуре около 750 °С. Схема реакции [c.269]
Газообразные парафиновые углеводороды, как метан, этан, пронан и бутаны, имеются в большом количестве в природных газах, а также в отходящих газах нефтепереработки и установок гидрирования угля азотная кислота может быть просто и в любом количестве получена путем каталитического окисления аммиака. [c.278]
Каталитическое окисление аммиака имеет ряд преимуществ перед другими способами. Состав продуктов окисления, скорость процесса и температура начала окисления зависят от применяемого катализатора. [c.155]
Оксид азота (И) N0 (окись азота) получают в больших количествах в производстве ННОз каталитическим окислением аммиака [c.403]
Технологический процесс производства синильной кислоты методом каталитического окисления метана и аммиака кислородом воздуха состоит из следующих основных стадий [c.77]
Процессы адсорбции широко применяются в промышленности при очистке и осушке газов, очистке и осветлении растворов, разделении смесей газов или паров, в частности при извлечении летучих растворителей из их смеси с воздухом или другими газами (рекуперация летучих растворителей) и т. д. Еще сравнительно недавно адсорбция применялась в основном для осветления растворов и очистки воздуха в противогазах в настоящее время ее используют для очистки аммиака перед контактным окислением, осушки природного газа, выделения и очистки мономеров в производствах синтетического каучука, смол и пластических масс, выделения ароматических углеводородов из коксового газа и для многих других целей. В ряде случаев после адсорбции поглощенные вещества выделяют (десорбируют) из поглотителя. Процессы адсорбции часто сопутствуют гетерогенному катализу, когда исходные реагенты адсорбируются на катализаторе, а продукты реакции десорбируются, например при каталитическом окислении двуокиси серы в трехокись на поверхности платинового катализатора и др. [c.563]
ПРОИЗВОДСТВО СИНИЛЬНОЙ КИСЛОТЫ КАТАЛИТИЧЕСКИМ ОКИСЛЕНИЕМ МЕТАНА И АММИАКА КИСЛОРОДОМ ВОЗДУХА [c.76]
Промышленное получение азотной кислоты. Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При описании свойств аммиака (см. разд. 17.1.2) было указано, что он горит в кислороде, причем продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение NH3 в N0 [c.441]
Акролеин, получаемый каталитическим окислением пропилена в газовой фазе (гл. 9, стр. 161), вскоре станет доступным в промышленности как дешевый исходный продукт для различных химических синтезов. Реакцию акролеина с аммиаком и воздухом можно использовать для производства акрилонитрила [c.383]
Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий [c.215]
Эти закономерности справедливы для всех простых обратимых экзотермических газовых реакций, в частности для промышленных каталитических процессов гидрирования, окисления, гидратации и др. Кривые рис. 98 и 99 типичны для реакций синтеза аммиака, каталитического окисления 502, конверсии оксида углерода, окисления этилена в оксид этилена, синтеза углеводородов гидрированием СО и многих других процессов. [c.230]
Этот способ получения азотной кислоты начал широко применяться в промышленности со времени первой мировой войны 1914—1918 гг. В настоящее время подавляющая часть азотной кислоты получается окислением аммиака. Каталитическое окисление аммиака — это современный способ производства азотной кислоты. [c.172]
Положительное влияние температуры на течение обратимых экзотермических реакций ограничено снижением выхода при повышении температуры выше оптимальной. Это противоречие между скоростью и равновесием, ограничивающее применение высоких телшератур, характерно для промышленных процессов, синтеза аммиака, каталитического окисления ЗОо, конверсии окиси углерода, пря.мой гидратации олефинов и т. п. [c.199]
И Т зз. Приведенные кривые (см, рис. 34 и 35) типичны для реакций синтеза аммиака, каталитического окисления SO2, конверсии окиси углерода, синтеза углеводородов и др. [c.125]
I. Первая стадия производства азотной кислоты каталитическое окисление аммиака кислородом [c.129]
Определяющей стадией всего процесса окисления является скорость диффузии кислорода к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, в отличие от окисления на окисном катализаторе, которое идет в кинетической области. [c.215]
Газовые реакции на твердом катализаторе распространены в химической промышленности. В частности, производство азотных удобрений было бы невозможным без каталитических реакций конверсии метана и моноксида углерода, синтеза аммиака и окисления его до моноксида азота. Серную кислоту, необходимую для производства фосфорных удобрений, в настоящее время получают почти исключительно контактным способом, основанным на каталитическом окислении сернистого ангидрида в серный. Примеры таких процессов в нефтехимических и органических производствах — каталитический крекинг и риформинг нефтепродуктов, а также синтез метанола и других спиртов и углеводородов. Реакторы для таких процессов обычно называют контактными аппаратами или колоннами синтеза. [c.285]
Можно провести реакцию каталитического окисления аммиака до оксидов азота и далее при помощи последовательных реакций диспропорционирования и окисления получить азотную, кислоту. [c.545]
Парофазное каталитическое окисление пропилена в присутствии аммиака или этилена и синильной кислоты приводит непосредственно к акрилонитрилу [c.284]
Другое важнейшее соединение азота — азотная кислота. В настоящее время ее получают либо в результате каталитического окисления аммиака кислородом воздуха, либо так называемым дуговым способом [c.89]
Время контактирования. Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,97— [c.218]
Скорость каталитического окисления аммиака на платине кислородом воздуха при получении азотной кислоты уменьшается даже при очень малом содержании в газовой смеси фосфористого водорода, сероводорода или ацетилена. Например, выход продуктов реакции окисления аммиака (окислов азота) на платиновом катализаторе при 750° равен 93,8%, если применяются чистый аммиак, чистый воздух, свежий катализатор и т. д. Если в газовой смеси содержится [c.430]
Отличительная особенность палладия — способность поглощать значительные количества водорода. Так, 1 объем Рд при 80Х может поглотить до 900 объемов Нг- Палладий и никель — хорошие катализаторы гидрирования, восстановления водородом. В присутствии Рс1 водород (даже на холоду и в темноте) легко восстанавливает галогены, переводит 50, в Н,8, СЮ в С1, и т. д. Для платины наиболее характерно поглощение кислорода. Большое значение платина имеет как катализатор окисления кислородом аммиака (в производстве ННОз), водорода (для очистки О, от примеси И,) и в других процессах каталитического окисления. [c.646]
Аммиак. Каталитическое окисление аммиака пад платиновым катализатором даино известно. По однолгу из патентов на получение цианистоводородной кислоты из аммиака, воздуха и метана сначала получается смссь N0, Н2О и воздуха путем каталитического окисления аммиака на платиновом катализаторе, а затем эта смесь реагирует с метаном [26]. Весь процесс каталитического препращения, приблизительно выражаемого уравнением [c.100]
Каталитическое окисление аммиака. 1. Смочите стенки большой плоскодонной колбы 25 %-м раствором аммиака. Колбу закройте на время пробкой. Наберите в железную ложечку оксид хрома (III), полученный в предыдущем опыте, п сильно прогрейте его в газовом пламени. Откройте колбу и быстро внесите в нее ложечку с оксидом хрома [c.165]
III), встряхивая ее и рассыпая оксид хрома (III). На раскаленных частичках оксида хрома (III) происходит каталитическое окисление аммиака до оксида азота (I). Вследствие выделения теплоты в этой реакции частички оксида хрома вспыхивают. [c.165]
Ранее было указано, что благотворное влияние температуры на течение обратимых экзотермических реакций ограничено снижением не только равновесного, но и действительного выхода при повыщенни температуры выще оптимальной. Это противоречие лежду скоростью и равновесием, ограничивающее применение высоких температур, характерно для промышленных процессов синтеза аммиака, каталитического окисления ЗОг, конверсии окиси углерода, синтеза метанола, прямой гидратации олефинов и т. д. [c.145]
Азотная кислота НКЮз и ее соли принадлежат к наиболее важным кислородным соединениям азота. НЫОд в настояшее врелш получают превращением атмосферного азота в аммиак, каталитическим окислением аммиака до N0 и поглощением N0 водой в присутствии кислорода. [c.185]
Акрилонитрил в процессе Sohio получается каталитическим окислением пропилена на катализаторе фосфоромолибдате висмута в присутствии аммиака [c.119]
Производство разбавленной азотной кпслок.г состоит из трех стадий каталитическое окисление аммиака в ОКСИД азота (И) окисление оксида азота (П) в оксид азота (IV) абсорбция оксида азота (IV) водой с образованием кислоты. [c.159]
ЗОг), при синтезе аммиака (конвертор Фаузера — Монтекатини— рис. 1Х-55, в котором вода под давлением 300 ат движется в замкнутом цикле и отдает теплоту воде, кипящей в котле), при каталитическом окислении аммиака до окиси азота (рис. 1Х-56), при сжигании сероводорода по методу Клауса и т. д. Такой способ приводит не только к рациональному использованию тепловой энергии, но в некоторых случаях и к наиболее выгодному для повышения выхода реакции распределению температур (синтез МНз, сгорание [c.402]
Разработка основ технологии производства азотной кислоты каталитическим окислением аммиака немецким физикохими-ком Вильгельмом Оствальдом (1853-1932 гг., лауреат Нобелевской премии 1909 г.). [c.282]
Пример 11. 15, с. 302—307] . Процесс каталитического окисления аммиака происходит в реакторе поверхностного контакта при давлении Р = 0,1 МПа. Определить необходимую высоту слоя катализатора (пакеты сеток из платины) в реакторе для следующих исходных дадных. Состав исходндгд газа [%(об.)] NH3 — [c.128]
Метод обеспечения взрывобезопасности путем такого регулирования состава, при котором концентрация горючего всегда остается меньшей нижнего предела взрываемости, широко используется на практике. Однако, как правило, он реализуется только в отношении допустимого содержания горючего в атмосфере производственного помещения на случай утечек из аппаратов и газапроводов. Значительно реже применяется такая регламентация в отношении технологических смесей, поскольку величина Ящь для этого слишком мала. Помимо процесса окисления этилена до окиси этилена, бедные смеси перерабатываются в технологических процессах лишь при каталитическом окислении аммиака воздухом, для которого Ят1п=15%, обычно перерабзтываются смеси, содержащие 9,5—11,5% NHз. [c.62]
Первые исследования процесса синтеза азотной кислоты из аммиака относятся к началу XIX века. В1800 году А. Фуркруа наблюдал образование оксидов азота при пропускании смеси аммиака с воздухом через раскаленную трубку. В 1839 году Кюльман получил оксиды азота окислением аммиака на платиновом катализаторе, высказав при этом предположение, что могут наступить времена, когда это превращение в экономическом отношении станет возможным . В начале XX века условия окисления аммиака детально изучаются В. Оствальдом и И.И. Андреевым и делаются попытки освоить этот метод в промышленных условиях. В1907 году В. Оствальд создает промышленную опытную установку для получения азотной кислоты каталитическим окислением аммиака. В 1916 году, на основе теоретических исследований И.И. Андреева, создается опытная установка, а в 1917 году был введен в строй первый завод по производству азотной кислоты из аммиака коксового газа мощностью 10 ООО тонн в год в г. Юзовка. [c.211]
Сочетая способы каталитического окисления и физической адсорбции, на угле можно осуществить тонкую очистку газа от всех сернистых соединений. Недостатком угольной адсорбции есть вдкличность процесса и сложность технологической схемы. При большой мощности современных установок синтеза аммиака и метанола оборудование узла сероочистки становится очень громоздким. Все это делает проблема-, тичным развитие этого способа, хотя в настоящее время он имеет широкое распространение в ряде стран. [c.88]
Альтернативный вариант каталитического окисления, находящийся за завершающейся стадии разработки, предложен Киюрой [443, 444] из Технологического института г. Токио — процесс Киюра ТИТ (рис. 111-58). В этом процессе используется аммиак, смешанный с окисленным ЗОг в газовом потоке, причем образуется сульфат аммония. Воздушный подогреватель сконструирован в виде двухступенчатого аппарата, и инжекция аммиака происходит в смесителе Вентури между этими ступенями. [c.194]
Работа посвящена экспериментальному исследованию адсорбционных и каталитических свойств углеродньге материалов и нанесенных на углерод катализаторов в процессах каталитического окисления веществ различной природы в водной фазе кислородом при повыщенных температурах и давлениях. Использованы как модельные растворы (хлор-, и азотсодержащие соединения), так и реальные стоки нефтехимических производств (- сернистые соединения), коксохимии (- аммиак, сернистые соединения), сточные воды щоколадной фабрики, спиртовых производств (- кислородсодержащие соединения), и другие. Исходные концентрации загрязняющих примесей были от 0.1 до 60 г/л, pH = 6.0 14. [c.87]
Какое К Оличество бертолето-в ой соли потребуется для получе-Н ия кислгашеной извести, содержащей 3,5% примеси карбоната кальция. [c.29]
Оксид азога (11) получают в иро% ьинленности каталитическим окислением аммиака, образуется он также из простых веществ иод действием электрического разряда иль при очень высокой температуре (3000—4000 «С), В лаборатории МО получают действием 30 %Л 0Й азотной кислот л на металлическую медь. Образующиеся ири этом иримсси оксида азота (IV) по -лощают водой, а N0 малорастворим в воде и химически с ицй ие взаи.модействует. [c.161]
Пособие по химии для поступающих в вузы 1972 (1972) — [
c.240
]
