Какие продукты образуются при хлорировании метана
Насыщенные углеводороды активно вступают в реакцию с хлором. Хлорируют алканы атомами или катионами хлора, которые более реакционноспособны, чем молекулярный хлор. Диссоциация молекулы хлора на атомы требует затраты 242,8 кДж/моль энергии. Такая диссоциация хлора легко происходит при обычной температуре под действием УФ-света, поглощение которого молекулой придает ей 293,0 кДж/моль энергии. Для термической диссоциации молекулы хлора на атомы необходима температура около $300^circ C$ . Диссоциация молекулы хлора на ионы требует затраты 1130,2 кДж / моль. Из приведенных энергетических данных видно, что насыщенные углеводороды легче хлорировать на свете.
Хлорирование алканов происходит с выделением 108,8 кДж / моль теплоты и является менее экзотермическим процессом, чем фторирование. Фотохимическое хлорирование алканов проводят при рассеянном свете, поскольку при прямом освещении реакция происходит со взрывом. При хлорировании атомы водорода алканов постепенно замещаются на хлор. В результате образуются хлоропохидни насыщенных углеводородов.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Итак, если смесь метана с хлором нагреть до $200^circ C$ или воздействовать на неё УФ-светом подходящей длины волны, протекает сильно экзотермическая реакция:
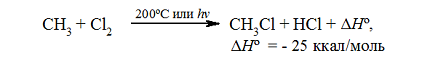
Рисунок 1. Хлорирование метана
Тепловой эффект первой стадии хлорирования метана в газовой фазе до $CH_3Cl$ и $HCl$ может быть рассчитан на основании закона Гесса.
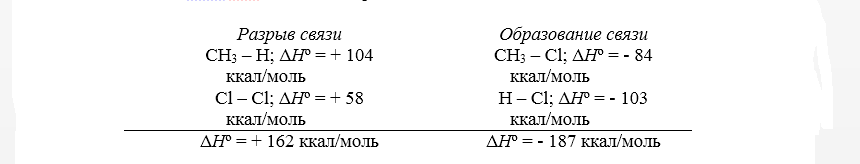
Рисунок 2. Хлорирование метана
Замечание 1
Суммарный тепловой эффект $Delta underline{H}^circ = — 25$ ккал/моль. Эти данные показывают, что хлорирование метана представляет собой вполне вероятный процесс, хотя тепловой эффект никоим образом не связан со скоростью реакции, которая определяется свободной энергией активации.
Радикальный механизм хлорирования метана
Хлорирование алканов при нагревании, облучении и в присутствии радикалообразующих инициаторов происходит радикально-цепным механизмом $SR$ (Семенов) и состоит из трех основных стадий:
зарождение цепи (инициирование)
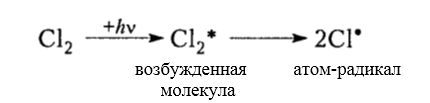
Рисунок 3. Хлорирование метана
рост цепи
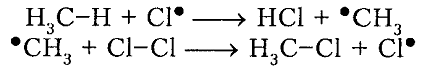
Рисунок 4. Хлорирование метана
обрыв цепи (рекомбинация)
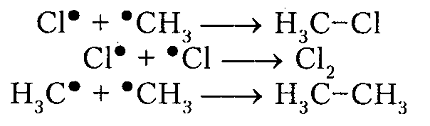
Рисунок 5. Хлорирование метана
Итак, молекула хлора $Cl_2$ под действием света ($h nu $) или при нагревании получает избыток энергии, становится возбужденной и распадается на два атома, которые по своей природе являются радикалами. Атом-радикал хлора в процессе столкновений или взаимодействия с другими молекулами отщепляет атом водорода от молекулы метана $CH_4$ с образованием метильного радикала $^*CH_3$. Метательный радикал, в свою очередь, отщепляет атом хлора от следующей молекулы $Cl_2$ и т.д. Таким образом, один образованный радикал инициирует много повторений стадии роста цепи. Количество таких повторений определяет длину кинетического цепи всей реакции, для хлорирования может достигать $10 000$ и более.
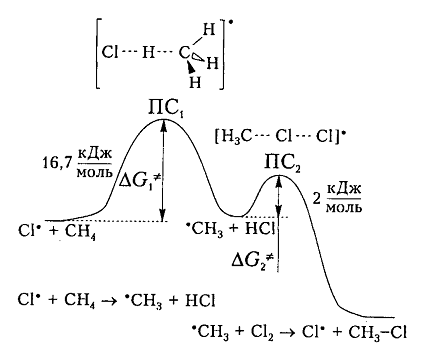
На рис. 6 показана энергетическая диаграмма хлорирования метана.

Рисунок 6. Диаграмма изменения свободной энтальпии для взаимодействия атома хлора и молекулы метана
Закономерности радикального хлорирования метана
Исходя из общетеоретических соображений атом хлора и молекула метана будут взаимодействовать между собой только тогда, когда их свободная энтальпия будет равна величине энергетического барьера (и энергии активации) 16,7 кДж / моль, которая всегда немного больше, чем просто разница (-6 кДж / моль) энергий разрыва старой связи $C-H$ (+425 кДж / моль) и образования новой связи — связи $H-Cl$ (-431 кДж / моль). Поэтому не каждое столкновение реагирующих частиц вызывает их взаимодействие, а только те, которые достаточны для преодоления этого барьера.
Дополнительная энергия активации возникает благодаря облучению или нагреву молекул. Возбужденые молекулы проявляют достаточно высокие скорости движения, кинетическая энергия которого и превращается в потенциальную энергию при столкновениях. На вершине кривой в переходном состоянии $ПС_1$ между реагирующими компонентами образуется активированный комплекс, в котором разрыв старого связи $C-H$ и формирования новой ${rm H}-Cl$ происходят примерно одновременно. Образованный метательный радикал имеет достаточную потенциальную энергию и относительно легко взаимодействует с последующей молекулой $Cl_2$. Энергия активации этой стадии составляет всего 2 кДж / моль. Формирование конечного соединения $CH_3Cl$ проходит через стадию второго активированного комплекса с переходным состоянием $ПС_2.$
Хлорирование метана и других алканов при таких температурах — плохоуправляемый процесс, который обычно не останавливается на стадии образования хлористого метила $CH_3C1$ и может происходить дальше:
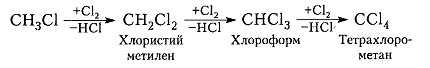
Рисунок 7. Хлорирование метана
Ионный механизм хлорирования метана
В присутствии катализаторов (кислот Льюиса $A1C1_3$, $SbF_5$), способствующих ионному механизму реакции, процесс хлорирования в кислой среде имеет электрофильный характер ($Sе$). Химизм взаимодействия електроноакцепторного хлорида алюминия с молекулой хлора заключается в значительной поляризации неполярной связи $C-C$, что вызывает её диссоциацию с образованием электрофильного агента. Без таких катализаторов реакция хлорирования по ионному механизму почти не происходит, поскольку гетеролитических расщепления молекулы хлора на катион и анион требует значительной энергии (1130 кДж / моль).
Хлорирование насыщенных углеводородов при наличии катализаторов, происходит цепным ионным електрофильным механизмом ($Se$):
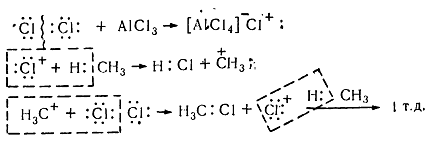
Рисунок 8. Хлорирование метана
Молекула хлора при воздействии катализатора распадается гетеролически с образованием комплексной ионной пары $[A1Cl_4]-Cl+$, поскольку алюминий соединен с электроотрицательными атомами хлора и имеет потребность в электронах. В связи с этим он отщепляет от молекулы $Cl_2$ атом хлора с парой электронов. При этом одновременно образуется катион хлора, который затем взаимодействует с молекулой метана и гетеролитично разрывает связь $C-H$. Такое взаимодействие приводит к образованию метильного карбкатиона. Последний дальше вступает в реакцию с молекулой хлора и образует хлористый метил и катион хлора, реагирует с другой молекулой метана. Такие ионные реакции, в которых промежуточными частицами являются положительно заряженные ионы, называют электрофильными.
Хлорирование насыщенных углеводородов при наличии катализаторов проводят при нагревании реакционной смеси, поскольку диссоциация молекулы хлора на ионы требует значительной затраты энергии.
Рис.. х-33. Продукты хлорирования метана. [c.553]
Переработка продуктов хлорирования сильно усложняется тем, что оно идет с большим избытком углеводорода. Если целью процесса в первую очередь является получение высших продуктов хлорирования метана, то хлористый метил и хлористый метилен могут быть возвращены в процесс. Если хотят получить хлористый метилен, то на повторное хлорирование возвращают в первую очередь хлористый метил. [c.114]
Прямое хлорирование метана в настоящее время применяют главным образом для производства хлористого метилена, широко используемого в качестве растворителя. При этом процессе неизбежно образуются и другие продукты хлорирования метана. Обычно хлорирование ведут так, чтобы в качестве побочного продукта образовался в основном хлористый метил. [c.206]
Кинетика реакции хлорирования метана и его хлорпроизводных в кипящем слое катализатора — активированного угля при 375°С. Использовав экспериментальное распределение продуктов хлорирования метана и его хлорпроизводных во взвешенном слое катализатора — активированного угля [17]—в совокупности с решением системы дифференциальных З равнений скоростей бимолекулярной последовательной необратимой реакции, протекающей в четыре ступени (8), мы Получаем следующее соотношение между константами скорости рассматриваемой реакции [c.29]
В настоящее время не удалось установить такие условия, которые позволили бы получать только один из продуктов хлорирования метана. Состав продуктов хлорирования в большей степени зависит от соотношения реагентов и температуры, чем от катализаторов. [c.268]
Хлорирование метана протекает с большой скоростью. При температуре 400—450° в зависимости от отношения хлора к метану время контакта составляет 5—10 сек. При изучении кинетики реакции термического хлорирования метана Пиз и Вольц [6] установили, что первым продуктом хлорирования метана является хлористый метил. Скорость хлорирования хлористого метила оказалась выше скорости хлорирования метана. [c.370]
Поток, выходящий из реактора 41 по линии 50, подают в отделение сепарации и выделения 51, рециркулируемые компоненты выделяются и возвращаются в реактор 41 по линии 46. Продукты хлорирования метана выводятся из зоны разделения 51 по линии 52. [c.192]
Реакции хлорирования относятся к числу важнейших проц ессов нефтехимической нромышленности. Парафины и особенно олефины легко реагируют с хлором, давая в результате продукты, являюш иеся важнейшими промежуточными и конечными продуктами современной промышленности алифатической химии. Значение продуктов хлорирования метана, этана, этилена, нропена, пентана, а также высокомолекулярных парафиновых углеводородов, получаемых из парафинистых нефтяных фракций или синтезом Фишера-Тропша, в настояш ее время очень велико. [c.112]
Рассмотрим кинетику процесса хлорирования метана и его хлорпроизводных в кипящем слое катализатора—-кварцевого песка при температуре 350 С. Использование распределения продуктов хлорирования метана в кварцевом песке дает такое соотноше-ние между константами скоростей рассматриваемой реакции ki k2 ki = I , 4 0,8 0,5. [c.26]
Таким образом, константа скорости второй реакции образования метиленхлорида почти в 1,,5 раза больше константы скорости реакции образования хлористого метила, а константа скорости образования хлороформа составляет 0,57 константы скорости второй реакции. Константа скорости образования четыреххлористого углерода, в свою очередь, составляет 0,625 константы скорости третьей реакции образования хлороформа. С помощью этих данных мы получаем аналитическое выражение для распределения продуктов хлорирования метана и его хлорпроизвод-ных в кипящем слое катализатора — кварцевого песка [c.27]
Аналитическое выражение распределения продуктов хлорирования метана в зависимости от времени пребывания и степени превращения в реакторе объемного хлорирования имеет вид [c.32]
Продукт хлорирования метана [c.454]
Охлажденные в холодильниках продукты хлорирования метана подвергают осушке сначала в системе прямоточных циклонов 6 от них отделяют капли воды, а затем в абсорберах типа трубы Вентури 7 обрабатывают концентрированным раствором серной кислоты. [c.19]
Промышленный способ хлорирования метана, как он был применен впервые Хохстер Фарбеверкен, состоит в том, что метан и хлор в соотношении 5 1 смешиваются и подаются в стальную, облицованную бетоном трубу, обогреваемую газом [7] (рис. 57). При этом образуются одновременно все продукты хлорирования метана и от молярного соотношения зависит, какие продукты хлорирования будут преобладать. Образование отдельных продуктов хлорирования метана в зависимости от молярного соотношения хлора к метану представлено данными табл. 59. [c.114]
Хлорнроизводпые метана. Продукты хлорирования метана являются прежде всего растворителями. Хлористый метил часто применяется так жо, как метилирующий агент (метилцеллюлоза и др.). На рис. 61 показаны возможные направления псиользовапия хлористого метила. [c.118]
В настоящее время, если ограничиться лишь немногими примерами, продукты хлорирования метана играют важную роль в качестве растворителей, хлористый этил — как исходный продукт для производства тетраэтилсвинца, 1,3-дихлорпропан — для производства циклопропана, применяемого как анестезирующее вещество, и хлористый амил — в качестве исходного продукта для производства амилового спирта и амилфенолов последние находят широкое применение в лакокрасочной промышленности. [c.136]
Четыреххлористый углерод можно получить и из метана путем его хлорирования или из хлорированных метанов, образующихся при хлорировании метана. Первая промышленная установка для хлорирования метана, пущенная в 1923 г. фирмой Farbwerke Hoe hst, давала четыреххлористый углерод наряду с метилхлоридом, метилен-хлоридом (главным продуктом) и хлороформом в различных соотношениях. Чтобы добиться полного хлорирования до четыреххлористого углерода, хлораторы соединили каскадом, а хлор и продукты хлорирования метана направили противотоком. [c.203]
Составьге схему взаимодействия хлора с метаном. Объясните механизм (Зг,) этой реакции. Где используются продукты хлорирования метана [c.14]
Хлорирование метана протекает обычно с образованием всех его хлорпроизводных — хлористого метила, метиленхлорида, хлороформа и четыреххлористого углерода. Регулируя отношение хлора к метану, можно обеспечить преимущественное получение одного из продуктов хлорирования метана, как это показано на рис. 1.1, построенном автором по литературным данным [41, 42] значение тепла реакции в соответствии с составом метанхлоридов, образующихся при хлорировании 1 моля метана, нанесено на график по расчетным данным автора. Получению метанхлоридов хлорированием метана посвящено значительное количество работ и патентов, рассмотренных Эллисом [43], Сукневичем [44], Солодарем [24]. [c.370]
На рис. 1Х-13 приведена схема такой комплексной локальной установки для очистки сточных вод производства хлорме-танов, осуществленная на одном из предприятий хлорной промышленности. Сточные воды, содержап1ие смесь хлороформа, метилепхлорида, четыреххлористого углерода и других продуктов хлорирования метана (700—1400 г/м в пересчете на органический хлор) предварительно подаются в двухсекционный отстойник 1 для осаждения взвешенных веществ. Из отстойника сточная вода направляется на двухслойный фильтр 2, загруженный песком и антрацитовой крошкой (или гранулами активного угля АГ-3). Осветленная вода, прошедшая фильтры, направляется через теплообменник 3 в отпарную колонку 4, заполненную кольцами Рашига. В теплообменнике сточная вода нагревается за счет тепла, отдаваемого водой, выходящей нз отпарной колонны. Кубовая жидкость в отпарнон колонне нагревается до 95°С паром, который подается в кипятильник 5. [c.269]
Большое значение приобрело производство хлорсодержащих полимерных продуктов, в частности поливинилхлоридных смол и хлоропренового каучука, а также хлорсодержащих растворителей (дихлорэтана, перхлоруглеродов, трихлорэтилена и продуктов хлорирования метана — четыреххлористого углерода, хлороформА, хлористого метилена и хлористого метила). Значительная масса хлора расходуется на получение хлорпроизводных бензола, многочислен-JiHx средств защиты растений от вредителей и болезней и других хлорпродуктов. [c.9]
Хлориды углеводородов широко используются в народном хозяйстве. Продукты хлорирования метана являются прежде всего растворителями. Кроме того, хлористый метил часто применяется в качестве метилирующего агента при производстве ме-тилцеллюлозы. Хлористый метил -используется как хладагент для холодильных машин и растворитель при получении бутил-каучука. [c.251]
Имеется ряд работ [15—17], в которых в результате экспериментальных разработок получены кривые распределения продуктов реакции. В некоторых работах ([16—17]) дается довольно сложный метод определения констант скоростей выде Ляется предпоследний продукт хлорирования метана — хлороформ, затем при хлорировании последнего находится константа скорости этой уже простой реакции. [c.26]
При получении хлороформа как целевого продукта хлорирование метана широкого применения не имеет. Это связано с трудностями регулирования высокоэкзотермического процесса и отвода тепла. Новые процессы получения высших хлоридов метана разрабатываются на основе фотохимического хлорирования метиленхлорида [c.366]
Отдельные представители. Наибольшее значение имеют в технике продукты хлорирования метана и этана, а также фторхлориды. [c.103]
Галогенирование. Из галогенов наиболее широко используется хлор вследствие дешевизны и достаточной химической активности. При взаимодействии метана с хлором на свету атомы водорода постепенно замещаются хлором. Как было установлено экспериментальными исследованиями, реакция протекает по радикальному цепному механизму. Молекулярный хлор под влиянием света расщепляется на атомный, который иницирует (начинает) радикальную реакцию он отщепляет водород от метана, образуя радикал метил и хлористый водород. Метильный радикал взаимодействует с молекулярным хлором и стабилизируется в первый продукт хлорирования метана — хлористый метил, который по аналогичной схеме подвергается дальнейшему хлорированию, образуя последовательно хлористый метилен, хлоро рм и тетрахлорметан (четыреххлористый углерод) [c.41]
Наибольшее значение имеют в технике продукты хлорирования метана и этана, а также фторхлориды. [c.114]
УРОК №4 ПО
ТЕМЕ «СПОСОБЫ ПОЛУЧЕНИЯ,
ХИМИЧЕСКИЕ СВОЙСТВА И
ПРИМЕНЕНИЕ АЛКАНОВ».
Изучив материал,
нужно будет:
1.Знать:
—
Способы получения алканов.
—
Химические свойства алканов.
—
Применение алканов.
2.Уметь:
—
Грамотно записывать уравнения
реакций получения алканов.
—
Грамотно записывать уравнения
реакций, отражающих химические
свойства алканов.
—
Знать именные реакции,
названные в честь
учёного, который впервые
их осуществил.
—
Знать сферы использования
алканов их производных.
ХОД ЛЕКЦИИ:
1.Основные
способы получения алканов.
А) Получение
алканов на основе
синтез – газа (смесь оксида
углерода (II) и
водорода).
200oc
nCO + (2n+1)H2 → CnH2n+2 + nH2O
кат. Ni
Образующаяся в данной реакции смесь алканов
называется «синтином» (синтетический бензин).
Б) Гидрирование
непредельных углеводородов (алкенов
или алкинов).
t t
C2H4 + H2 → C2H6 С2H2 + 2H2→ C2H6
этен кат. Pt этан этин кат. Pt этан
В) Взаимодействие однородных
галогенпроизводных
предельных углеводородов с
металлическим натрием (реакция
Вюрца, впервые осуществлена
в 1855 году
французским химиком Шарлем
Адольфом Вюрцем).
t
CH3 – I + 2Na + I – C2H5→ CH3 – C2H5 + 2NaI
йодистый метил йодистый этил пропан
С помощью
реакции Вюрца можно получить и алканы разветвленного строения:
(CH3 )2– CH2–
I + 2Na + I – CH3→ CH3 – CH – CH2 – CH3
+ 2NaI
CH3
изобутил
иодид метил иодид 2-метил бутан
Г) Восстановление производных
алканов (галогеналкилов, спиртов,
кетонов и др.)
йодоводородной кислотой при нагревании.
t t
C2H5 – I + HI → C2H6 + I2 C2H5 – OH + 2HI → C2H6 + H2O + I2
этанол
Д) Сплавление солей
карбоновых кислот со
щелочами (лабораторное получение
алканов).
t
CH3 – COONa + NaOH →CH4 ↑+ Na2CO3
ацетат натрия
2.Основные
химические свойства алканов.
А) Взаимодействие с галогенами (в результате
данной реакции атомы водорода в алканах замещаются на галогены – реакция
металепсии, условие реакции — свет).
Взаимодействие метана с хлором протекает
последовательно и может быть представлено следующими четырьмя реакциями:
CH4
+ Cl2→ CH3Cl + HCl; CH3Cl
+ Cl2 → CH2Cl2 + HCl;
монохлорметан
дихлорметан
CH2Cl2
+ Cl2→CHCl3 + HCl; CHCl3
+ Cl2→ CCl4 + HCl
трихлорметан тетрахлорметан
Полное хлорирование метана (исчерпывающее) может
быть представлено следующим уравнением:
CH4
+ 4Cl2→ CCl4 + 4HCl
тетрахлорметан
(четыреххлористый углерод)
Или
полное хлорирование алканов в общем виде можно выразить уравнением: CnH2n+2 + (2n+2)Cl2 → CnCl 2n+2 + (2n+2)НCl
Реакции взаимодействия алканов с
галогенами протекают на свету (фотохимическое галогенирование) или при
нагревании (термическое галогенирование метана протекает при 300оС).
Такие реакции протекают по свободнорадикальному механизму. Механизм реакции
хлорирования метана на свету представлен ниже:
На
первой стадии этого процесса происходит распад молекулы хлора на два свободных
радикала – зарождение, или инициирование, цепи:
hv
Cl : Cl → 2Cl ·
Затем начинается рост цепи, связанный с
взаимодействием свободного радикала с молекулой алкана:
CH4
+ Cl · → CH3· +
HCl; CH3· + Cl2→ CH3Cl
+ Cl ·
·
CH3Cl +
Cl · → CH2Cl + HCl
·
CH2Cl +
Cl2→ CH2Cl2 + Cl ·
·
CH2Cl2
+ Cl · → CHCl2 + HCl
·
CHCl2 +
Cl2→ CHCl3 + Cl ·
·
CHCl3 +
Cl · → CCl3 + HCl
·
CCl3 + Cl2 → CCl4
+ Cl ·
Реакция заканчивается обрывом
цепи, который наступает в результате взаимодействия между собой свободных
радикалов:
2CH3· → CH3 – CH3; 2Cl
· → Cl2; CH3· + Cl · → CH3Cl и т.д.
Б) Нитрование алканов (впервые эту реакции
провел в 1888г русский ученый М. И. Коновалов, действуя на алканы 12-14 % HNO3 при нагревании смеси до 140оС).
CH3
– CH2 – CH2 – CH3 + HNO3(p-p)→ CH3 – CH – CH2 – CH3 + H2O бутан
NO2 2-нитробутан
В) Сульфирование алканов (взаимодействие с H2SO4).
t
CH3
– CH3 + H2SO4(конц.) → C2H5
– SO3H + H2O
этан этилгидросульфат
Г) Сульфохлорирование алканов.
hv
CH3
– CH2 – CH3 + SO2 + Cl2→ C3H7 – SO2Cl + HCl
пропан пропилсульфохлорид
Д) Сульфоокисление алканов.
hv
2CH3
– CH3 + 2SO2 + O2→ 2C2H5 – SO2OH
этан этилсульфокислота
Е) Дегидрирование алканов (отщепление
водорода при нагревании на катализаторе).
460oC
CH3
– CH2 – CH3 → СH2 = CH – CH3
+ H2
кат. Cr2O3
пропан пропен
Ж) Горение алканов.
CH4
+ 2O2→ CO2 + 2H2O
В общем виде:
CnH2n+2 + (3n+1)/2
O2→ n CO2↑ + (n + 1)H2O
3. Применение алканов.
А) Топливо для двигателей
внутреннего сгорания.
Б) Газ для отопления и приготовления пищи.
В)
Производство лаков, красок, растворителей, пластмасс, синтетических материалов.
Г) Производство хладагентов (фторхлорпроизводные
метана).
Д) Производство медицинских препаратов.
Е) Производство жирных кислот, синтетических жиров,
смазочных масел.
Ж) Резка и сварка металлов.
З) Производство синтетического каучука, резины,
типографской краски.
Домашнее
задание: знать материал
параграфа, записи в
тетрадях, написать
постадийную схему хлорирования
этана, а так
же предложить способ
получения соединения 2,6
диметил октан с
помощью реакции Вюрца,
написать уравнения реакций
горения пентана, нонана,
декана.
