Какие продукты образуются при горении спиртов

В
химических реакциях гидроксисоединений возможно разрушение одной из двух
связей:
·
С–ОН
с отщеплением ОН-группы
·
О–Н
с отщеплением водорода
Это
могут быть реакции замещения, в которых происходит замена ОН или Н, или
реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный
характер связей С–О и О–Н способствует гетеролитическому их разрыву и
протеканию реакций по ионному механизму. При разрыве связи О–Н с
отщеплением протона (Н+) проявляются кислотные свойства
гидроксисоединения, а при разрыве связи С–О – свойства основания и
нуклеофильного реагента.
С
разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции,
давая различные классы соединений. Вследствие доступности гидроксильных
соединений, в особенности спиртов, каждая из этих реакций является одним из
лучших способов получения определенных органических соединений.
I. Кислотно-основные
RO— + H+ ↔ ROH ↔ R+ + OH-
алкоголят-ион
Кислотные свойства
уменьшаются в ряду, а основные возрастают:
HOH → R-CH2-OH →
R2CH-OH → R3C-OH
вода первичный вторичный третичный
Кислотные свойства
С активными щелочными металлами:
2C2H5OH + 2 Na → 2C2H5ONa + H2
этилат натрия
Алкоголяты подвергаются гидролизу, это доказывает,
что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH +
NaOH
Основные свойства
С галогенводородными кислотами:
C2H5OH + HBr
H2SO4(конц)↔ C2H5Br
+ H2O
бромэтан
Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной
способности происходит в следующих рядах:
первичные <
вторичные < третичные
II. Окисление
1). В присутствии
окислителей [O] – K2Cr2O7
или KMnO4 спирты окисляются до карбонильных
соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Третичные спирты более устойчивы к
действию окислителей. Они окисляются только в жестких условиях (кислая
среда, повышенная температура), что приводит к разрушению углеродного
скелета молекулы и образованию смеси продуктов (карбоновых кислот и
кетонов с меньшей молекулярной массой).
В кислой среде:
Для первичных и
вторичных одноатомных спиртов качественной реакцией является взаимодействие их
с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr2O72-
исчезает и появляется зеленоватая окраска, характерная для иона Cr3+ .
Эта смена окраски позволяет определять даже следовые количества спиртов.
CH3- OH + K2Cr2O7 + 4H2SO4
→ CO2 + K2SO4 + Cr2(SO4)3
+ 6H2O
3CH3-CH2-OH + K2Cr2O7
+ 4H2SO4 → 3CH3COH + K2SO4
+ Cr2(SO4)3 + 7H2O
В более жёстких
условиях окисление первичных спиртов идёт сразу до карбоновых кислот:
3CH3-CH2-OH + 2K2Cr2O7
+ 8H2SO4 t→ 3CH3COOH + 2K2SO4
+ 2Cr2(SO4)3 + 11H2O
Третичные спирты
устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при
нагревании, в кислой среде) они окисляются с расщеплением связей С-С и
образованием кетонов и карбоновых кислот.
В нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные спирты до солей соответствующих
карбоновых кислот.
2). Качественная реакция на первичные спирты!
3). Горение(с увеличением массы углеводородного радикала –
пламя становится всё более коптящим)
CnH2n+1-OH
+ O2t → CO2
+ H2O + Q
III. Реакции
отщепления
1)
Внутримолекулярная дегидратация
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 + H2O
бутанол-2 бутен-2
В тех случаях, когда возможны 2 направления реакции,
например:
дегидратация
идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена. Правило
Зайцева: Водород отщепляется от
наименее гидрированного атома углерода соседствующего с углеродом, несущим
гидроксил.
2) Межмолекулярная дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 + H2O
простой эфир
— при переходе
от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов;
уменьшается способность образовывать простые эфиры.
3)
Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В.
Лебедева
2C2H5OH — 425,ZnO,Al2O3→ CH2=CH-CH=CH2 + H2
+ 2H2O
IV. Реакции
этерификации
Спирты
вступают в реакции с минеральными и органическими кислотами, образуя сложные
эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).

Видео-опыты:
Горение спиртов
Взаимодействие этилового спирта с металлическим натрием
Взаимодействие этилового спирта с бромоводородом
Качественная реакция наэтанол
Окисление этилового спиртаоксидом меди (II)
Окисление этилового спиртараствором перманганата калия
Окисление этилового спиртакристаллическим перманганатом калия
Каталитическое окислениеэтанола
Окисление этанола (тест наалкоголь)
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у
насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH.
Общая формула их гомологического ряда — CnH2n+1OH.
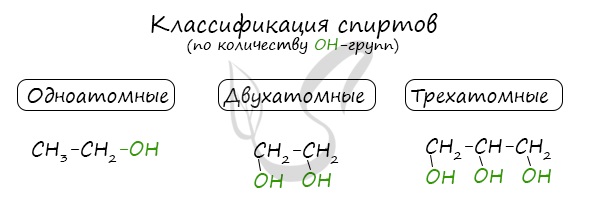
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы
OH — глицерины) и т.д.
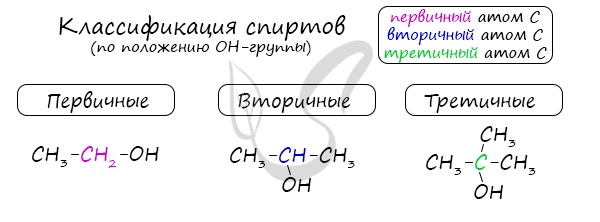
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода),
вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
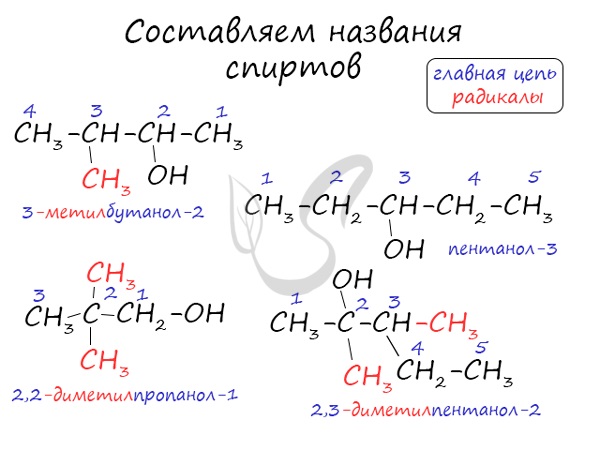
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол,
этанол, пропанол, бутанол, пентанол и т.д.
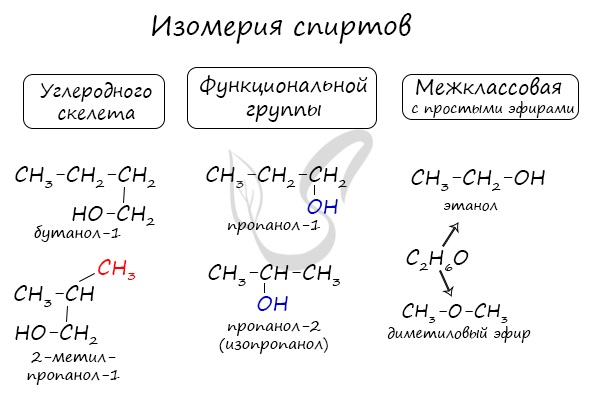
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с
простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
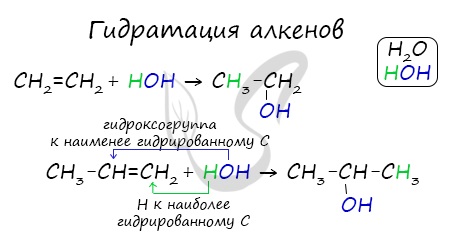
- Гидратация алкенов
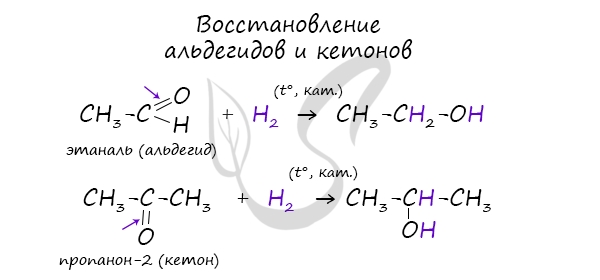
- Восстановление карбонильных соединений
- Получение метанола из синтез-газа
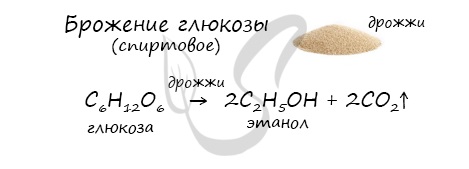
- Получение этанола брожением глюкозы
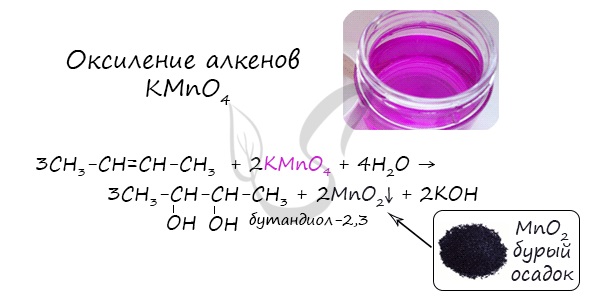
- Окисление алкенов KMnO4 в нейтральной (водной) среде
Помните, что в реакциях галогеналканов со сПиртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором
щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода,
а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных
химических соединений, в том числе и метанола.
CO + 2H2 → (t,p,кат.) CH3-OH
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения.
У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
- Кислотные свойства
- Реакция с галогеноводородами
- Реакции с кислотами
- Дегидратация спиртов
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
- Окисление спиртов
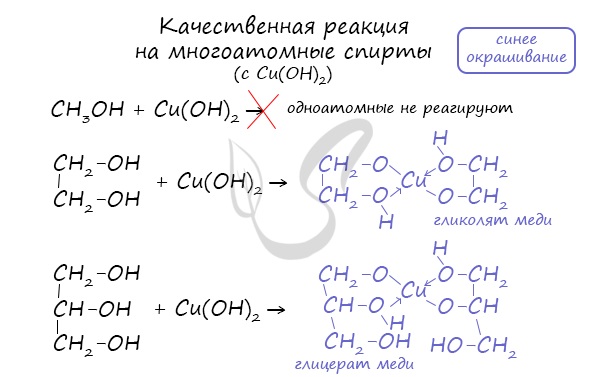
- Качественная реакция на многоатомные спирты
- Кислотные свойства многоатомных спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся
алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
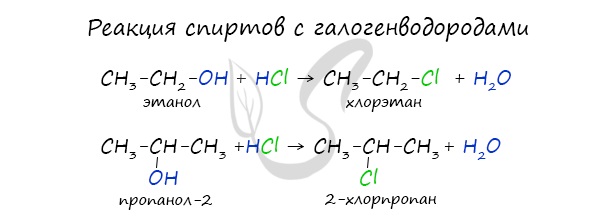
В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое
окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при
которых углеродный скелет подвергается деструкции.
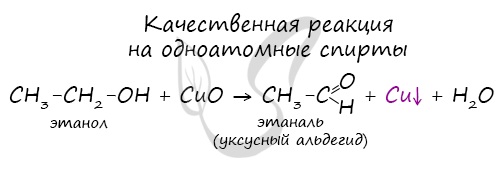
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой
реакции выпадает маслянистый осадок.
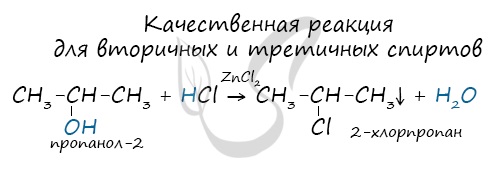
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие
от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
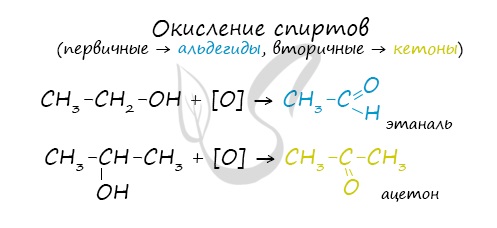
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор
окрашивается в характерный синий цвет.
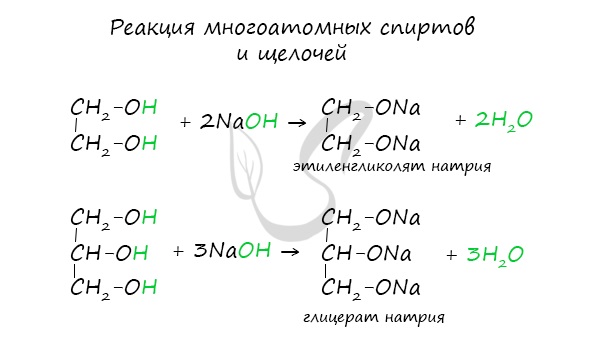
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов).
Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Анонимный вопрос · 6 марта 2019
2,2 K
Какие вещества находятся в клетке и окрашивают органы растений?
Всем трям, то есть здравствуйте. 🙂 Я по жизни оптимист, натуралист, огородник-г…
Хлоропласты, содержащие хлорофилл — окрашивают растения в зелёный цвет. И ещё хромопласты, они окрашивают растения в различные цвета в зависимости от пигмента, который в них содержится: ксантофилл дает желтый цвет, лютеин — красный, антоцианин — от фиолетового до синего в зависимости от рН.
Почему соли натрия, содержащиеся в древесине, дают оранжево красный цвет при сгорании?
Researcher, Institute of Physics, University of Tartu
И не только в древесине, а любые соли натрия в пламени дают желто-оранжевую окраску. Это связано с основным для натрия переходом 3p*->3s (длина волны примерно 590 нм, если посмотрите на какое-нибудь стандартное сопоставление цветов и длин волн, то это будет на границе желтого и оранжевого). Другими словами, при попадании в пламя сначала происходит переход электрона в возбужденное 3р состояние, а оттуда он сваливается на 3s, испуская квант света 590 нм. Почему 590 нм? Ну, вот так получилось, такой энергетический зазор между 3s и 3р уровнями у натрия. У других элементов — другой, поэтому и цвет в пламени будет другой. На этом основан качественный метод опредления элементов — по окрашиванию пламени.
Что же касается красноватого цвета пламени, то его могут давать, например, ионы кальция, которого тоже много в биоматериалах, но скорее всего красный свет связан с неполным сгоранием и низкой температурой пламени.
От чего и в какой степени зависит цвет пламени?
1.Почему включив газовую конфорку и поджигая выходящий газ, мы видим голубоватый огонь? В процессе горения газ распадается на кислород и углерод, выделяя при этом угарный газ, который и является причиной голубого цвета.
2.В состав соли входит хлорид натрия, при горении создающий желто-оранжевые языки пламени. Любой деревянный предмет или костер из дров будут гореть таким же цветом, так как в составе древесного материала находится большое количество подобных солей.
3.Есть у огня и зеленые оттенки. Их появление означает то, что в горящих предметах содержатся фосфор или медь. Причем медное пламя будет ярким и слепящим, близким к белому. Причиной зеленого пламени может стать наличие в предметах горения бария, молибдена, фосфора, сурьмы. Синий цвет зависит от селена или бора.
Огонь без признаков цвета можно увидеть только в лабораторных условиях. Понять, что что-то горит, возможно только по легкому колебанию воздуха и выделяемому теплу.
Какие химические вещества относятся к АХОВ?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Аварийно опасных химических веществ довольно много, но самые распростраенные из них это: аммиак, диоксин, окись углерода, хлор, цианистый углерод, окись этилена, сероуглерод, сернистый ангидрит, гидразин, фосген. Эти вещества применяются в промышленности и сельском хозяйстве, но при аварийном выбросе могут нанести значительный вред окружающей среде, привести к поражению людей и животных.
Почему именно углерод является главным органическим элементом на планете Земля?
ALBA synchrotron, postdoc
Вообще, как мы тут недавно обсуждали в другом вопросе, практически любой вопрос «почему» в науке в конце концов приводит к ответу «таковы законы природы в нашей Вселенной», который хоть и верен, но не слишком конструктивен:)
В частности, законы природы сложились так, что углерод с точки зрения химии оказался самым «никаким» элементом. Ему глубоко пофиг, с кем образовывать ковалентную связь — с другим углеродом, с водородом, с кислородом, с азотом. За счёт этого ему удаётся строить длинные и сложные, но при этом довольно стабильные молекулы. Для других элементов это не так. Кислород или азот образуют прочные связи с водородом, но не друг с другом (построение длинных цепочек азот-азот — вообще самый модный метод синтеза взрывчатки). Связь бор-бор по прочности близка к связи углерод-углерод, зато связь бор-водород очень слабая, а бор-кислород наоборот очень прочная.
Прочитать ещё 1 ответ
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
![]()
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
![]()
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
![]()
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:

Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.

Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
![]()
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
![]()
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида

Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона

Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь

Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ



