Какие продукты на аноде

Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).
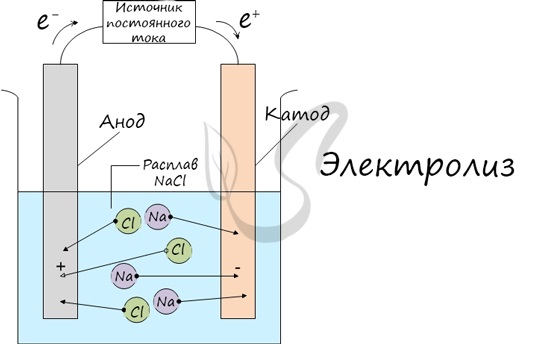
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.
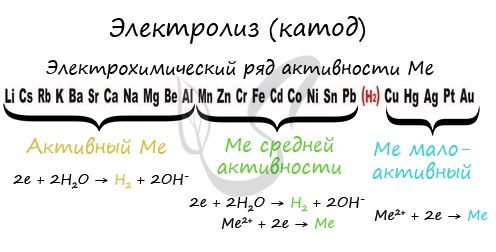
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ — 2e = H2
Анод
К аноду притягиваются анионы — отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-,
I-, F-, S2-, CH3COO-.

При электролизе кислородсодержащих анионов: SO42-, PO43- — на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
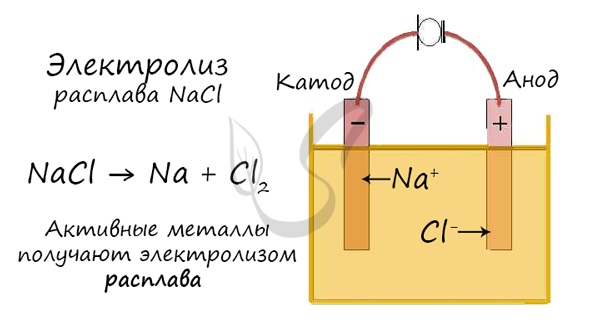
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
| Дано: а)CuCl2, б) NaОН. Анод инертный | Решение а) CuCl2 = Cu2+ + 2Cl-. Схему электролиза составляем в соответствии с табл. 11.1 и 11.2: K(-) A(+) инертный Cu2+ + 2ē = Cu 2Cl- –2ē = Cl2 H2O H2O |
| 1. Схема электролиза – ? 2. Продукты электролиза – ? |
На катоде выделяется Cu, на аноде – Cl2.
б) NaОН = Na+ + ОН-.
K(-) A(+) инертный
Na+ 4ОН – 4ē = О2 + 2H2О
2H2O + 2ē = H2 + 2OH-
На катоде выделяется Н2, на аноде – О2.
2. Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II) , если: а) анод инертный; б) анод никелевый. Какие продукты выделяются на катоде и аноде?
| Дано: NiSO4 а) анод инертный б) анод никелевый | Решение а) анод – инертный NiSO4 = Ni2+ + . Схему электролиза составляем в соответствии с табл. 11.1. и 11.2: |
| 1. Схема электролиза – ? 2. Продукты электролиза – ? |
K(-) A(+) инертный
Ni2+ + 2ē = Ni
2H2O + 2ē = H2 + 2OH- 2H2O – 4ē = О2 + 4H+.
На катоде выделяется Ni и H2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni2+ +
K(-) A(+) (Ni)
Ni2+ + 2ē = Ni , Н2О
2H2O + 2ē = H2 + 2OH- Ni – 2ē = Ni2+.
На катоде выделяется Ni и H2, на аноде растворяется Ni.
3. При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить, какое вещество и в каком количестве выделилось на катоде. Анод инертный.
В соответствии со схемой электролиза
nэк (О2)(анод) = nэк (Н2)(катод) или ,
откуда
= = = 1120 см3,
= 11200 см3/моль.
= 5600 см3/моль.
На катоде выделилось 1120 см3 водорода.
Ответ: 1120 см3 водорода.
б) AgNO3 = Ag+ + .
Схема электролиза:
K(-) A(+) инертный
Ag+ + ē = Ag
H2O 2H2O – 4ē = О2 + 4H+
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: nэк(О2)(анод) = nэк(Ag)(катод) или
,
Откуда = = 10,8 г.
где .
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
УРОВЕНЬ С
Составить схему электролиза и написать уравнения электродных процессов водного раствора сульфата калия (анод инертный). Определить, какие вещества и в каком количестве выделяются на катоде и аноде, если проводить электролиз в течение четырех часов при силе тока 2 А. Температура 298 К, давление 99 кПа.
= = 3,34 л,
где = 11,2 л/моль.
F = 96500 Кл/моль, если τ – c,
F = 26,8 А∙ч/моль, если τ – ч.
= = 1,67 л,
где = 5,6 л/моль, т.е. = 2 .
Объем водорода при заданных условиях
,
откуда
= = 3,73 л.
Объем кислорода при заданных условиях
= 1/2 = 1,87 л.
Ответ: 3,73 л водорода, 1,87 л кислорода.
2. Металлическую деталь, площадь поверхности которой равна 100 см2, необходимо покрыть слоем электролитически осажденной меди из раствора хлорида меди (II). Составить схему электролиза и написать уравнения электродных процессов, если анод медный. Сколько времени должно длиться осаждение при силе тока 8 А и выходе по току 98 %, если толщина покрытия 0,15 мм? Плотность меди 8,9 г/см3.
| Дано: Электролит: CuCl2S = 100 см2h = 0,15 мм I = 8 A BT = 98 % ρCu = 8,9 г/см3 | Решение CuCl2 = Cu2+ + 2Cl- . Схема электролиза: K(-) A(+) (Cu) Cu2+ + 2ē = Cu Cl- H2O H2O Cu – 2ē = Cu2+ На катоде выделяется Cu, на аноде растворяется Cu. |
| Анод медный Схема электролиза – ? Время электролиза τ – ? |
ВТ= .
По закону Фарадея с учетом выхода по току (ВТ) масса меди, фактически выделившейся на катоде:
mCu(факт) = .
Масса меди, необходимая для получения медного покрытия:
mCu(факт) = S ∙ h ∙ ρ, г,
где S – см2, h – см, ρ – г/см3.
S ∙ h ∙ ρCu = ,
откуда
τ = 1,43 часа,
где Mэк(Cu) = = 32 г/моль.
F = 26,8 А∙ч/моль,
10-1 – коэффициент пересчета миллиметров в сантиметры.
Ответ: 1,43 часа.
3. Определить молярную концентрацию эквивалента раствора нитрата серебра, если для выделения всего серебра из 75 см3 этого раствора потребовалось пропустить ток силой 4А в течение
25 минут. Составить схему электролиза и написать уравнения электродных процессов. Анод инертный. Выход по току серебра 100 %.
Молярная концентрация эквивалента раствора AgNO3:
= .
По закону эквивалентов
nэк(AgNO3) = nэк(Ag), nэк(Ag) = ,
где mAg – масса серебра, выделившегося при электролизе с учетом 100 % выхода по току:
mAg = ,
откуда = ,
тогда nэк(AgNO3) = nэк(Ag) = .
Молярная концентрация эквивалента раствора AgNO3
= = 0,83 моль/л,
где τ – c, F = 96500 Кл/моль, Vр-ра – л;
60 – коэффициент пересчета минут в секунды.
10-3 – коэффициент пересчета сантиметров кубических в литры
Ответ: = 0,83 моль/л.
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn2+ +2e → Zn0.
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H20 + 2OH–.
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H+ +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F–), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl– – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления.
4OH– – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H+.
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO– – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na+ + Cl–
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2Cl– – 2e → Cl2
Коэффициент 2 перед Na+ появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na+ + 2Cl– + 2H2O → H20 + 2Na+ + 2OH– + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H20 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO42–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H20 + 2OH–
А: 2H2O – 4e → O20 + 4H+.
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H20 + 4OH–
А: 2H2O – 4e → O20 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H20 + 4OH– + 4H+ + O20.
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H20 + 4H2O + O20.
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H20 + O20.
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu2+ + 2e → Cu0
A: 2Cl– – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu2+ + SO42–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu2+ + 2e → Cu0
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu2+ и SO42– 1:1.
К: 2Cu2+ + 4e → 2Cu0
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Записываем суммарное уравнение:
2Cu2+ + 2SO42– + 2H2O → 2Cu0 + O2 + 4H+ + 2SO42–.
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni2+ + 2Cl–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: 2Cl– – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 4Cl– – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 4Cl– + 2H2O → Ni0 + H20 + 2OH– + Ni2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni0 + H20 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni2+ + SO42–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
A: SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni2+. Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni2+ + 2e → Ni0
2H2O + 2e → H20 + 2OH–
Ni2+ (в растворе)
A: 2SO42– (в растворе)
2H2O – 4e → O2 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
Ni2+ + Ni2+ + 2SO42– + 2H2O + 2H2O → Ni0 + Ni2+ + 2OH– + H20 + O20 + 2SO42– + 4H+.
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni0 + Ni(OH)2 + H20 + O20 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H+ и OH– с образованием двух молекул воды. Оставшиеся 2H+ расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni2+ + SO42– + 2H2O + 2H2O → Ni0 + 2OH– + H20 + O20 + SO42– + 4H+.
Ni2+ + SO42– + 4H2O → Ni0 + H20 + O20 + SO42– + 2H+ + 2H2O.
Итоговое уравнение:
NiSO4 + 2H2O → Ni0 + H20 + O20 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO– + Na+
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2CH3COO– – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na+ + 2CH3COO– + 2H2O → 2Na+ + 2OH– + H20 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H20 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H+ + SO42–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H+ +2e → H2
A: 2H2O – 4e → O2 + 4H+
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H+ +4e → 2H2
A: 2H2O – 4e → O2 + 4H+
Суммируем левые и правые части уравнений:
4H+ + 2H2O → 2H2 + O2 + 4H+
Катионы H+ находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na+ + OH–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 4OH– – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na+ (в растворе)
4H2O + 4e → 2H20 + 4OH–
А: 4OH– – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH– → 2H20 + 4OH– + O20 + 2H2O
Сокращая 2H2O и ионы OH–, получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
