Какие продукты могут образоваться при гидролизе

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 марта 2019;
проверки требуют 9 правок.
Гидро́лиз (от др.-греч. ὕδωρ «вода» + λύσις «разложение») — сольволиз водой. Это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества и воды с образованием новых соединений. Гидролиз соединений различных классов (соли, углеводы, белки, сложные эфиры, жиры и др.) существенно различается.
Гидролиз солей[править | править код]
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде.
Различают обратимый и необратимый гидролиз солей[1]:
- 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 3. Гидролиз соли слабой кислоты и слабого основания:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
- 4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Степень гидролиза[править | править код]
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
где — число молей гидролизованной соли, — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза[править | править код]
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учётом стехиометрических коэффициентов. Вообще, для любой химической реакции вида
константа равновесия определяется по следующей формуле:
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции имеет вид:
или
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных можно заменить одной новой — константой гидролиза:
Численное значение константы гидролиза получим, используя ионное произведение воды и константу диссоциации азотистой кислоты :
подставим в уравнение константы гидролиза:
В общем случае для соли, образованной слабой кислотой и сильным основанием:
, где — константа диссоциации слабой кислоты, образующейся при гидролизе
Для соли, образованной сильной кислотой и слабым основанием:
, где — константа диссоциации слабого основания, образующегося при гидролизе
Для соли, образованной слабой кислотой и слабым основанием:
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – , а и — соответственно, кислота и основание, которые образуют данную соль:
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому её можно включить в константу
тогда выражение для константы гидролиза соли будет иметь вид:
По величине константы гидролиза можно судить о полноте гидролиза: чем больше её значение, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
, моль/л
Где – концентрация соли в растворе, – степень гидролиза
Это выражение можно упростить, т.к. обычно , тогда
Зная, константу гидролиза, можно определить среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Используя это выражение можно вычислить pH раствора:
моль/л
моль/л
Гидролиз органических веществ[править | править код]
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций катаболизма при участии ферментов. Например, в ходе гидролиза при участии пищеварительных ферментов белки расщепляются на аминокислоты. А жиры на глицерин и жирные кислоты, полисахариды (например, крахмал и целлюлоза) — на моносахариды (например, на глюкозу), нуклеиновые кислоты — на свободные нуклеотиды.
При гидролизе жиров в присутствии щёлочей получают мыло; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот. Гидролизом древесины получают этанол, а продукты гидролиза торфа находят применение в производстве кормовых дрожжей, воска, удобрений и др.
См. также[править | править код]
- Аминолиз
- Окислительный аммонолиз
Примечания[править | править код]
- ↑ Приведённые ниже для 1 и 2 случая молекулярные уравнения имеют исключительно условный характер, поскольку вещества-электролиты в водном растворе находятся в ионном виде
Ссылки[править | править код]
- Гидролиз ацетата натрия — видеоопыт в Единой коллекции цифровых образовательных ресурсов
Жиры — органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных)
кислот.
К жирным кислотам (их формулы лучше выучить 😉 относятся:
- Пальмитиновая — C15H31COOH (предельная)
- Стеариновая — C17H35COOH (предельная)
- Олеиновая — C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая — C17H31COOH (непредельная, 2 двойные связи в радикале)
- Линоленовая — C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров
есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры — твердые и
содержат остатки предельных жирных кислот.

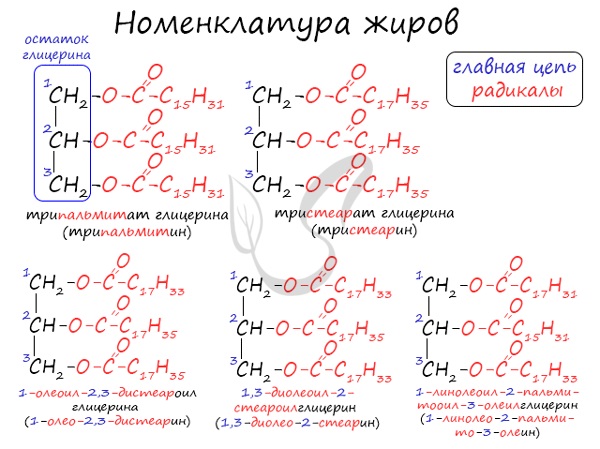
Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов — остатков жирных
кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс «оил».
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание «ин» к названию кислоты и приставку, указывая, сколько гидроксогрупп
в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 😉
Получение жиров
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми
(жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.

Химические свойства жиров
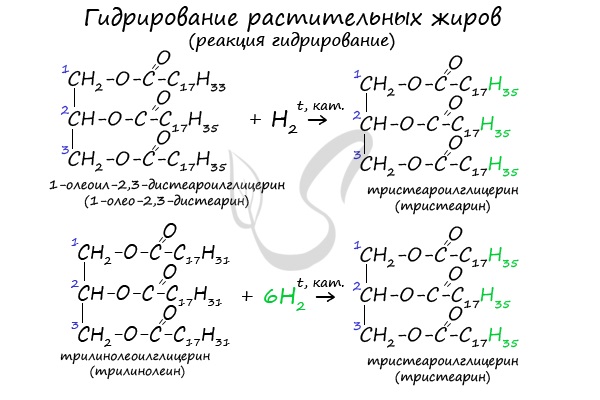
- Гидрирование растительных жиров
- Гидролиз
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой
промышленности получают маргарин.
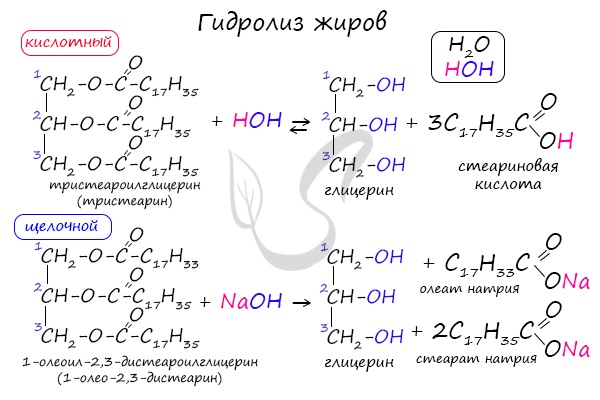
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза
образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза — глицерин и соли жирных кислот.
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот — мыла. Кислотный гидролиз протекает
обратимо, щелочной — необратимо.
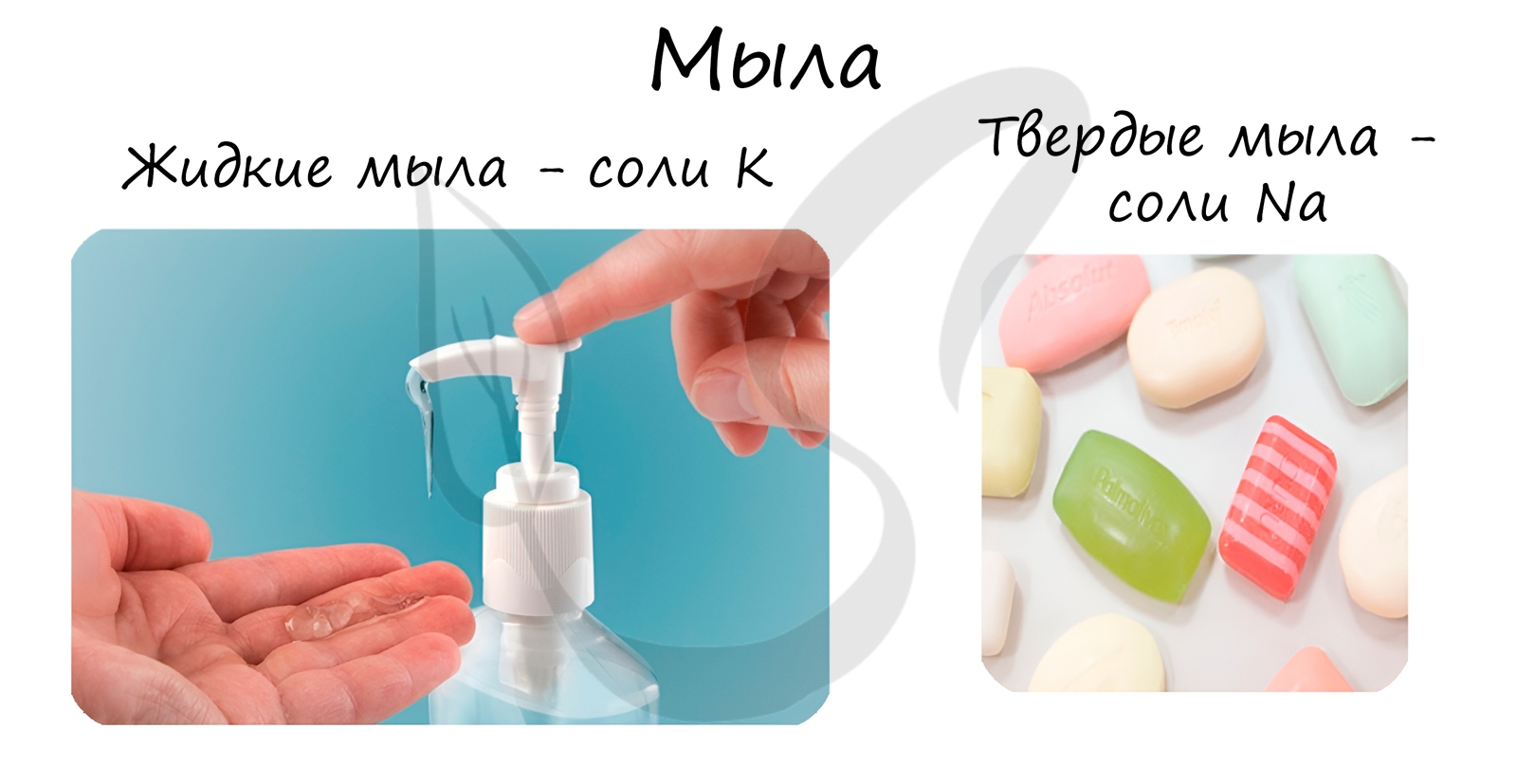
В состав твердого мыла входят соли Na, в состав жидкого — K.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами).
.

Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:

| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С17Н33СООН (содержит одну двойную связь в радикале) СН3—(СН2)7—СН = СН—(СН2)7—СООН |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С17Н31СООН (две двойные связи в радикале) СН3-(СН2)4-СН = СН-СН2-СН = СН-СООН |
| Стеариновая кислота С17Н35 — СООН | Линоленовая кислота С17Н29СООН (три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:

Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин

1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия.

2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина:

Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира.
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca2+ и Mg2+ дают с высшими кислотами нерастворимые в воде соли.
Например, тристеарат глицерина взаимодействует с сульфатом кальция
![]()
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата.
![]()
Далее алкилсульфат гидролизуется щелочью:
![]()
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
С помощью данного урока вы освоите тему «Жиры. Строение, химические свойства, функции в организме». Вначале мы определим, что такое жиры. Затем изучим их строение, обсудим химические свойства, которыми обусловлены многие сферы применения жиров. Также рассмотрим, какие функции они выполняют в организме человека и животных.
Тема: Карбонильные соединения. Карбоновые кислоты
Урок: Жиры. Строение, химические свойства, функции в организме
1. Введение
Жиры – сложные эфиры глицерина и жирных (неразветвленных одноосновных карбоновых) кислот.
Сложные эфиры RCOOR’ – производные карбоновых кислот, у которых гидроксил карбоксильной группы замещен на остаток спирта.
Жиры — строительный материал и запас энергии организма. В теле человека массой 70 кг в среднем содержится около 11 кг жира.
В животных жирах обычно содержатся остатки предельных (насыщенных) углеводородов. Эти жиры твердые.
R = СnH2n + 1
Рис. 1 (Источник)
Растительные жиры (масла) обычно жидкие при комнатной температуре. В состав растительных масел обычно входят остатки непредельных (ненасыщенных) кислот. Растительные масла жидкие потому, что окружение каждой двойной связи – жесткая плоская конструкция из 6 атомов, и такие молекулы плохо укладываются в кристаллическую решетку.
R = СnH2n – 1, СnH2n – 3, СnH2n – 5 …
Рис. 2 (Источник)
Агрегатное состояние жира зависит не от его происхождения, а именно от наличия или отсутствия в нем остатков непредельных кислот.
Кокосовое масло содержит остатки предельных кислот, а потому твердое:
Рис. 3 (Источник)
Рыбий жир – жидкий, потому что в нем содержатся остатки непредельных кислот:
Рис. 4 (Источник)
Гидрирование жиров
Из дешевых сортов растительных масел, непригодных для употребления в пищу, получают с помощью неполного гидрирования маргарин, а при глубоком гидрировании образуется саломас — твердая масса, которую используют для производства мыла:
Гидролиз жиров
В организме под действием ферментов жиры разлагаются на глицерин и жирные кислоты:
В промышленности проводят щелочной гидролиз жиров, при этом образуется глицерин и смесь солей жирных кислот — мыло:
Действие мыла
Почему растворы мыла растворяют частички грязи?
Потому что анион соли жирной кислоты состоит из двух частей: гидрофильной (полярный остаток карбоксильной группы, на котором сосредоточен отрицательный заряд) и гидрофобной (большой углеводородный радикал).
Гидрофильность – сродство к воде, способность к электростатическому взаимодействию с молекулами воды.
Гидрофобность – отсутствие сродства к воде, неспособность к электростатическому взаимодействию с молекулами воды, приводящие к выталкиванию из водной среды.
Углеводородные радикалы мыла прилипают к грязевой частице, а гидрофильная часть взаимодействует с водой. В результате грязь отрывается от поверхности и переходит в раствор, где другие анионы мыла окружают ее со всех сторон и не дают осесть обратно:
Рис. 5
Когда мыло плохо мылится?
1) В подкисленной воде выпадают в осадок белые хлопья. Почему? Более сильные кислоты вытесняют из солей слабые нерастворимые жирные кислоты:
C17H35COONa + HCl C17H35COOH+ NaCl.
2) В жесткой воде — воде, содержащей много солей магния и кальция — выпадают в осадок нерастворимые кальциевые и магниевые соли жирных кислот:
2C17H35COONa + CaCl2 (C17H35COO)2Ca+ 2NaCl.
Химия
11 класс
Вы знаете, что, согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греч. hydro — вода, lysis — разложение, распад).
Гидролиз — это реакция обменного разложения веществ водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение.
Гидролиз органических веществ
1. Гидролиз галогеналканов используют для получения спиртов.

Присутствие щелочи (ОН-) позволяет «связать» получающуюся кислоту и сместить равновесие в сторону образования спирта.
2. Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты:

Для смещения химического равновесия в сторону продуктов реакции гидролиз проводят в присутствии щелочи.
Исторически первым примером такой реакции было щелочное расщепление сложных эфиров высших жирных кислот, что привело к получению мыла. Это произошло в 1811 г., когда французский ученый Э. Шеврёль, нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными эфирами, но только «трижды сложными», производными трехатомного спирта глицерина — триглицеридами. А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют омылением.
Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами:

Натриевые соли высших карбоновых кислот — основные компоненты твердого мыла, калиевые соли — жидкого мыла.
Французский химик М. Бертло в 1854 г. осуществил реакцию этерификации и впервые синтезировал жир. Следовательно, гидролиз жиров (как и других сложных эфиров) протекает обратимо. Уравнение реакции можно упрощенно записать так:

В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидролизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые, свойственные ему жиры. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролизуются и затем постепенно окисляются до оксида углерода (IV) и воды с выделением энергии, необходимой для жизнедеятельности.
В технике гидролиз жиров используют для получения глицерина, высших карбоновых кислот, мыла.
3. Как вы знаете, углеводы являются важнейшими компонентами нашей пищи. Причем дисахариды (сахароза, лактоза, мальтоза) и полисахариды (крахмал, гликоген) непосредственно не усваиваются организмом. Они, так же как и жиры, сначала подвергаются гидролизу.
Гидролиз дисахаридов, например сахарозы, можно представить следующим уравнением:

Гидролиз крахмала идет ступенчато, схематически его можно изобразить так:

Схема 4
Превращение углеводов в живых организмах

или более кратко:

В лабораторных и промышленных условиях в качестве катализатора этих процессов используют кислоту. Реакции осуществляют при нагревании.
Реакцию гидролиза крахмала до глюкозы при каталитическом действии серной кислоты осуществил в 1811 г. русский ученый К. С. Кирхгоф.
В организме человека и животных гидролиз углеводов происходит под действием ферментов (схема 4).
Промышленным гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы). Патоку применяют в кондитерском деле.
Декстрины как продукт частичного гидролиза крахмала обладают клеящим действием: с ними связано появление корочки на хлебе и жареном картофеле, а также образование плотной пленки на накрахмаленном белье под действием горячего утюга.
Еще один известный вам полисахарид — целлюлоза — также может гидролизоваться до глюкозы при длительном нагревании с минеральными кислотами. Процесс идет ступенчато, но кратко его можно записать так:

Этот процесс лежит в основе многих гидролизных производств. Они служат для получения пищевых, кормовых и технических продуктов из непищевого растительного сырья — отходов лесозаготовок, деревообработки (опилки, стружка, щепа), переработки сельскохозяйственных культур (соломы, шелухи семян, кочерыжек кукурузы и т. д.).
Техническими продуктами таких производств являются глицерин, этиленгликоль, органические кислоты, кормовые дрожжи, этиловый спирт, сорбит (шестиатомный спирт).
4. Вы знаете, что белки-биополимеры — основа жизни всех живых организмов (от вируса до человека) — состоят главным образом из α-аминокислот. Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов.
Так как все белки являются полипептидами, то полный гидролиз, например, трипептида можно представить так:

Можно представить себе и обратный процесс — процесс образования трипептида из аминокислот:

Процесс образования полипептида относится к реакциям поликонденсации. Аналогичные реакции гидролиза и поликонденсации осуществляются и в организме (схема 5).
Схема 5
Превращение белков в живых организмах

Известна обширная группа ферментов (гидролаз), катализирующих высокоселективный гидролиз молекул природных соединений. На таких процессах основано большинство методов изучения строения биополимеров.
5. Неизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (АТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе АТФ до адено-зиндифосфорной кислоты (АДФ) энергия высвобождается:

Обратный процесс — образование АТФ из АДФ — протекает с поглощением энергии. Следовательно, АТФ — это универсальное энергетическое вещество клетки, своего рода энергетический «консерв», который клетка использует по мере надобности.
