Какие признаки относятся к свойствам веществ

Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
«Вещества и их свойства. Чистые вещества и смеси»
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
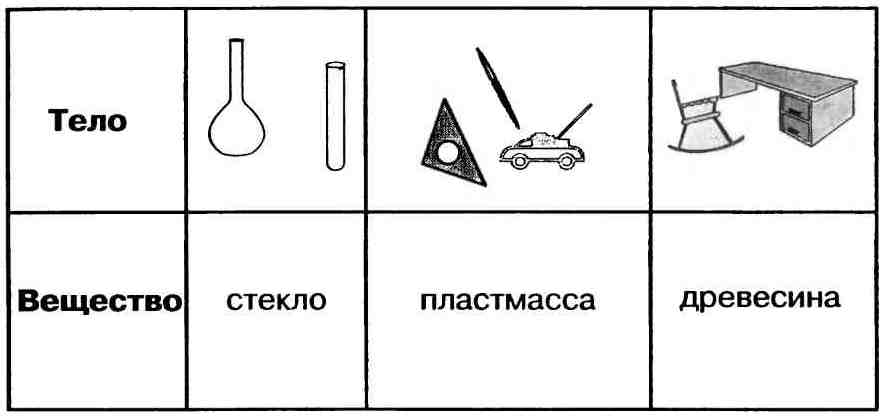
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
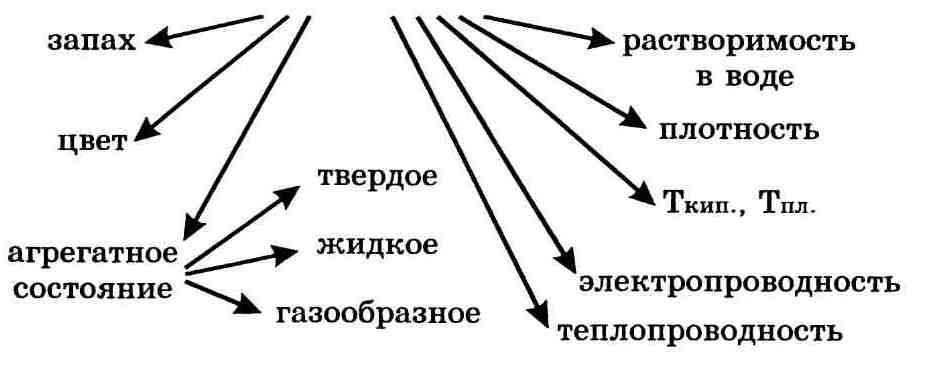
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
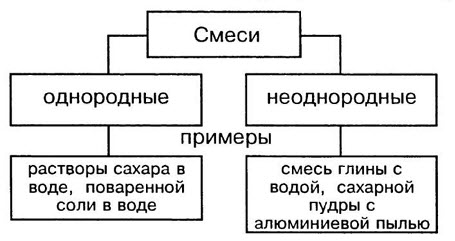
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
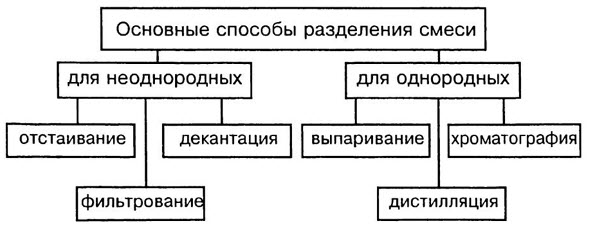
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Следующая тема: «Физические и химические явления».
Гипермаркет знаний>>Химия>>Химия 7 класс>> Вещества и их свойства. Экспериментируем дома. Свойства некоторых продуктов питания
Первоначальные химические понятия
Вещества и их свойства
Материал параграфа поможет вам:
> различать вещества, физические тела и материалы;
> характеризовать вещества по физическим свойствам.
Вещество.
В повседневной жизни мы сталкива емся со многими веществами. Среди них — вода, песок, железо, золото, сахар, соль, крахмал, уголь… Продолжать этот перечень можно очень долго. В сотни раз больше веществ используют и получают ученые.

Рис. 20. Природные вещества
Ныне известно свыше 20 млн веществ. Многие из них существуют в природе (рис. 20). В воздухе есть различные газы; в реках, морях и океанах, кроме воды, — растворенные в ней вещества; в твердом поверхностном слое нашей планеты — многочисленные минералы, горные породы, руды и т. п. Чрезвычайно большое количество веществ находится и в живых организмах.

Рис. 21. Искусственно полученные вещества
Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена, многих других веществ в природе нет. Их выпускает промышленность (рис. 21).
Некоторые вещества, существующие в природе, можно получить и в химической лаборатории. Так, при нагревании марганцовки выделяется кислород, а при нагревании мела — углекислый газ. Ученые при высокой температуре и давлении превращают графит в алмаз, но кристаллики искусственных алмазов очень мелкие и непригодны для изготовления ювелирных украшений. Получить же полудрагоценный камень малахит с помощью химических опытов не удается.
Неотъемлемым признаком вещества является масса. Световые лучи, магнитное поле не имеют массы и к веществам не относятся.
Вещество — это то, из чего состоит физическое тело.
Физическим телом называют все, что имеет массу и объем. Физическими телами являются, например, капля воды, кристаллик минерала, обломок стекла, кусочек пластмассы, зерно пшеницы, яблоко, орех, а также любой предмет, изготовленный человеком, — часы, игрушка, книга, ювелирное украшение и т. д.
► Назовите вещества, из которых состоят такие физические тела: льдина, гвоздь, карандаш.
Вещества, используемые для изготовления предметов, оборудования, а также в строительстве и других отраслях, называют материалами (рис. 22).
Первыми в истории человечества были природные материалы — древесина, камень, глина. Co временем люди научились выплавлять металлы и стекло, получать известь и цемент. В последние десятилетия на замену традиционным материалам приходят новые, в частности различные пластмассы.

Рис. 22. Строительные материалы
► Из каких материалов (пластмасса, стекло, металл, ткань, древесина) могут быть изготовлены ваза, ожерелье, тарелка?
Агрегатные состояния вещества.
Вещество может существовать в трех агрегатных состояниях — твердом, жидком и газообразном.
При нагревании твердые вещества плавятся, а жидкости закипают, превращаясь в пар. Понижение температуры приводит к обратным превращениям. Некоторые газы при высоком давлении сжижаются. При всех этих явлениях мельчайшие частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое.
Каждый знает о трех агрегатных состояниях воды, в которых она существует в природе: лед, вода, водяной пар. Ho не всякое вещество может быть твердым, жидким и газообразным. Для сахара известны два агрегатных состояния: твердое и жидкое. При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует. А такое вещество как графит нельзя расплавить: при температуре 3500 0C он сразу превращается в пар.
Кристаллические и аморфные вещества.
Если рассматривать соль и сахар через увеличительное стекло, то можно заметить, что крупинки соли имеют форму кубиков, а сахара — другую форму, но тоже правильную, симметричную. Каждая такая крупинка является кристаллом. Кристалл — это природное физическое тело, имеющее плоские грани (поверхности) и прямые ребра (стыки граней). Следовательно, соль и сахар — кристаллические вещества. К таким веществам относятся лимонная кислота, глюкоза, алмаз, графит, металлы и др. (рис. 23). Во многих случаях кристаллы веществ настолько мелкие, что их можно увидеть только под микроскопом.
Стекло — не кристаллическое, а аморфное1 вещество. Если его измельчить, то получим бесформенные кусочки, не похожие друг на друга. Аморфными веществами являются также крахмал, мука, полиэтилен и др. (рис. 24).
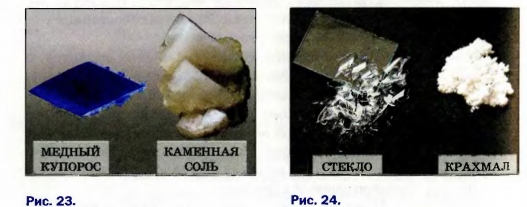
Рис. 23. Кристаллические вещества
Рис. 24. Аморфные вещества
Физические свойства веществ.
Все вещества чрезвычайно разнообразны; каждое обладает совокупностью определенных свойств.
Свойства вещества — это признаки, по которым вещество отличается от другого или подобно ему.
1 Термин происходит от греческих приставки а- и слова morphe — форма.
Железо легко отличить от древесины по цвету, особому блеску, а также на ощупь: металл всегда кажется более холодным, так как лучше проводит теплоту. Особенностью железа является то, что оно притягивается к магниту, а древесина — нет. В отличие от железа древесина в воде не тонет, поскольку ее плотность меньше плотности воды, а плотность железа — больше. Железо выдерживает высокую температуру, а древесина сначала темнеет, затем чернеет и загорается.
Свойства вещества, которые определяют наблюдением или измерением, без превращения его в другое вещество, называют физическими.
Важнейшие физические свойства вещества:
• агрегатное состояние при определенных температуре и давлении;
• цвет, блеск (или их отсутствие);
• запах (или его отсутствие);
• растворимость (или нерастворимость) в воде;
• температура плавления;
• температура кипения;
• плотность;
• теплопроводность;
• электропроводность (или неэлектропроводность).
Перечень физических свойств твердых веществ можно расширить, включив в него твердость, пластичность (или хрупкость), а для кристаллических — еще и форму кристаллов. Характеризуя жидкость, указывают, какая она — подвижная или маслянистая.
Такие физические свойства как цвет, запах, вкус, форма кристаллов можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, в частности — в справочниках.

Рис. 25. Нагревание иода
Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна. Газообразный кислород бесцветный, а жидкий — голубой.
Знание физических свойств помогает «узнавать» немало веществ. Например, медь — единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод — почти черное твердое вещество, которое при нагревании превращается в темно- фиолетовый пар (рис. 25). В большинстве случаев для определения вещества нужно при нимать во внимание несколько его свойств.
Лабораторный опыт№ 1Ознакомление с физическими свойствами веществ
Вам выдано три пробирки, в которых содержатся селитра1, графит и полиэтилен2. В вашем распоряжении есть стакан с водой (или промывалка) и стеклянные палочки.
Опишите вещества. Каков характер частиц каждого вещества (кристаллики, порошок, мелкие кусочки произвольной формы)? Выясните, растворяются ли вещества в воде, легче они или тяжелее ее.
Запишите физические свойства веществ в таблицу:

Какое свойство (свойства) позволяет отличить каждое вещество от двух других?
Назовите свойства, одинаковые для двух (трех) веществ.
Кроме физических свойств, каждое вещество имеет и химические свойства. О них пойдет речь позже.
1 Минеральное удобрение.
2 Учитель может заменить графит серой, медными или железными опилками, а полиэтилен — другим полимером.
Выводы
Вещество — то, из чего состоит физическое тело. Неотъемлемым признаком вещества является его масса.
Вещество может существовать в трех агрегатных состояниях: твердом, жидком и газообразном. Твердые вещества бывают кристаллическими и аморфными.
Свойства вещества — это признаки, по которым оно отличается от другого вещества или подобно ему.
Физические свойства вещества определяют наблюдением или измерением, без превращения его в другое вещество.
?
19. Что такое физическое тело, вещество, материал?
20. Найдите соответствие:
Вещество Физическое тело
1) золото; а) термометр;
2) ртуть; б) кольцо;
3) бумага; в) витрина;
4) стекло; г) тетрадь.
21.. Выберите среди приведенных слов и словосочетаний те, которые от носятся к веществам: стол, медь, лед, пластмассовая бутылка, спирт, газета, водяной пар, серебряная цепочка.
22. Какие из веществ являются строительными материалами: углекислый газ, железобетон, стекло, бумага, капрон, сталь?
23. Приведите примеры: а) нескольких предметов, сделанных из одного материала; б) предмета, сделанного из нескольких материалов; в) двух материалов, из которых изготовляют аналогичные предметы.
24. Опишите физические свойства мела.
25. Какие вещества, имеющиеся у вас дома, можно определить по за паху?
26. В сосудах без этикеток содержатся духи, растительное масло, поваренная соль, кусочки железа, мрамора. По каким свойствам можно определить каждое вещество?
27. Назовите несколько твердых веществ, которые вы легко можете отличить от остальных.
28. Приняв во внимание физические свойства веществ, объясните, почему отвертки и плоскогубцы имеют, как правило, пластмассовые ручки.
Экспериментируем дома
Свойства некоторых продуктов питания
Напишите на отдельных листочках бумаги названия веществ: мука, поваренная соль «Экстра», сахарная пудра, крахмал. Насыпьте на каждый листочек по несколько граммов соответствующего вещества.
Опишите внешний вид веществ.
Разотрите щепотку каждого вещества пальцами (определите, насколько мелкими являются его частички).
Попробуйте вещества на вкус (с веществами, имеющимися в химической лаборатории, это делать категорически запрещено).
Выясните, растворяются ли вещества в воде.
Запишите результаты исследований и наблюдений в таблицу, аналогичную представленной на с. 32.
Можно ли различить эти вещества? Если да, то как именно?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
![]() конспект урока и опорный каркас
конспект урока и опорный каркас
![]() презентация урока
презентация урока
![]() интерактивные технологии
интерактивные технологии
![]() акселеративные методы обучения
акселеративные методы обучения
Практика
![]() тесты, тестирование онлайн
тесты, тестирование онлайн
![]() задачи и упражнения
задачи и упражнения
![]() домашние задания
домашние задания
![]() практикумы и тренинги
практикумы и тренинги
![]() вопросы для дискуссий в классе
вопросы для дискуссий в классе
Иллюстрации
![]() видео- и аудиоматериалы
видео- и аудиоматериалы
![]() фотографии, картинки
фотографии, картинки
![]() графики, таблицы, схемы
графики, таблицы, схемы
![]() комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
![]() рефераты
рефераты
![]() шпаргалки
шпаргалки
![]() фишки для любознательных
фишки для любознательных
![]() статьи (МАН)
статьи (МАН)
![]() литература основная и дополнительная
литература основная и дополнительная
![]() словарь терминов
словарь терминов
Совершенствование учебников и уроков
![]() исправление ошибок в учебнике
исправление ошибок в учебнике
![]() замена устаревших знаний новыми
замена устаревших знаний новыми
Только для учителей
![]() календарные планы
календарные планы
![]() учебные программы
учебные программы
![]() методические рекомендации
методические рекомендации
![]() обсуждения
обсуждения
![]() Идеальные уроки-кейсы
Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний — Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов —
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других «взрослых» тем.
Разработка — Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: 
