Какие органические вещества проявляют амфотерные свойства
Амфоте́рность (от др.-греч. ἀμφότεροι «двоякий, двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство[править | править код]
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
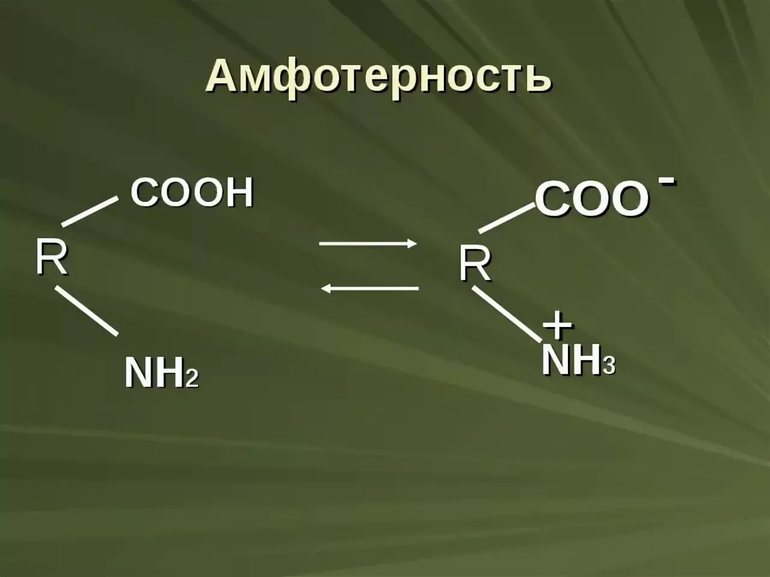
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
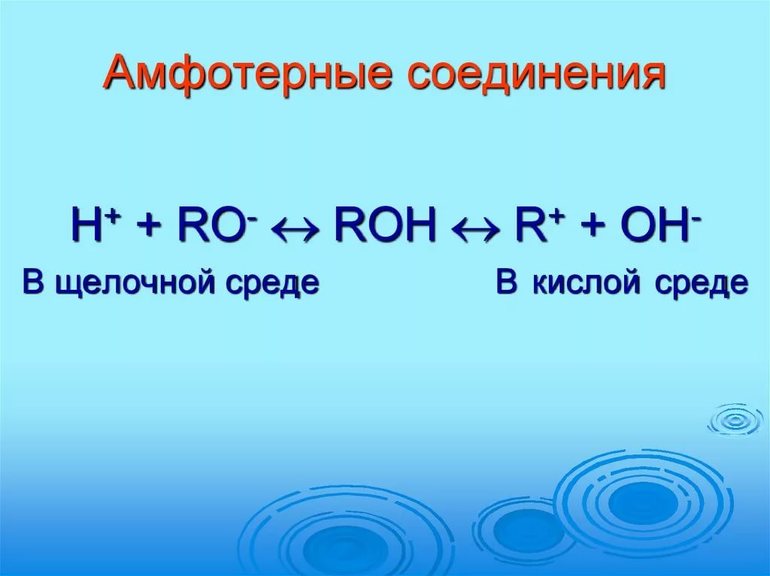
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может быть описано как реакции ионного обмена ионов среды с лигандами H2O и OH–. Например, для Al(OH)3 ионные равновесия могут быть записаны следующим образом:
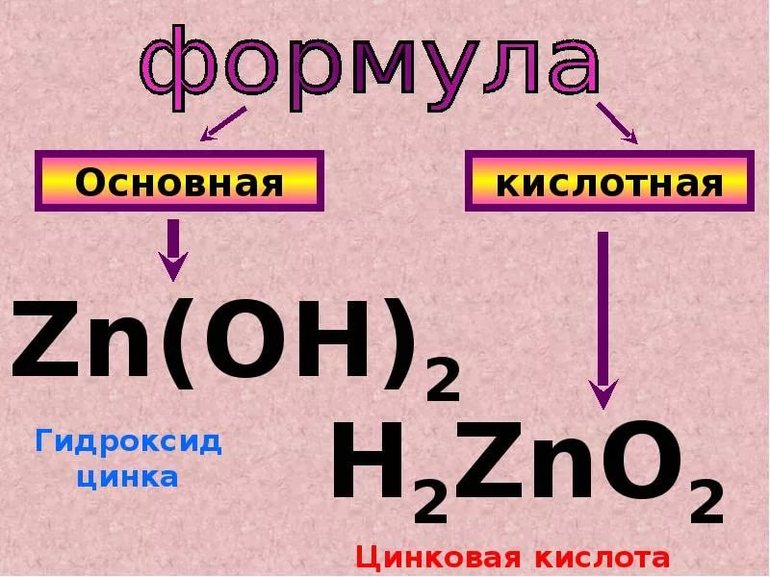
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Ссылки[править | править код]
- Амфотерный // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература[править | править код]
- Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с
Примечания[править | править код]
- ↑ Танганов Б.Б. Химические методы анализа. — Улан-Удэ, 2005.- 550 с.
- ↑ 1 2 3 Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- ↑ 1 2 Угай Я. А. Общая и неорганическая химия. — М.: Высшая школа, 1997. — 527 с.
- ↑ Автопротолиз воды / Жуков С. Т. Химия. 8-9 класс
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. – М.: Химия, 2000. – 480 с.: ил.
- ↑ Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с .
Амфотерность (от др.-греч. амфотеро — «двойственный»,
«обоюдный») — способность некоторых соединений проявлять в зависимости от
условий как кислотные, так и основные свойства.
Понятие амфотерность как характеристика
двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л.
Тенаром.
Амфотерными называются
оксиды и гидроксиды, которые проявляют и основные и кислотные свойства в
зависимости от условий.
Наиболее
часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды):
ZnO,
Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO,
Sn(OH)2, Al2O3, Al(OH)3, Fe2O3,
Fe(OH)3, Cr2O3, Cr(OH)3
Свойства амфотерных соединений
запомнить не сложно: они взаимодействуют с
ОСНОВНЫЕ СВОЙСТВА
При взаимодействии с кислотами все просто. Амфотерные соединения ведут себя как основания:
Оксиды:
Al2O3 + 6HCl =
2AlCl3 + 3H2O;
ZnO + H2SO4 = ZnSO4 +
H2O;
BeO + HNO3 = Be(NO3)2 +
H2O
Гидроксиды:
Fe(OH)3 + 3HCl = FeCl3 +
3H2O;
Pb(OH)2 + 2HCl = PbCl2 +
2H2O
Таким образом, при описании основных свойств записывают хорошо знакомые уравнения реакций обмена.
КИСЛОТНЫЕ СВОЙСТВА
Сложней для понимания реакция со щелочью. Рассмотрим на примере взаимодействия гидроксида цинка с гидроксидом калия при сплавлении. Амфотерные соединения взаимодействуя с основаниями, ведут себя как кислоты. Вот и запишем гидроксид
цинка Zn(OH)2 как
кислоту. У кислоты водород спереди, вынесем его: H2ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он –
кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + H2ZnO2(тв.) = K2ZnO2 + 2H2O
Полученное
вещество K2ZnO2 называется метацинкат калия (или просто
цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H2ZnO2 (солями такие соединения называть не совсем правильно, но
для собственного удобства мы про это забудем).
Гидроксид цинка записывать в виде H2ZnO2 не принято. Пишем как обычно Zn(OH)2,
но подразумеваем (для собственного удобства), что это кислота H2ZnO2:
2KOH(тв.) + Zn(OH)2(тв.)
= K2ZnO2 + 2H2O
С гидроксидами при сплавлении, в которых
2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) =Na2BeO2 + 2H2O (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) = Na2PbO2 + 2H2O (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя OH— группами (Al(OH)3, Cr(OH)3, Fe(OH)3) немного
иначе.
Разберем
на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH = H2O + KAlO2
(метаалюминат калия, или просто алюминат)
Но гидроксид алюминия HAlO2 записывать нельзя, записываем как обычно, но подразумеваем кислоту HAlO2:
Al(OH)3(тв.) + KOH(тв.) = 2H2O + KAlO2 (метаалюминат калия)
То
же самое и с гидроксидом хрома (при сплавлении):
Cr(OH)3 → H3CrO3 → HCrO2;
Cr(OH)3(тв.) + KOH(тв.) = 2H2O + KCrO2
(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли
хромовой кислоты).
*С гидроксидами содержащими четыре группы
ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3;
Pb(OH)4 → H4PbO4 → H2PbO3
Следует
помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью
окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4,Pb(OH)4).
Оксид | Гидроксид | Гидроксид в виде | Кислотный остаток | Соль | Название соли |
BeO | Be(OH)2 | H2BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
ZnO | Zn(OH)2 | H2ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
SnO | Sn(OH)2 | H2SnO2 | SnO22- | K2SnO2 | СтаннИТ |
PbO | Pb(OH)2 | H2PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
SnO2 | Sn(OH)4 | H2SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
PbO2 | Pb(OH)4 | H2PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ |
* Выше было рассмотрено взаимодействие амфотерных соединений с твердыми щелочами при сплавлении, т.е. в отсутствии воды. При взаимодействии с растворами щелочей образуются комплексные соединения:
Al(OH)3 + KOH → K[Al(OH)4]
(тетрагидроксоалюминат калия);
Al(OH)3 + 3KOH → K3[Al(OH)6]
(гексагидроксоалюминат калия).
С растворами щелочей реагируют и амфотерные оксиды. Следует обратить внимание, что в уравнении реакции вода записывается, как исходное вещество, т.е. в левой части уравнения:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4];
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6].
Продукты реакций относятся к классу солей и являются растворимыми. Следовательно, при диссоциации распадаются на катион металла и анионы кислотных остатков
[Al(OH)4]- или [Al(OH)6]3-.
Какой продукт писать, не имеет значения. Главное чтобы все индексы были верно проставлены и сумма всех зарядов равнялась нулю.
ПЕРЕХОДНЫЕ МЕТАЛЛЫ
Элементы, образующие амфотерные оксиды и гидроксиды, относятся к металлам. Они как все металлы реагируют с разбавленными кислотами:
2Al + 6HCl = 2AlCl3 + 3H2;
Zn + H2SO4 = ZnSO4 + H2
Наиболее активные металлы, образующие амфотерные оксиды и гидроксиды (алюминий, берилий, цинк), реагируют со щелочами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
ТРЕНИРУМСЯ!!!
Амфотерные гидроксиды
Амфотерные оксиды
Химические свойства амфотерных гидроксидов
Химические свойства амфотерных оксидов
Амфотерные неорганические и органические соединения
- Какое из утверждений верно? «Понятие «амфотерность» в химии означает:
- преобладание кислотных свойств вещества над основными;
- проявление веществом как кислотных, так и основных свойств;
- способность вещества диссоциировать с отщеплением как Н+, так и ОН-;
4. способность амфотерных веществ взаимодействовать друг с другом
2. Некоторый элемент образует 3 типа оксидов (основный, кислотный, амфотерный). Степень окисления элемента в амфотерном оксиде будет:
1) минимальной; 2). максимальной
3. промежуточной между минимальной и максимальной 4.нулевой;
3. В щелочном растворе аминоуксусная кислота существует в виде частиц:
1). Н3N+-CH2-COOH; 2). H2N-CH2-COO-
3). H3N-CH2-COO- 4). H2N-CH2-COOH
4. Какое из утверждений неверно?
1) амфотерные оксиды взаимодействуют с растворами щелочей;
2) амфотерные гидроксиды реагируют с растворами сильных кислот
3) органических амфотерных соединений не существует
4) амфотерным оксидам соответствуют амфотерные гидроксиды.
5. Какое из соединений, формулы которых приведены ниже, является комплексным?
1) СаОНСl 2) (-CH2 – CH2- ) n; 3) Na[CrOH)4]; 4) H4P2O7.
- Какая из приведенных формул лишняя?
- H2ZnO2; 2) ZnCl2; 3) ZnO; 4) Zn(OH)2
- К амфотерным гидроксидам не относят вещество, имеющее формулу:
- Be(OH)2; 2) Pb(OH)2; 3) K2[Zn(OH)4]; 4) Cu(OH)2;
- При добавлении избытка раствора гидроксида калия к раствору хлорида алюминия происходит следующее превращения:
- вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием комплексной соли – тетрагидроксоалюмината калия;
- образуется осадок гидроксида алюминия;
- сначала видимых изменений не наблюдается, затем образует осадок гидроксида алюминия;
- вначале образуется осадок гидроксида алюминия, который затем растворяется с образованием соли – метаалюмината калия.
- При взаимодействии свежеприготовленного осадка амфотерного гидроксида с избытком щелочи всегда образуется:
1) средняя соль; 2) основная соль;
3)двойная соль 4) комплексная соль.
10. Комплексную соль с формулой K4[Fe(CN)6] разывают гексацианоферрат (II) калия (желтая кровяная соль) и используют в аналитической химии для обнаружения в растворе иона Fe3+. Координационное число, заряд иона-комплексообразователя и заряд комплексного иона в данном соединении соответственно равны:
1) 6, +2, -4; 2) 4, + 2, -6; 3) 6, -4, +2; 4) 2, +6, -4.
11. Какое из химических свойств аминокислот обусловлено наличием в их молекуле аминогруппы?
1) образование сложных эфиров;
2) взаимодействие с неорганическими кислотами
3) взаимодействие с щелочами;
4) способность к отщеплению катиона водорода.
12. Какое из химических свойств аминокислот не обусловлено наличием в их молекуле
карбоксильной группы?
1) взаимодействие со спиртами;
2) взаимодействие с неорганическими кислотами
3) взаимодействие с щелочами;
4) способность к отщеплению катиона водорода.
13. Синтетические полиамидные волокна являются производными аминокислот со следующим расположением функциональных групп – аминогруппы – NH2 и карбоксильной группы – COOH:
1) непосредственно связанными друг с другом;
2) находящимися у одного атома углерода;
3) разделенными несколькими атомами углерода;
4) расположенными на концах углеродной цепи.
14. Трипептид образован остатками аминоуксусной, α – аминопропиловой и β – аминомасляной кислот в указанной последовательности. Обозначение этого трипептида с помощью международной символики:
- Gly – Val – Ala; 2) Gly – Ala – Va;
3) Ala – Gly – Val 4) Val – Ala – Gly.
15.Аминокислоты, имеющие общую формулу H2 – CH – COOH, содержат асимметрический
│ атом углерода, поэтому
R могут существовать в виде оптических изомеров, условно обозначаемых D и L. Природные белки, образующие все живые организмы на Земле, построены:
1) остатками D-аминокислот;
2)остатками L-аминокислот;
3) закономерным чередованием остатков L- и D – аминокислот в полипептидной
цепи;
- беспорядочным чередованием остатков L- и D- аминокислот в полипептидной
цепи.
16. Поликонденсация , α – аминокислот приводит к образованию полипептидов. Обратную реакцию называют:
1) деполиконденсация; 2) деполимеризация;
3) гидролиз; 4) гидратация.
18. При добавлении небольшого объема р-ра гидроксида натрия к избытку р-ра хлорида алюминия образуется дисперсная система, которую называют:
- эмульсией; 2) суспензией; 3) золем; 4) гелем.
- Молекула воды может являться как донором, так и акцептором протона, превращаясь при этом соответственно в ионы:
1) гидроксид – анион и катион гидроксония;
2) катион водорода и гидроксид – анион;
3) катион гидроксония и гидроксид – анион;
4) гидроксид – анион и катион водорода
20. Ионное уравнение реакции [Zn(OH)4]2- + 2H+ = Zn(OH)2 + 2H2O соответствует взаимодействию между:
1) гидроксидом цинка и соляной кислотой;
2) тетрагидроксоцинкатом натрия и азотистой кислотой;
3) тетрагидроксоцинкатом калия и серной кислотой;
4) оксидом цинка и азотной кислотой.
21. При пропускании постоянного электрического тока через водный раствор α-аминопропионовой кислоты (аланина) частицы растворенного вещества:
1) движутся к катоду; 3) движутся к катоду, и к аноду;
2) движутся к аноду; 4)не движутся к катоду, и к аноду.
22. Металл в степени окисления +3 образует амфотерный оксид, молярная масса которого на 49,5% больше, чем у соответствующего основания. Данный металл в Периодической системе Д.И.Менделеева находится в группе, номер которой:
1) III; 2) IV; 3) V: 4) VIII.
23. Для какого из элементов справедливо утверждение: «С увеличением степени окисления элемента в оксиде его характер является от основного через амфотерный к кислотному»?
1) хлора; 2)серы; 3)хрома; 4)алюминия.
24. Органическое вещество лизин имеет следующую формулу:
H2N – CH2 — CH2 — CH2 — CH2 – CH – COOH какое из утверждений верно?
│
NH2
1) лизин не проявляет амфотерных свойств;
2) лизин проявляет амфотерные свойства с преобладанием основных;
3) лизин проявляет амфотерные свойства с преобладанием кислотных;
4) лизин не является аминокислотой.
25. В растворе с рН
1) катиона; 2) аниона; 3) биополярного иона; 4) молекулы.
26. При взаимодействии 1 моль гидроксида алюминия с раствором, содержащим 1 моль серной кислоты, образуется:
1) кислая соль; 2) средняя соль;
3) основная соль; 4) комплексная соль.
27. Минерал,не содержащий амфотерного оксида:
1) корунд; 2) рубин; 3) сапфир; 4) криолит.
28. Какой из природных силикатов не содержит оксида алюминия?
1) каолин; 2) рубин; 3) асбест; 4) слюда.
29. Амфотерные свойства проявляет вещество, формула которого:
1) H2N – (CH2)6 – NH2 2) H2N – CH – COOH
3) О2N-CH2-COOH CH2 – C6H5
4) C6H5-CH2-NH2
30. Гидроксид меди (II) растворяется в растворе вещества, формула которого:
1) KOH; 2)H2SO4; 3) NH3; 4) все приведенные ответы верны.

Это определение было введено при изучении общей теоретической химии в области ведущих и кислотных взаимодействий при наступлении определенных условий.
Отмечается влияние смены растворяющего вещества на дуальные характеристики.
Амфотерные свойства
В концепции электролитической диссоциации, когда происходит распадение проводящего вещества на отдельные ионы при сплавлении или растворении, субстанция реагирует по кислотному механизму или основным свойствам. В первом случае отщепляются частицы гидроксония, Н+, во втором варианте отделяются гидроксид-анионы, ОН-. Электролиты получают ионы одновременно из нейтральных молекул и атомов, процесс проходит под совместным действием кислотных и генеральных качеств вещества. В этом случае проводящие смеси имеют название амфолитов.
Гидроксиды элементов и их сцеплений из таблицы Менделеева, которые относятся к амфотерным соединениям:
- элементы головных подгрупп (алюминий, бериллий, сурьма, галлий, селен, мышьяк);
- участники дополнительных подвидов (вольфрам, цинк, молибден).
Чаще всего вещества проявляют одно из взаимодействий, которое изменяет характер при перемене условий. Например, происходят процессы ионизации азотной кислоты, при этом получаются нитрозильные анионы и нитрит-катионы, в качестве амфолита выступает вода.
Амфотерность рассматривается в виде способности проводящего вещества быть донором и акцептировать протоны в рамках протеолитической концепции Бренстеда и Лоури. В этом случае вода проявляет свойства самоионизации в форме обратимой передачи молекул между жидкостями, в результате появляется одинаковое число анионов и катионов.
Амфолитами являются субстанции с содержанием структурных включений органических молекул, которые передают свойственные характеристики разного характера.
Такие вещества представлены пептидами, белками и аминокислотами. Эти группы частично ионизируются при помещении в раствор.
Молекулы и частицы аминокислот имеют равновесные состояния:
- заряженная (цвиттер-ион);
- незаряженная форма.
В этих случаях вещество представлено кислотой (воспроизводят катионы) и протоны или работает по основному свойству и акцептирует катионы и протоны.
Характеристики гидроксидов
Способность амфотерного элемента проявляется и в форме взаимодействия с кислотами и основаниями.

Так ведут себя оксиды, комплексные соединения, гидроксиды и отдельные р-элементы на средней стадии окисления. Для неорганических связей с присутствием гидроксильной группы ОН такое взаимодействие является общей характеристикой.
Традиционная теория об амфотерности гидроксидов в процессе разложения на ионы по основному и кислотному виду не подтверждается. Амфотерное поведение гидроксидов заключается в реакции обмена частицами среды с молекулами, имеющими связь с акцепторным центром. Гидроксиды обладают особенностью выделять соль и по-разному взаимодействовать в кислотной среде и растворе щелочи.
В первом случае они действуют по типу оснований, а вторая среда заставляет проявлять реакцию кислот.
Амфотерность гидроксидов и оксидов проявляется в продуцировании 2 рядов солей. Двойственность свойств используется при проведении качественного анализа и отделения веществ с подобными характеристиками от других элементов. Интервал появления осадка проявляется узким промежутком, поэтому внимание уделяется тщательности регулировки растворной среды.
Номенклатура и химические особенности
На особом положении в ряду амфотерных элементов находится алюминий, он стоит на границе между кислотами и основаниями. Это ведет к его диссоциации по двум типам поведения.
Амфотерные металлы и неметаллы обладают свойствами:
- гидроксиды слабо растворяются в водной среде, поэтому не способствуют приобретению водой основных или кислотных характеристик;
- оксид-гидроксиды имеют особенности, типичные для электроположительных веществ;
- гидроксиды активных металлических групп чаще проявляют характеристики акцепторов элементарных частиц;
- по мере перехода к неметаллам свойства переходят от типичных оснований к амфотерным связкам, т. е. вещества выступают донорами протонов;
- в категории основных гидроксидов с положительными катионами существует ионная спайка, а кислород присоединяется к водороду с помощью ковалентной связи;
- в группе кислотных оксидов кислород имеет ковалентную связь с положительными электрочастицами, а с водородом соединяется полярной сцепкой ионов.
Гидроксиды с двойственными свойствами имеют физические промежуточные характеристики, доказать амфотерность можно на примере взаимодействия комплексных соединений из списка веществ 3 периода таблицы Менделеева.

В химии свойства однотипных сульфидов и оксидов, а также гидросульфитов и гидроксидов имеют разную реакцию в пределах отличающихся периодов. Свойство оснований проявляют сульфиды типичных металлов, а кислотные характеристики присутствуют в бинарных соединениях неметаллических субстанций. Различие химического происхождения наблюдается при обменной реакции между действующим веществом и растворителем, а также во взаимодействии сульфидов друг с другом.
Амфотерность гидроксидов металлических элементов объясняется тем, что в воде вещество распадается на отдельные ионы водорода по кислотному виду, а образование гидроксильных ионов проходит по типу основы.
Степени окисления
У некоторых веществ наблюдается несколько ступеней окисления, поэтому амфотерные свойства гидроксидов и оксидов подлежат разной классификации. Вещества с низкими окислительными характеристиками тяготеют к группе оснований, а сам элемент обладает свойствами металла, поскольку содержится в категории катионов. Субстанции с высокой степенью окисления являются участниками кислотных групп и проявляют неметаллические показатели, так как представляют собой анионы.
Например, у гидроксида и оксида марганца (2) главными являются основные свойства, а сам элемент входит в категорию катионов. У разновидности марганца (Vil) преобладают показатели кислоты, а само вещество относится к анионовой группы (тип МПО4).
Свойства оксидов и гидроксидов проявляются в зависимости от характеристики металла. Для элементов подвида бора (исключается таллий) типичной является 3-я степень перехода заряженных частиц от донора-восстановителя к окислительному акцептору. В результате свойства основания для элемента ослабляются.
При переходе к 3 группе встречаются вещества, которые образуют кислоты и неорганические кислоты. Последние обладают сочетанием химических и физических показателей, характерных для кислот и являются типовыми для многих элементов, за исключением щелочноземельных и щелочных металлов.

Рост свойств основного вещества происходит при увеличении радиуса движения ионов. Некоторые субстанции имеют почти одинаковую степень диссоциации с получением ионов, а у других аморфные показатели выражаются слабо.
В соединениях развитие основных свойств происходит медленно. Это объясняется тем, что атомы веществ 3 группы представляют собой аналоги с характерным строением внешней оболочки по типу благородных газов. Другие субстанции отличаются наружным слоем атома в форме электронной оболочки с 10 электронами. В таблице после алюминия наблюдается увеличение радиусов ионов, отмечается диагональное сходство, что ведет к постепенному усилению основных характеристик.
Процессы при диссоциации
В некоторых случаях амфотерные характеристики металлических гидроксидов проявляются не только в водной среде, но под действием кислотного и щелочного раствора. Если в случае с кислотой при продуцировании нейтральных частиц выделяется вода и появляется ион металла (свойство основания), то в щелочной среде не происходит отщепление протона.
При тяготении азота к висмуту степень окисления стабилизируется и усиливаются показатели основного характера. Такие соединительные субстанции выполняют одновременно окислительные и восстановительные функции. Двойственный процесс объясняется ионизацией молекулы воды, которая располагается во внутренней сфере, а протон перемещается к иону ОН.
В этом случае затрудняется определение развитости кислотных и основных показателей вещества, так как оно не имеет в составе подвижного водородного атома.
В результате из бокситов получаются другие элементы, что служит показателем использования химических характеристик при разделении. Метод основывается на применении свойства амфотерности алюминия. К этому же разряду относится выделение магния из воды морей и океанов.
Реакции взаимного действия с расплавами щелочей и кислотами ведут к появлению молекул воды и соли, а в результате степень окисления остается неизменной.
Двойственные показатели
Ионный потенциал вещества увеличивается в результате проявления двойственного механизма при диссоциации амфотерных соединений. Например, Мл (0Н) является неуравновешенным основанием, а Мп (0Н)4 представляет собой амфотерный элемент, который в равной степени проявляет кислотные особенности. НМПО4 переходит в категорию усиленных кислот, при этом снижаются свойства основания.

Щелочная среда используется для восстановления элементов с образованием гидросолей, например, гексагидроксоалюминат натрия. Если судить о тетрагидроксиде титана, то название подчеркивает возможность взаимной реакции с кислотами. Эта же субстанция гидроокиси называется ортокислотой при характеристике ее реагирования в условиях щелочной среды.
Активные металлические соединения образовывают сильнополярные ионные связи, поэтому относятся к группе оснований. Уменьшение динамичности характера вещества изменяется в сторону кислотного реагирования: НМпО, КОН, 5с (ОН)3, Са (ОН)2, НУО3 и другие.
Амфотерные оксиды М2О3 и соответствующие им гидроксиды М (ОН)3 (при этом исключается В2О3) плохо растворяются в водном растворе.
Гидроксиды характеризуются неравномерным изменением двойственных характеристик:
- А1 (0Н)3 имеет небольшое показание в области диссоциации, как основание, и представляет собой амфотерный проводящий электролит.
- Оа (0Н)3 является дуалистическим гидроксидом с неизменной константой распада, которая характеризует вещество в качестве основания и одновременно кислоты.
- Переход от Оа (0Н)3 к Т1 (0Н)3 происходит постепенно, также равномерно изменяется реакция в сторону кислотного взаимодействия в результате увеличения металлизации.
Другие вещества
Соединение гидроксида циркония является малорастворимым в воде и проявляет устойчивость к этой среде. Вещество относится к классу полимеров с положительно заряженными частицами, который содержит периодические цепи, расположенные в клеточном порядке. Материал не реагирует на основания, восстановительных и окислительных агентов.

В кислых растворах гидроксид циркония переводит анионы С1, НО3, СГО4, 8Ог на ионы ОН. Увеличение температурных показателей почти не сказывается на скорости обмена. В случае с цирконием не происходит образование определенных гидратов, термогравиметрические измерения показывают осадок полимерных частиц с образованием структурного слоя.
Германий находится ближе к группе металлов и образовывает связи, в которых его степень окисления расценивается по 2 категории. Соединения являются менее прочными, по сравнению с контактами германиевого аналога свинцовой группы, и отличаются восстановительными характеристиками. Амфотерный гидроксид с явно выраженными кислотными свойствами соответствует черному оксиду германия, молекулы которого не растворяются в жидкости. Последний носит название германистой кислоты, а его осадочные соли — германитов.
Если элемент в зависимости от условий образовывает несколько различающихся по составу оснований, то наиболее сильным признается то, которое отличается низкой окислительной степенью.
Качества основания в таких веществах выражаются ярко. Сильной является кислота, анионы которой содержат множество кислородных атомов в случае появления у элемента нескольких кислотосодержащих соединений.
