Какие неорганические соединения проявляют амфотерные свойства
Амфотерность (от др.-греч. амфотеро — «двойственный»,
«обоюдный») — способность некоторых соединений проявлять в зависимости от
условий как кислотные, так и основные свойства.
Понятие амфотерность как характеристика
двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л.
Тенаром.
Амфотерными называются
оксиды и гидроксиды, которые проявляют и основные и кислотные свойства в
зависимости от условий.
Наиболее
часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды):
ZnO,
Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO,
Sn(OH)2, Al2O3, Al(OH)3, Fe2O3,
Fe(OH)3, Cr2O3, Cr(OH)3
Свойства амфотерных соединений
запомнить не сложно: они взаимодействуют с
ОСНОВНЫЕ СВОЙСТВА
При взаимодействии с кислотами все просто. Амфотерные соединения ведут себя как основания:
Оксиды:
Al2O3 + 6HCl =
2AlCl3 + 3H2O;
ZnO + H2SO4 = ZnSO4 +
H2O;
BeO + HNO3 = Be(NO3)2 +
H2O
Гидроксиды:
Fe(OH)3 + 3HCl = FeCl3 +
3H2O;
Pb(OH)2 + 2HCl = PbCl2 +
2H2O
Таким образом, при описании основных свойств записывают хорошо знакомые уравнения реакций обмена.
КИСЛОТНЫЕ СВОЙСТВА
Сложней для понимания реакция со щелочью. Рассмотрим на примере взаимодействия гидроксида цинка с гидроксидом калия при сплавлении. Амфотерные соединения взаимодействуя с основаниями, ведут себя как кислоты. Вот и запишем гидроксид
цинка Zn(OH)2 как
кислоту. У кислоты водород спереди, вынесем его: H2ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он –
кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + H2ZnO2(тв.) = K2ZnO2 + 2H2O
Полученное
вещество K2ZnO2 называется метацинкат калия (или просто
цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H2ZnO2 (солями такие соединения называть не совсем правильно, но
для собственного удобства мы про это забудем).
Гидроксид цинка записывать в виде H2ZnO2 не принято. Пишем как обычно Zn(OH)2,
но подразумеваем (для собственного удобства), что это кислота H2ZnO2:
2KOH(тв.) + Zn(OH)2(тв.)
= K2ZnO2 + 2H2O
С гидроксидами при сплавлении, в которых
2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) =Na2BeO2 + 2H2O (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) = Na2PbO2 + 2H2O (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя OH— группами (Al(OH)3, Cr(OH)3, Fe(OH)3) немного
иначе.
Разберем
на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH = H2O + KAlO2
(метаалюминат калия, или просто алюминат)
Но гидроксид алюминия HAlO2 записывать нельзя, записываем как обычно, но подразумеваем кислоту HAlO2:
Al(OH)3(тв.) + KOH(тв.) = 2H2O + KAlO2 (метаалюминат калия)
То
же самое и с гидроксидом хрома (при сплавлении):
Cr(OH)3 → H3CrO3 → HCrO2;
Cr(OH)3(тв.) + KOH(тв.) = 2H2O + KCrO2
(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли
хромовой кислоты).
*С гидроксидами содержащими четыре группы
ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3;
Pb(OH)4 → H4PbO4 → H2PbO3
Следует
помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью
окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4,Pb(OH)4).
Оксид | Гидроксид | Гидроксид в виде | Кислотный остаток | Соль | Название соли |
BeO | Be(OH)2 | H2BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
ZnO | Zn(OH)2 | H2ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
SnO | Sn(OH)2 | H2SnO2 | SnO22- | K2SnO2 | СтаннИТ |
PbO | Pb(OH)2 | H2PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
SnO2 | Sn(OH)4 | H2SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
PbO2 | Pb(OH)4 | H2PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ |
* Выше было рассмотрено взаимодействие амфотерных соединений с твердыми щелочами при сплавлении, т.е. в отсутствии воды. При взаимодействии с растворами щелочей образуются комплексные соединения:
Al(OH)3 + KOH → K[Al(OH)4]
(тетрагидроксоалюминат калия);
Al(OH)3 + 3KOH → K3[Al(OH)6]
(гексагидроксоалюминат калия).
С растворами щелочей реагируют и амфотерные оксиды. Следует обратить внимание, что в уравнении реакции вода записывается, как исходное вещество, т.е. в левой части уравнения:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4];
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6].
Продукты реакций относятся к классу солей и являются растворимыми. Следовательно, при диссоциации распадаются на катион металла и анионы кислотных остатков
[Al(OH)4]- или [Al(OH)6]3-.
Какой продукт писать, не имеет значения. Главное чтобы все индексы были верно проставлены и сумма всех зарядов равнялась нулю.
ПЕРЕХОДНЫЕ МЕТАЛЛЫ
Элементы, образующие амфотерные оксиды и гидроксиды, относятся к металлам. Они как все металлы реагируют с разбавленными кислотами:
2Al + 6HCl = 2AlCl3 + 3H2;
Zn + H2SO4 = ZnSO4 + H2
Наиболее активные металлы, образующие амфотерные оксиды и гидроксиды (алюминий, берилий, цинк), реагируют со щелочами:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑;
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
ТРЕНИРУМСЯ!!!
Амфотерные гидроксиды
Амфотерные оксиды
Химические свойства амфотерных гидроксидов
Химические свойства амфотерных оксидов
ОТВЕТЫ НА ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ ПО ХИМИИ
БИЛЕТ №1
Вопрос 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете теории строения атома. Значение периодического закона для развития науки.
Ответ. В 1869 г. Д. И. Менделеев сформулировал периодический закон. Современная формулировка этого закона звучит так: «Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер их атомов (величины атомных масс элементов)».
Периодическая система химических элементов – это графическое изображение пародического закона. Она представлена в виде таблицы, содержащей 7 периодов, 10 рядов и 8 групп элементов. Каждая группа состоит из двух подгрупп – главной и побочной.
Для элементов, объединенных в одну группу, характерны следующие закономерности:
1. Высшая валентность элементов в соединениях с кислородом соответствует номеру группы (исключение: медь может быть и двухвалентной).
2. В главных подгруппах с увеличением относительных атомных масс (при движении сверху вниз) усиливаются металлические свойства элементов и ослабевают неметаллические.
3. При движении по периоду слева направо усиливаются неметаллические свойства и ослабевают металлические.
Порядковый номер химического элемента (Z) совпадают с зарядом ядра его атома.
Для атома 1939K (А – массовое число): Z = 19 (число протонов) и N=A-Z=39-19=20 (число нейтронов).
Сущность периодичности состоит в том, что при возрастании положительных зарядов ядер атомов химических элементов наблюдается периодическое повторение химических элементов с одинаковым числом валентных (внешних) электронов. Этим объясняется периодическая повторяемость свойств элементов и их соединений.
Значение периодического закона
1. Закон сыграл большую роль в создании современной теории строения атома, которая подтвердила его положения.
2. Явление периодичности в изменении свойств химических элементов было объяснено электронными структурами атомов.
3. Возрастание числа химических элементов в периодах (2-8, 18-32) привело ученых к мысли о заполнении энергетических уровне соответствующим числом электронов.
4. На основе периодического закона удалось предсказать и открыть заурановые элементы.
5. Периодический закон и периодическая система химических элементов имели большое значение для открытия радиоактивных изотопов и областей их применении.
6. В периодическом законе и периодической системе химических элементов ярко проявляются общие законы развития природы:
• закон перехода количества в качество,
• закон единства и борьбы противоположностей,
• закон отрицания отрицания.
Вопрос 2. Амфотерность неорганических и органических соединений.
Ответ. Амфотерные элементы – элементы, оксиды и гидроксиды которые проявляют амфотерные свойства.
К амфотерным элементам относятся: алюминий, цинк, хром, желез, марганец и др.
Амфотерные оксиды – это оксиды элементов, проявляющие свойства, характерные и для основных оксидов
Al2O3 + 2NaOH сплавление2NaAlO2 + H2O,
(твердый) алюминат натрия
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Амфотерные гидроксиды – гидроксиды, проявляющие свойства, характерные и для кислот, и для оснований:
Al(OH)3 + 3HCl = AlCl3 +3H2O (Al(OH)3 как основание),
Al(OH)3 +NaOH + 2H 2O = Na[Al(OH) 4(H 2O) 2) ] (Al(OH)3 как кислота).
Чем выше степень окисления элемента, тем более сильные кислотные свойства проявляют его оксиды (например, хром).
Среди органических соединений амфотерными свойствами обладают аминокислоты благодаря наличию двух функциональных групп:NH2 (аминогруппа) и СООH (карбоксильная группа).
Для аминокислот характерны свойства, присущие аминам и карбоновым кислотам.
1. Свойства кислоты:
а) взаимодействие с металлом:
2NH2CH2COOH + 2Na = 2NH2CH2COONa + H2 ↑;
б) взаимодействие с оксидом металла:
2NH2CH2COOH + MgO = (NH2CH2COO)2 Mg + H2O;
в) взаимодействие с основанием:
NH2CH2COOH + NaOH = NH2CH2COONa + H2O;
г) взаимодействие с солью:
2NH2CH2COOH + Na2CO3 = 2NH2CH2COONa + H2O + CO2↑;
д) реакция этерификации:
t
NH2CH2COOH + HOC2H5 = NH2CH2COOC2H5 + H2O.
2. Свойства (как амин):
NH2CH2COOH + HCl = Cl- [+NH2CH2COOH] .
3. Поликонденсация(взаимодействие друг с другом):
NH2CH2COOH + H2NCH2COOH = NH2CH2 CONH CH2COOH + H2O;
пептидная группа
дипептид ɑ- аминоуксусной кислоты
Вопрос 3. Получите углекислый газ и докажите его наличие.
Ответ.
Получение
CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑,
мрамор
CaCO3 + 2H+ + Сl- = Ca2+ + 2Cl- + H2O + CO2 ↑,
CaCO3 + 2H+ = Ca2+ + H2O + CO2 ↑,
Доказательство
Сa(OH)2 +CO2 = CaCO3↓ + H2O
(осадок белого цвета)
При длительном пропускании углекислого газа через известковую воду осадок CaCO3 растворяется вследствие образования хорошо растворимой соли – гидрокарбоната кальция Ca(HCO3)2:
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Оборудование и реактивы: мрамор, прибор для получения газов, соляная кислота (раствор), известковая вода, штатив с пробирками.
БИЛЕТ № 2
Вопрос 1. Многоатомные спирты, их строение свойства и применение.
Ответ.Многоатомные спирты – органические соединения, содержащие несколько гидроксильных групп, соединенных углеводородным радикалом.
CH2(OH) – CH2(OH) – этандиол-1,2, или этиленгликоль (двухатомный спирт),
CH2(OH)–CH(OH)–CH2(OH) – пропантриол-1,2,3, или пропиленгликоль, или глицерин (трехатомный спирт).
Физические свойства
Вязкие, сиропоподобные жидкости, без цвета и запаха, сладковатого вкуса, хорошо растворимые в воде. Температура кипения этиленгликоля – 197,6 ̊С, глицерина – 290 ̊С. Этиленгликоль – яд!
Химические свойства
1. Взаимодействие со щелочными металлами:
CH2(OH)CH2(OH) + 2Na = CH2(ONa)CH2(ONa) + H2↑.
2. Взаимодействие с галогеноводородами:
CH2(OH)CH2(OH) + 2HCl = CH2ClCH2Cl + 2H2O.
дихлорэтан
3. Нитрование:
CH2(OH)CH(OH)СH2(OH) + 3HNO3 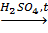 CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O. нитроглицерин
CH2(ONO2)CH(ONO2)CH2(ONO2) + 3H2O. нитроглицерин
4. Качественная реакция на глицерин:
2CH2 (OH)CH(OH)CH2(OH) + Cu(OH)2
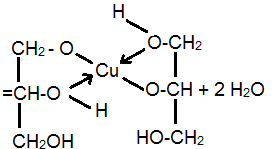
глицерат меди(II)
(раствор ярко-синего цвета)
Получение
1. 3С2H4 + 2KMnO4 + 4H2O = 3CH2(OH)CH2(OH) + 2MnO2 + 2KOH.
2. CH2ClCH2Cl + 2NaOH = CH2(OH)CH2(OH) + 2NaCl.
3. 2C2H4 + O2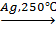 2H2C – CH2,
2H2C – CH2,
/
O
этиленоксид
H2C – CH2 + H2O = CH2(OH)CH2(OH)
/
O
4. CH3CHCH2 + O2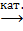 CH2CHCHO + H2O,
CH2CHCHO + H2O,
акролен
CH2CHCHO + H2 = CH2CHCH2OH,
аллиловыйспирт
CH2CHCH2OH + H2O2 = CH2(OH)CH(OH)CH2(OH).
Применение
1. В производстве антифризов (веществ, понижающих температуру замерзания растворов).
2. В производстве лекарств (глицерин).
3. В производстве искусственного волокна.
4. В производстве взрывчатых веществ (глицерин).
5. В производстве алкогольных напитков.
6. В парфюмерии (глицерин).
7. Как смягчитель кожи и тканей (глицерин).
Перед изучением этого раздела рекомендую изучить следующие темы:
Классификация неорганических веществ
Классификация оксидов, способы их получения
Химические свойства основных оксидов
Химические свойства кислотных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
Например, оксид алюминия взаимодействует с соляной кислотой, оксидом серы (VI), но не взаимодействует с углекислым газом и кремниевой кислотой:
амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный оксид + кислотный оксид = соль
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + CO2 ≠
Al2O3 + H2SiO3 ≠
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
- Сначала записываем центральный атом-комплекообразователь (это, как правило, амфотерный металл).
- Затем дописываем к центральному атому лиганды — гидроксогруппы. Число лигандов в 2 раза больше степени окисления центрального атома (исключение — комплекс алюминия, у него, как правило, 4 лиганда-гидроксогруппы).
- Заключаем центральный атом и его лиганды в квадратные скобки, рассчитываем суммарный заряд комплексного иона.
- Дописываем необходимое количество внешних ионов. В случае гидроксокомплексов это — ионы основного металла.
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
Степень окисле-ния +2 (Zn, Sn, Be) | Соль состава X2YO2*. Например: Na2ZnO2 | Комплексная соль состава Х2[Y(OH)4]*. Например: Na2[Zn(OH)4] |
| Степень окисле-ния +3 (Al, Cr, Fe) | Соль состава XYO2 (мета-форма) или X3YO3 (орто-форма). Например: NaAlO2 или Na3AlO3 | Na3[Al(OH)6] или Na[Al(OH)4 Комплексная соль состава Х3[Y(OH)6]* или реже Х[Y(OH)4]. Например: Na[Al(OH)4] |
* здесь Х — щелочной металл, Y — амфотерный металл.
Исключение — железо не образует гидроксокомплексы в растворе щелочи!
Например:
амфотерный оксид + щелочь (расплав) = соль + вода
Al2O3 + 2NaOH = 2NaAlO2 + H2O
амфотерный оксид + щелочь (раствор) = комплексная соль
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]

4. Амфотерные оксиды взаимодействуют с основными оксидами.
При этом взаимодействие возможно только с основными оксидами, которым соответствуют щелочи и только в расплаве. В растворе основные оксиды взаимодействуют с водой с образованием щелочей.
амфотерный оксид + основный оксид = соль + вода
Al2O3 + Na2O = 2NaAlO2
5. Окислительные и восстановительные свойства.
Амфотерные оксиды способны выступать и как окислители, и как восстановители и подчиняются тем же закономерностям, что и основные оксиды. Окислительно-восстановительные свойства амфотерных оксидов подробно рассмотрены в статье про основные оксиды.
6. Амфотерные оксиды взаимодействуют с солями летучих кислот.
При этом действует правило: в расплаве менее летучие кислоты и их оксиды вытесняют более летучие кислоты и их оксиды из их солей.
Например, твердый оксид алюминия Al2O3 вытеснит более летучий углекислый газ из карбоната натрия при сплавлении:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<.p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
