Какие кислоты могут содержаться в дождевой воде
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 июля 2018;
проверки требуют 14 правок.
Скульптура, пострадавшая от кислотного дождя
Кисло́тный дождь — все виды метеорологических осадков — снег, дождь, град, туман, дождь со снегом, — при которых наблюдается понижение водородного показателя (pH) дождевых осадков из-за загрязнений воздуха кислотными оксидами, обычно оксидами серы и оксидами азота[1].
История термина[править | править код]
Впервые термин «кислотный дождь» был введен в 1872 году английским учёным Робертом Смитом в книге «Воздух и дождь: начало химической климатологии». Его внимание привлёк смог в Манчестере. Кислотные дожди являются одной из причин гибели лесов, урожаев и растительности, а также одной из причин разрушения зданий и памятников культуры, трубопроводов, приводят в негодность автомобили, понижают плодородие почвы и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Вода обычного дождя тоже представляет собой слабокислый раствор. Это происходит вследствие того, что природные вещества атмосферы, такие как углекислый газ, вступают в реакцию с дождевой водой. При этом образуется слабая угольная кислота, тогда как в идеале pH дождевой воды равняется 5,6—5,7. В реальной жизни показатель кислотности дождевой воды в одной местности может отличаться от показателя кислотности дождевой воды в другой местности. Это прежде всего зависит от состава газов, содержащихся в атмосфере той или иной местности, таких как оксид серы и оксиды азота.
В 1883 году шведский учёный Сванте Август Аррениус ввел в обращение два термина — кислота и основание. Он назвал кислотами вещества, которые при растворении в воде образуют свободные положительно заряженные ионы водорода. Основаниями он назвал вещества, которые при растворении в воде образуют свободные отрицательно заряженные гидроксид-ионы. Водородный показатель является взятым с обратным знаком десятичным логарифмом активности ионов водорода в растворе и его используют в качестве показателя кислотности воды.
Химические реакции[править | править код]
Даже нормальная дождевая вода имеет слабокислую реакцию из-за наличия в воздухе диоксида углерода. Кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как диоксиды серы (SO2 и SO3) и различными оксидами азота. Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий, тепловых электростанций, а в естественных условиях — вулканами.
Соединения серы, сульфиды, самородная сера и другие содержатся: в углях и в руде (особенно много сульфидов в бурых углях, при сжигании или обжиге которых образуются летучие соединения — оксид серы(IV) (сернистый ангидрид), оксид серы(VI) (серный ангидрид), сероводород — (образуется в малых количествах при недостаточном обжиге или неполном сгорании, при низкой температуре). Различные соединения азота содержатся в углях, и особенно в торфе (так как азот, как и сера, входит в состав биологических структур, из которых образовались эти полезные ископаемые).
При сжигании таких ископаемых образуются оксиды азота (например, оксид азота, вступая в реакцию с водой атмосферы, под воздействием солнечного излучения, или так называемых «фотохимических реакций»), которые превращаются в растворы кислот — серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю.
Кислоты реагируют с карбонатом кальция (CaCO3), из которого построены многие известные достопримечательности, например, великая пирамида Гизы (Египет), в связи с чем они разрушаются.
Экологические и экономические последствия[править | править код]
Лес после кислотного дождя
Последствия выпадения кислотных дождей наблюдаются во многих странах земного шара.
Кислотный дождь оказывает отрицательное воздействие на водоёмы — озера, реки, заливы, пруды — повышая их кислотность до такого уровня, что в них погибает флора и фауна.
Выделяют три стадии воздействия кислотных дождей на водоёмы:
| Первая стадия | с увеличением кислотности воды (показатели рН меньше 7) водяные растения начинают погибать, лишая других животных водоёма пищи, уменьшается количество кислорода в воде, начинают бурно развиваться водоросли (буро-зеленые). Первая стадия эутрофикации (заболачивания) водоема. При кислотности рН 6 погибают пресноводные креветки. |
| Вторая стадия | кислотность повышается до рН 5,5, погибают донные бактерии, которые разлагают органические вещества и листья, и органический мусор начинает скапливаться на дне. Затем гибнет планктон — крошечное животное, которое составляет основу пищевой цепи водоема и питается веществами, образующимися при разложении бактериями органических веществ. |
| Третья стадия | кислотность достигает рН 4,5, погибает вся рыба, большинство лягушек и насекомых. |
Первая и вторая стадии обратимы при прекращении воздействия кислотных дождей на водоем.
По мере накопления органических веществ на дне водоёмов из них начинают выщелачиваться токсичные металлы. Повышенная кислотность воды способствует более высокой растворимости таких опасных металлов, как кадмий, ртуть и свинец из донных отложений и почв.
Эти токсичные металлы представляют опасность для здоровья человека. Люди, пьющие воду с высоким содержанием свинца или принимающие в пищу рыбу с высоким содержанием ртути, могут приобрести серьёзные заболевания.
Кислотный дождь наносит вред не только водной флоре и фауне. Он также уничтожает растительность на суше. Учёные считают, что хотя до сегодняшнего дня механизм до конца ещё не изучен, «сложная смесь загрязняющих веществ, включающая кислотные осадки, озон и тяжёлые металлы, в совокупности приводит к деградации лесов»[2].
Экономические потери от кислотных дождей в США, по оценкам одного исследования[какого?], составляют ежегодно на восточном побережье 13 миллионов долларов и к концу века убытки достигнут 1,7 миллиардов долларов от потери лесов; 8,3 миллиардов долларов от потери урожаев (только в бассейне реки Огайо) и только в штате Миннесота 40 миллионов долларов на медицинские расходы.
Примечания[править | править код]
Дождевая вода, образующаяся при конденсации водяного пара, должна иметь нейтральную реакцию, т.е. рН=7,0 (pH — показатель, характеризующий кислотные или щелочные свойства раствора). Но даже в самом чистом воздухе всегда есть диоксид углерода, и дождевая вода, растворяя его, чуть подкисляется (pH 5,6-5,7). А вобрав кислоты, образующиеся из диоксидов серы и азота, дождь становится заметно кислым. Уменьшение pH на одну единицу означает увеличение кислотности в 10 раз, на две — в 100 раз и т.д. Мировой рекорд по кислотности осадков принадлежит шотландскому городку Питлок-ри, где 20 апреля 1974 г. выпал дождь с pH 2,4.[ …]
Воду для приготовления питательного раствора берут чистую, мягкую, без каких-либо примесей, лучше дистиллированную или дождевую. Сам питательный раствор, готовый к употреблению, должен иметь температуру, одинаковую с температурой воздуха помещения, в котором растут декоративные растения (16-2СГС). Необходимо периодически определять кислотность (pH) раствора. Для нормального развития растений кислотность может колебаться от 4,8 до 6,6.[ …]
Кислотные и щелочные свойства дождевой воды и аэрозольного вещества определяются наличием в растворах свободных ионов водорода Н+ или ОН-, образующихся при диссоциации кислот и оснований. В естественных условиях дождевые осадки имеют нейтральный .или слабо кислотный характер, что зависит от количества растворенных солей естественного происхождения и от количества растворенной двуокиси углерода.[ …]
Кислотные дожди — следствие нарушения круговорота веществ между атмосферой, гидросферой и литосферой. Кислотность измеряется показателем pH, который выражается десятичным логарифмом концентрации водородных ионов. Облачная и дождевая вода в нормальных условиях должна иметь pH = 5,6 … 5,7. Это зависит от растворения в ней атмосферного С02 с образованием слабой угольной кислоты. Но вот уже десятки лет над Северной Америкой и Европой выпадают дожди с содержанием в них кислот в десятки, сотни, тысячи раз большими. По содержанию кислоты современные дояеди соответствуют сухому вину, а часто и столовому уксусу.[ …]
В образовании кислотных дождей участвуют также продукты жизнедеятельности растений, природные газы, выходящие из почвы, продукты горения биомассы (например, при лесных пожарах). Как известно, кислотность измеряется показателем pH. При нормальных условиях облачная или дождевая вода имеет pH = 5,6—5,7.[ …]
Еще 200 лет назад дождевая и снеговая вода была практически нейтральной, тогда как в настоящее время она стала слабым раствором серной и азотной кислот. Осадки с pH [ …]
Для отвода сточных вод от производства магнитной ленты имеются три сети канализации: производственно-дождевых, кислотных и бытовых стоков.[ …]
Для отведения сточных вод от производства триацетата целлюлозы имеются три сети канализации; кислотно-щелочных, бытовых и производственно-дождевых стоков.[ …]
Для отведения сточных вод метизного производства могут служить четыре канализационные сети: производственно-дождевых, кислотных, масло-окалиносодержащих и бытовых стоков.[ …]
Если вы знаете, какова кислотность почвы на вашем участке, — прекрасно, если нет, то ее можно определить с помощью индикаторной бумаги. Для этого по диагонали участка выкапывают ямы иа глубину пахотного горизонта и берут пробы земли. Пробы хорошо перемешивают, увлажняют дистиллированной или дождевой водой и сжимают в руке вместе с полоской индикаторной бумаги. В зависимости от кислотности почвы бумага будет изменять свой первоначальный цвет. Сравнивая полученную окраску со стандартной цветной шкалой, можно узнать кислотность почвы.[ …]
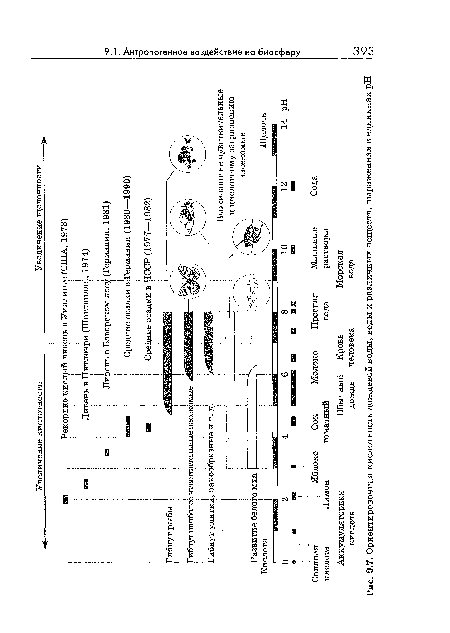
| Ориентировочная кислотность дождевой воды, воды и различных веществ, выраженная в единицах pH |  |
Оксиды серы и азота, растворяясь в дождевой воде, образуют кислоты и выпадают в виде кислых (кислотных) дождей.[ …]
Как уже отмечалось, в начале и первой половине XX века величина pH дождевой воды в Европе не опускалась ниже 5,0 и в среднем составляла 5,5. Резкое уменьшение водородного показателя проб атмосферных осадков и расширение зоны, охваченной кислотными осаждениями, приходится на вторую половину 1950-х годов.[ …]
Поскольку все продукты приведенных выше реакций хорошо растворимы в воде, они легко вымываются дождевой водой из атмосферы, создавая кислотные осадки.[ …]
Канализация предусматривается четырьмя сетями: шламовых стоков, минеральных кислотно-щелочных, производственно-дождевых и бытовых стоков. Шламовые сточные воды со стадии очистки рассола направляются в проточный шламона-копитель, в котором шлам задерживается, а осветленная вода сбрасывается в водоем.[ …]
Специалисты американского Университета штата Северная Каролина изучили воздействие, оказываемое кислотными дождями на растения в период их максимальной восприимчивости к факторам внешней среды. Под влиянием кислотных дождей непосредственно после опыления в початках кукурузы формировалось меньше зерен, чем при орошении чистой водой. Причем чем больше в дождевой воде содержалось кислоты, тем меньше зерен образовывалось в початках. Вместе с тем выяснилось, что кислотные дожди, прошедшие до опыления, не оказывали заметного влияния на формирование зерен.[ …]
Если какая-то часть Ы02 за счет рассеивания в атмосфере достигнет ’’сухопутной” территории, то при наличии дождевых осадков образуется азотная кислота, а значит в дождевой воде будут присутствовать оины Ж)3 . В обоих случаях вторичные загрязнители будут попадать и в морской бассейн,г и на растительность, и в почву суши. Поскольку море не представляет собой замкнутую водную систему, то за счет быстрого обмена в нем воды будет сохраняться буферное его противодействие загрязнителям. Более опасными последствия от воздействия кислотных осадков представляются для бесточных (замкнутых) водных систем. Свидетельством сказанному является факт закисления 20,.тысяч озер (из 90 тысяч) в Швеции, а в значительном числе озер в Норвегии практически отсутствует жизнь. Эти озера, как правило, были бесточные. Повышение кислотности воды в пресноводных водоемах приводит к сокращению числа видов обитающей рыбы и к увеличению загрязнения за счет растворения в такой воде тяжелых металлов. По данным зарубежных исследований, в странах Северной Европы выпадение дождей с pH, составляющим 4-5, привело к исчезновению многих видов рыбы в пресноводных бассейнах, так как повысилась кислотность воды. В озерах штата Нью-Йорка (США) величина показателя концентрации водородных ионов снизилась с 6,6-7,2 до 3,9-5,8, чтЬ нанесло ущерб 75 % рыб, там обитающих. Во многих озерах штата Онтарио (Канада) при величине pH = 4,5 исчезновение рыбы наступило с одновременным исчезновением водорослей.[ …]
Следует напомнить, что pH — это отрицательный десятичный логарифм концентрации водородных ионов, и, следовательно, вода с pH 2,7 в тысячу раз «кислее» воды с pH 5,7. В промышленных районах и в зонах атмосферного заноса окислов серы и азота pH дождевой воды колеблется от 3 до 5. Кислотные осадки особенно опасны в районах с кислыми почвами и низкой буферностью природных вод. В Америке и Евразии это обширные территории севернее 55° с. ш. Техногенная кислота, помимо прямого негативного действия на растения, животных и микрофлору увеличивает подвижность и вымывание почвенных катионов, вытесняет из карбонатов и органики почвы углекислый газ, закисляет воду рек и озер. Это приводит к неблагоприятным цепным изменениям в водных экосистемах. Природные комплексы Южной Канады и Северной Европы уже давно ощущают действие кислых осадков.[ …]
Деятельность человека, проявляющаяся в сжигании ископаемого топлива и плавлении сернистых руд, привела к заметным изменениям в кислотности осадков. Оксиды азота, серы, хлор, выделяемые в процессе технологической деятельности, преобразуются в сильные кислоты в атмосфере и возвращаются на землю с осадками. Эти сильные кислоты при таянии снежного покрова или разбавлении дождевой водой понижают pH атмосферных осадков ниже 5,6. Усиливается вымывание Са, Мд, К и других химических элементов из склоновых почв в результате поверхностного стока талых и ливневых вод. При этом, как полагает В.А. Ковда (1981), наблюдается активизация и мобилизация А1, Ре, Мд и связывание Р. Такие изменения заметно снижают почвенное плодородие и заставляют увеличивать дозировку удобрений и усиливать известкование почв.[ …]
На предприятиях пластических масс, и полупродуктов строится несколько канализационных сетей для отвода производственных сточных вод к местным очистным установкам. Раздельно отводятся и обрабатываются: кислотно-щелочные стоки, загрязненные преимущественно минеральными веществами; кислотно-щелочные с органическими веществами; химически загрязненные стоки и стоки, загрязненные в основном нерастворимыми примесями. После местной очистки сточные воды сбрасываются в канализационную сеть для отвода бытовых сточных вод и вместе с ними направляются для дальнейшей очистки. Незагрязненные стоки сбрасываются в дождевую канализацию.[ …]
Важнейшими свойствами почвы как среды обитания являются: наличие минеральных элементов питания растений и способность их удерживать, наличие воды и влагоудерживающая способность. Инфильтрация воды с поверхности и аэрация почвы зависят от ее структуры. Переуплотненные почвы становятся непригодными для роста растений. Переувлажнение почв также нарушает газообмен, а относительная кислотность и ионный состав почвенного раствора сильно влияют на жизнь организмов в почвенном слое. Почвенные экосистемы включают следующие компоненты: минеральные частицы, детрит (мертвые остатки растений и животных) и множество живых организмов — почвообразователей.[ …]
Если известно содержание учитываемых последним уравнением ионов, появляется возможность расчета концентрации ионов водорода. Реконструированная таким образом величина pH проб дождевой воды, отобранных в Европе в довоенное время, составляет в среднем 5,5. И если сейчас в Западной и Центральной Европе обычны дожди с pH [ …]
Основная часть осадков (65 — 70%) годовой суммы выпадает в теплый период. В условиях чистой атмосферы при среднем содержании С02 0,030% и температуре 10°С H.A. Шмидеберг (1990) приводит величину pH дождевых вод, равную 5,60. В загазованной атмосфере реакция среды дождевых вод становится довольно кислой (pH = 3,5 — 4,5). В работах И.С. Шатилова с соавторами (1979, 1990) и H.A. Шмидеберг (1990) приведены данные о химическом составе кислотных дождей и их влиянии на почвенный покров европейской части России. Подобные данные для Сибири отсутствуют. В случае действия кислотных дождей на почвенную систему важнее общее количество выпадающих осадков, которое способствует закислению почвы, усиливает коррозию и выветривание минералов, определяет скорость ионообменных процессов.[ …]
Совершенно иной эффект от поступления серы в виде 802 сернистой и серной кислоты. Оксид серы, проникая через устьица зеленых органов растений, вызывает снижение фотосинтети-ческой активности растений и уменьшение их продуктивности. Сернистая и серная кислоты, выпадая с дождевой водой, поражают растительность. Присутствие Б02 в количестве 3 мг/л вызывает снижение pH дождевых вод до 4 и образование «кислых дождей». Время жизни» системы 802 — Н28 04 в атмосфере изменяется от нескольких часов до 6 дней. Тем не менее за это время агрессивные соединения серы могут переноситься с воздушными массами на десятки и сотни километров от источника загрязнения и выпадать в виде «кислых дождей». Известны многочисленные случаи переноса сернокислотных атмосферных осадков из индустриальных районов ФРГ на территорию стран Скандинавии, что послужило поводом для дипломатических действий и обращения в Международный суд. Распространение осадков с повышенной кислотностью захватило также прибрежные районы Прибалтики.[ …]
С вулканическими газами в атмосферу попадают окислы серы, азота, углерода, а также хлор. Углекислый газ входит в атмосферный запас углерода, окислы азота и серы быстро вымываются дождями и попадают на почву в виде слабых растворов азотной, азотистой, серной и сернистой кислот. Вблизи действующего вулкана кислотность дождевой воды может стать опасно высокой и подавить рост и развитие растений, водных и почвенных животных. Но вдали от вулкана, а после прекращения извержения и вблизи него, эти кислоты постепенно нейтрализуются, соли азотной и азотистой кислот поглощаются растениями и их азот входит в состав белков и других азотсодержащих органических веществ. Растворимые соединения серы постепенно вымываются, а в небольших количествах сера также включается в состав белков растений, а потом и других компонентов экосистем.[ …]
Так, например, выбрасываемые химическими предприятиями как при нормальной деятельности, так и при авариях диоксид серы и окислы азота при взаимодействии с влагой атмосферы, с водяными каплями облаков и выпадающего дождя образуют растворы кислот (серной, сернистой, азотистой и азотной). В результате выпадающие метеорологические осадки (дождь, снег, град, туман, дождь со снегом), имеют pH меньше, чем среднее значение pH дождевой воды (рНсредн. = 5,6). Они именуются «кислотными дождями».[ …]
В середине XX века и особенно в его последнее двадцатилетие одной из основных причин закисления почв на обширных территориях становится хозяйственная деятельность человека. Развитие индустрии привело к выбросам в атмосферу колоссальных количеств оксидов серы, азота, углерода. Эти оксиды переносятся на значительные расстояния, взаимодействуют с атмосферной влагой и превращаются в растворы смесей сернистой, серной, азотной и угольной кислот, которые выпадают в виде «кислых дождей» на почвы, растения, поверхностные воды. По подсчетам ученых масса газов, ведущих к образованию «кислых дождей», достигает на планете 270—900 млн т в год. С каждым годом эти цифры возрастают и повсеместно, особенно в промышленных регионах, наблюдается глобальное увеличение кислотности дождевой и снеговой воды.[ …]
