Какие элементы обладают амфотерными свойствами

Амфоте́рность (от др.-греч. ἀμφότεροι «двоякий, двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство[править | править код]
Амфотерность как химическое свойство вещества может проявляться по-разному:
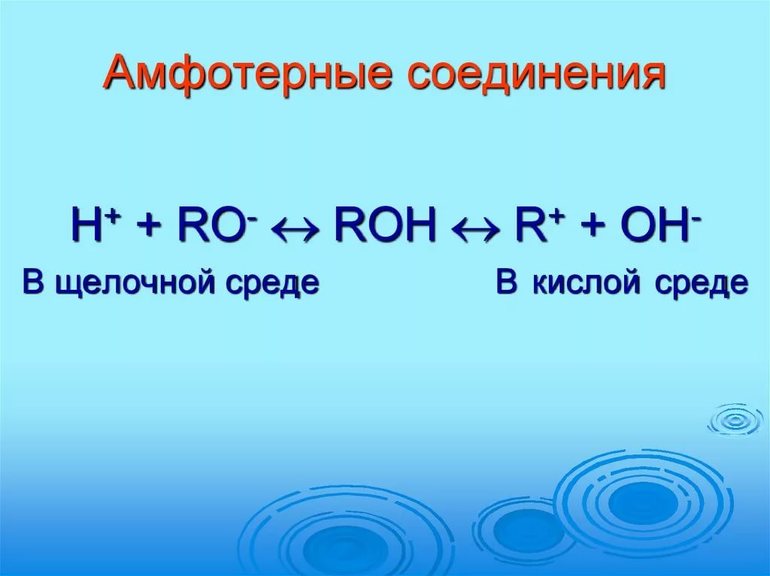
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
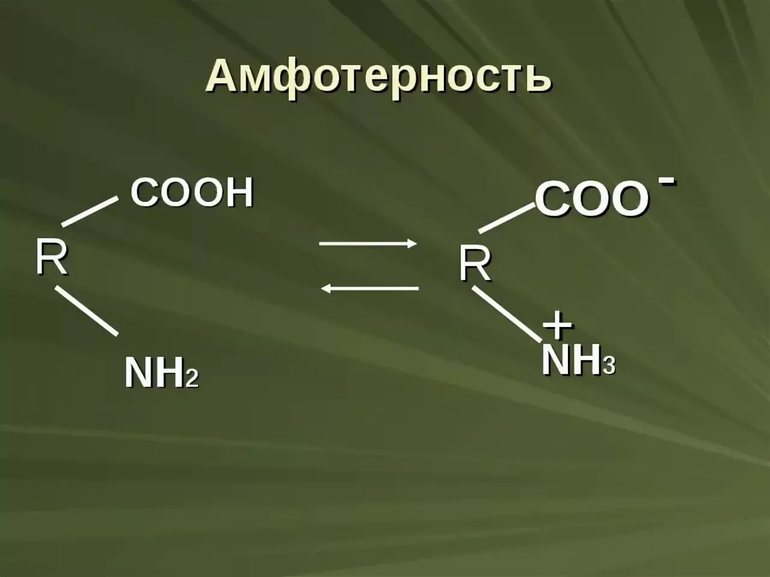
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может быть описано как реакции ионного обмена ионов среды с лигандами H2O и OH–. Например, для Al(OH)3 ионные равновесия могут быть записаны следующим образом:
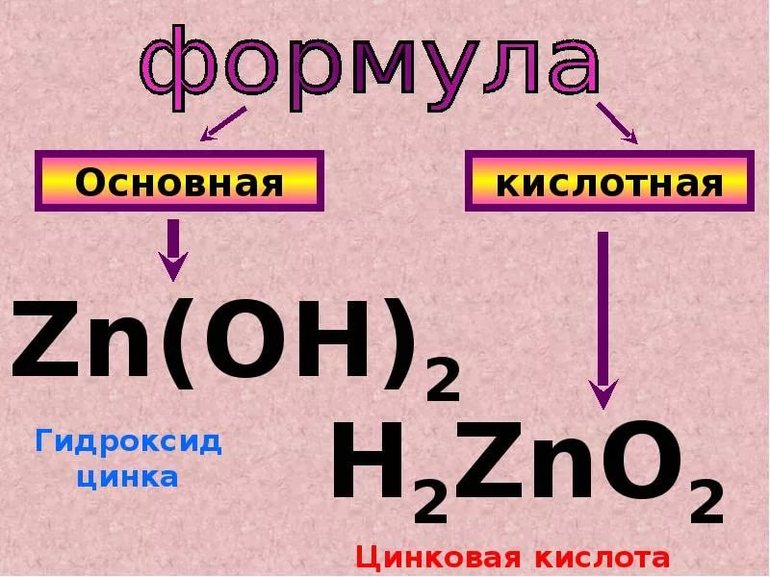
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Ссылки[править | править код]
- Амфотерный // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература[править | править код]
- Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с
Примечания[править | править код]
- ↑ Танганов Б.Б. Химические методы анализа. — Улан-Удэ, 2005.- 550 с.
- ↑ 1 2 3 Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- ↑ 1 2 Угай Я. А. Общая и неорганическая химия. — М.: Высшая школа, 1997. — 527 с.
- ↑ Автопротолиз воды / Жуков С. Т. Химия. 8-9 класс
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. – М.: Химия, 2000. – 480 с.: ил.
- ↑ Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с .
Определение
Амфотерность (от др.-греч. амфотеро — «двойственный», «обоюдный») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Понятие амфотерность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром.
А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 г.г.) предложил следующее определение:
Определение
Амфотерность — способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя.
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, то есть проявлять основные свойства.
Запомнить! Амфотерными свойствами обладают оксиды и гидроксиды
элементов главных подгрупп — бериллий, алюминий, галлий, мышьяк, сурьма, селен и др.,
элементов побочных подгрупп — хром, цинк, медь (II), железо (III), молибден, вольфрам и др.
Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер. Амфотерными свойствами обладают также некоторые органические соединения. Например, аминокислоты $(NH_2)R-COOH$, содержат в своей структуре одновременно карбоксильную группу -СООН, обуславливающую кислотные свойства, то есть являющуюся донором протона водорода, и амино-группу $NH_2$, обеспечивающую основные свойства, то есть являющуюся акцептором протонов водорода за счет неподеленной электронной пары азота.
Получение амфотерных гидроксидов
Общим способом получения амфотерных гидроксидов является осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента, например:
$ZnSO_4 + 2NaOH longrightarrow Zn(OH)_2 downarrow+ Na_2SO_4$
В ряде случаев при осаждении образуется не гидроксид, а гидрат оксида соответствующего элемента (например, гидраты оксидов железа(III), хрома(III), олова(II) и др.). Химические свойства таких гидратов по большей части аналогичны свойствам соответствующих гидроксидов.
Общие химические свойства амфотерных гидроксидов
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
1. При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
$2Fe(OH)_3 xrightarrow{150-200^0 C} Fe_2O_3 + 3H_2O$
2. При взаимодействии с кислотами образуют растворимые соли, содержащие амфотерный катион, например:
$Zn(OH)_2 downarrow + 2HCl longrightarrow ZnCl_2 + 2H_2O$
3. При взаимодействии со щёлочью образуют растворимые соли с амфотерным элементом в анионе, например:
$Zn(OH)_2 downarrow + 2NaOH rightarrow Na_2[Zn(OH)_4]$
При сплавлении со щелочами образуют средние соли с амфотерным элементом в ионе кислотного остатка:
$Zn(OH)_2 downarrow + 2NaOH xrightarrow[]{t, ^circ C} Na_2ZnO_2 + 2H_2O$
Химические свойства амфотерных гидроксидов
Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями.
Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома (III) характерны следующие реакции:
$Cr(OH)_3$ (тв) + $3HCl$ (р-р) $ longrightarrow CrCl_3$ (р-р) + $3H_2O$
$Cr(OH)_3$ (тв) + NaOH (р-р) + $2H_2O longrightarrow Na[Cr(OH)_4(H_2O)_2]$ (р-р)
$Cr_2O_3$ (тв) + 6HCl (р-р) $ longrightarrow 2CrCl_3$ (р-р) + $3H_2O$
$Cr_2O_3$ (тв) + $Na_2CO_3$ (плавл)$ longrightarrow 2NaCrO_2 + CO_2$ (газ)
Традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам не являются достаточно точными. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может быть описано как реакции ионного обмена гидратированных комплексов с ионами гидроксония и гидроксил-анионами $H_3O^+$ и $OH^–$. Например, для $Al(OH_3)$ ионные равновесия могут быть записаны следующим образом:
$[Al(OH)_3(H_2O)_3] + 3H_3O^+ leftrightarrow [Al(H_2O)_6]^{3+} + 3H_2O$ (в кислой среде)
$[Al(OH)_3(H_2O)_3] + 3OH^- leftrightarrow [Al(OH)_6]^{3-}$ (в щелочной среде)
В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка:
$ZnCl_2$ и $[Zn(H_2O)_4]SO_4$ (катионные))
$Na_2ZnO_2$ и $Na_2]Zn(OH)_4]$ (анионные).
Простые вещества сходные с металлическими элементами по структуре и ряду химических и физических параметров называют амфотерными, т.е. это те элементы, проявляющие химическую двойственность. Надо отметить, что это не сами металли, а их соли или оксиды. К, примеру, оксиды некоторых металлов могут обладать двумя свойствами, при одних условиях они могут проявлять свойства присущие кислотам, в других, они ведут себя как щелочи.
К основным амфотерным металлам относят алюминий, цинк, хром и некоторые другие.
Термин амфотерность был введен в оборот в начале XIX века. В то время химические вещества разделяли на основании их сходных свойств, проявляющиеся при химических реакциях.

Что такое амфотерные металлы
Список металлов, которые можно отнести амфотерным, достаточно велик. Причем некоторые из них можно назвать амфотерными, а некоторые – условно.

Перечислим порядковые номера веществ, под которыми они расположены в Таблице Менделеева. В список входят группы с 22 по 32, с 40 по 51 и еще много других. Например, хром, железо и ряд других можно с полным основанием называть основными, к последним можно отнести и стронций с бериллием.
Кстати, самым ярким представителем амфорных металлов считают алюминий.
Именно его сплавы в течение длительного времени используют практически во всех отраслях промышленности. Из него делают элементы фюзеляжей летательных аппаратов, кузовов автомобильного транспорта, и кухонную посуду. Он стал незаменим в электротехнической промышленности и при производстве оборудования для тепловых сетей. В отличии от многих других металлов алюминий постоянно проявляет химическую активность. Оксидная пленка, которая покрывает поверхность металла, противостоит окислительным процессам. В обычных условиях, и в некоторых типах химических реакций алюминий может выступать в качестве восстановительного элемента.
Этот металл способен взаимодействовать с кислородом, если его раздробить на множество мелких частиц. Для проведения операции такого рода необходимо использование высокой температуры. Реакция сопровождается выделением большого количества тепловой энергии. При повышении температуры в 200 ºC, алюминий вступает в реакцию с серой. Все дело в том, что алюминий, не всегда, в нормальных условиях, может вступать в реакцию с водородом. Между тем, при его смешивании с другими металлами могут возникать разные сплавы.
Еще один ярко выраженный металл, относящийся к амфотерным – это железо. Этот элемент имеет номер 26 и расположен между кобальтом и марганцем. Железо, самый распространенный элемент, находящийся в земной коре. Железо можно классифицировать как простой элемент, имеющий серебристо-белый цвет и отличается ковкостью, разумеется, при воздействии высоких температур. Может быстро начинать коррозировать под воздействием высоких температур. Железо, если поместить его в чистый кислород полностью прогорает и может воспламениться на открытом воздухе.
Такой металл обладает способностью быстро переходить в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает. Находясь на воздухе металлическое вещество, быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Свойства амфотерных металлов
Они определены самим понятием амфотерности. В типовом состоянии, то есть обычной температуре и влажности, большая часть металлов представляет собой твердые тела. Ни один металл не подлежит растворению в воде. Щелочные основания проявляются только после определенных химических реакций. В процессе прохождения реакции соли металла вступают во взаимодействие. Надо отметить что правила безопасности требуют особой осторожности при проведении этой реакции.
Соединение амфотерных веществ с оксидами или самими кислотами первые показывают реакцию, которая присуща основаниями. В тоже время если их соединять с основаниями, то будут проявляться кислотные свойства.
Нагрев амфотерных гидроксидов вынуждает их распадаться на воду и оксид. Другими словами свойства амфотерных веществ весьма широки и требуют тщательного изучения, которое можно выполнить во время химической реакции.
Свойства амфотерных элементов можно понять, сравнив их с параметрами традиционных материалов. Например, большинство металлов имеют малый потенциал ионизации и это позволяет им выступать в ходе химических процессов восстановителями.
Амфотерные — могут показать как восстановительные, так и окислительные характеристики. Однако, существуют соединения которые характеризуются отрицательным уровнем окисления.
Абсолютно все известные металлы имеют возможность образовывать гидроксиды и оксиды.
Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Кстати, металлы могут вступать в реакцию окисления только с некоторыми кислотами. Например, реакция с азотной кислотой может протекать по-разному.
Амфотерные вещества, относящиеся к простым, обладают явными различиями по структуре и особенностям. Принадлежность к определенному классу можно у некоторых веществ определить на взгляд, так, сразу видно что медь – это металл, а бром нет.
Как отличить металл от неметалла
Главное различие заключается в том, что металлы отдают электроны, которые находятся во внешнем электронном облаке. Неметаллы, активно их притягивают.
Все металлы являются хорошими проводниками тепла и электричества, неметаллы, такой возможности лишены.
Основания амфотерных металлов
В нормальных условиях это вещества не растворяются в воде и их можно спокойно отнести к слабым электролитам. Такие вещества получают после проведения реакции солей металла и щелочи. Эти реакции довольно опасны для тех, кто их производит и поэтому, например, для получения гидроксида цинка в емкость с хлоридом цинка медленно и аккуратно, по капле надо вводить едкий натр.
Вместе тем, амфотерные — взаимодействуют с кислотами как основания. То есть при выполнении реакции между соляной кислотой и гидроксидом цинка, появится хлорид цинка. А при взаимодействии с основаниями, они ведут себя как кислоты.
Оцените статью:
Рейтинг: 0/5 — 0
голосов

Это определение было введено при изучении общей теоретической химии в области ведущих и кислотных взаимодействий при наступлении определенных условий.
Отмечается влияние смены растворяющего вещества на дуальные характеристики.
Амфотерные свойства
В концепции электролитической диссоциации, когда происходит распадение проводящего вещества на отдельные ионы при сплавлении или растворении, субстанция реагирует по кислотному механизму или основным свойствам. В первом случае отщепляются частицы гидроксония, Н+, во втором варианте отделяются гидроксид-анионы, ОН-. Электролиты получают ионы одновременно из нейтральных молекул и атомов, процесс проходит под совместным действием кислотных и генеральных качеств вещества. В этом случае проводящие смеси имеют название амфолитов.
Гидроксиды элементов и их сцеплений из таблицы Менделеева, которые относятся к амфотерным соединениям:
- элементы головных подгрупп (алюминий, бериллий, сурьма, галлий, селен, мышьяк);
- участники дополнительных подвидов (вольфрам, цинк, молибден).
Чаще всего вещества проявляют одно из взаимодействий, которое изменяет характер при перемене условий. Например, происходят процессы ионизации азотной кислоты, при этом получаются нитрозильные анионы и нитрит-катионы, в качестве амфолита выступает вода.
Амфотерность рассматривается в виде способности проводящего вещества быть донором и акцептировать протоны в рамках протеолитической концепции Бренстеда и Лоури. В этом случае вода проявляет свойства самоионизации в форме обратимой передачи молекул между жидкостями, в результате появляется одинаковое число анионов и катионов.
Амфолитами являются субстанции с содержанием структурных включений органических молекул, которые передают свойственные характеристики разного характера.
Такие вещества представлены пептидами, белками и аминокислотами. Эти группы частично ионизируются при помещении в раствор.
Молекулы и частицы аминокислот имеют равновесные состояния:
- заряженная (цвиттер-ион);
- незаряженная форма.
В этих случаях вещество представлено кислотой (воспроизводят катионы) и протоны или работает по основному свойству и акцептирует катионы и протоны.
Характеристики гидроксидов
Способность амфотерного элемента проявляется и в форме взаимодействия с кислотами и основаниями.

Так ведут себя оксиды, комплексные соединения, гидроксиды и отдельные р-элементы на средней стадии окисления. Для неорганических связей с присутствием гидроксильной группы ОН такое взаимодействие является общей характеристикой.
Традиционная теория об амфотерности гидроксидов в процессе разложения на ионы по основному и кислотному виду не подтверждается. Амфотерное поведение гидроксидов заключается в реакции обмена частицами среды с молекулами, имеющими связь с акцепторным центром. Гидроксиды обладают особенностью выделять соль и по-разному взаимодействовать в кислотной среде и растворе щелочи.
В первом случае они действуют по типу оснований, а вторая среда заставляет проявлять реакцию кислот.
Амфотерность гидроксидов и оксидов проявляется в продуцировании 2 рядов солей. Двойственность свойств используется при проведении качественного анализа и отделения веществ с подобными характеристиками от других элементов. Интервал появления осадка проявляется узким промежутком, поэтому внимание уделяется тщательности регулировки растворной среды.
Номенклатура и химические особенности
На особом положении в ряду амфотерных элементов находится алюминий, он стоит на границе между кислотами и основаниями. Это ведет к его диссоциации по двум типам поведения.
Амфотерные металлы и неметаллы обладают свойствами:
- гидроксиды слабо растворяются в водной среде, поэтому не способствуют приобретению водой основных или кислотных характеристик;
- оксид-гидроксиды имеют особенности, типичные для электроположительных веществ;
- гидроксиды активных металлических групп чаще проявляют характеристики акцепторов элементарных частиц;
- по мере перехода к неметаллам свойства переходят от типичных оснований к амфотерным связкам, т. е. вещества выступают донорами протонов;
- в категории основных гидроксидов с положительными катионами существует ионная спайка, а кислород присоединяется к водороду с помощью ковалентной связи;
- в группе кислотных оксидов кислород имеет ковалентную связь с положительными электрочастицами, а с водородом соединяется полярной сцепкой ионов.
Гидроксиды с двойственными свойствами имеют физические промежуточные характеристики, доказать амфотерность можно на примере взаимодействия комплексных соединений из списка веществ 3 периода таблицы Менделеева.

В химии свойства однотипных сульфидов и оксидов, а также гидросульфитов и гидроксидов имеют разную реакцию в пределах отличающихся периодов. Свойство оснований проявляют сульфиды типичных металлов, а кислотные характеристики присутствуют в бинарных соединениях неметаллических субстанций. Различие химического происхождения наблюдается при обменной реакции между действующим веществом и растворителем, а также во взаимодействии сульфидов друг с другом.
Амфотерность гидроксидов металлических элементов объясняется тем, что в воде вещество распадается на отдельные ионы водорода по кислотному виду, а образование гидроксильных ионов проходит по типу основы.
Степени окисления
У некоторых веществ наблюдается несколько ступеней окисления, поэтому амфотерные свойства гидроксидов и оксидов подлежат разной классификации. Вещества с низкими окислительными характеристиками тяготеют к группе оснований, а сам элемент обладает свойствами металла, поскольку содержится в категории катионов. Субстанции с высокой степенью окисления являются участниками кислотных групп и проявляют неметаллические показатели, так как представляют собой анионы.
Например, у гидроксида и оксида марганца (2) главными являются основные свойства, а сам элемент входит в категорию катионов. У разновидности марганца (Vil) преобладают показатели кислоты, а само вещество относится к анионовой группы (тип МПО4).
Свойства оксидов и гидроксидов проявляются в зависимости от характеристики металла. Для элементов подвида бора (исключается таллий) типичной является 3-я степень перехода заряженных частиц от донора-восстановителя к окислительному акцептору. В результате свойства основания для элемента ослабляются.
При переходе к 3 группе встречаются вещества, которые образуют кислоты и неорганические кислоты. Последние обладают сочетанием химических и физических показателей, характерных для кислот и являются типовыми для многих элементов, за исключением щелочноземельных и щелочных металлов.

Рост свойств основного вещества происходит при увеличении радиуса движения ионов. Некоторые субстанции имеют почти одинаковую степень диссоциации с получением ионов, а у других аморфные показатели выражаются слабо.
В соединениях развитие основных свойств происходит медленно. Это объясняется тем, что атомы веществ 3 группы представляют собой аналоги с характерным строением внешней оболочки по типу благородных газов. Другие субстанции отличаются наружным слоем атома в форме электронной оболочки с 10 электронами. В таблице после алюминия наблюдается увеличение радиусов ионов, отмечается диагональное сходство, что ведет к постепенному усилению основных характеристик.
Процессы при диссоциации
В некоторых случаях амфотерные характеристики металлических гидроксидов проявляются не только в водной среде, но под действием кислотного и щелочного раствора. Если в случае с кислотой при продуцировании нейтральных частиц выделяется вода и появляется ион металла (свойство основания), то в щелочной среде не происходит отщепление протона.
При тяготении азота к висмуту степень окисления стабилизируется и усиливаются показатели основного характера. Такие соединительные субстанции выполняют одновременно окислительные и восстановительные функции. Двойственный процесс объясняется ионизацией молекулы воды, которая располагается во внутренней сфере, а протон перемещается к иону ОН.
В этом случае затрудняется определение развитости кислотных и основных показателей вещества, так как оно не имеет в составе подвижного водородного атома.
В результате из бокситов получаются другие элементы, что служит показателем использования химических характеристик при разделении. Метод основывается на применении свойства амфотерности алюминия. К этому же разряду относится выделение магния из воды морей и океанов.
Реакции взаимного действия с расплавами щелочей и кислотами ведут к появлению молекул воды и соли, а в результате степень окисления остается неизменной.
Двойственные показатели
Ионный потенциал вещества увеличивается в результате проявления двойственного механизма при диссоциации амфотерных соединений. Например, Мл (0Н) является неуравновешенным основанием, а Мп (0Н)4 представляет собой амфотерный элемент, который в равной степени проявляет кислотные особенности. НМПО4 переходит в категорию усиленных кислот, при этом снижаются свойства основания.

Щелочная среда используется для восстановления элементов с образованием гидросолей, например, гексагидроксоалюминат натрия. Если судить о тетрагидроксиде титана, то название подчеркивает возможность взаимной реакции с кислотами. Эта же субстанция гидроокиси называется ортокислотой при характеристике ее реагирования в условиях щелочной среды.
Активные металлические соединения образовывают сильнополярные ионные связи, поэтому относятся к группе оснований. Уменьшение динамичности характера вещества изменяется в сторону кислотного реагирования: НМпО, КОН, 5с (ОН)3, Са (ОН)2, НУО3 и другие.
Амфотерные оксиды М2О3 и соответствующие им гидроксиды М (ОН)3 (при этом исключается В2О3) плохо растворяются в водном растворе.
Гидроксиды характеризуются неравномерным изменением двойственных характеристик:
- А1 (0Н)3 имеет небольшое показание в области диссоциации, как основание, и представляет собой амфотерный проводящий электролит.
- Оа (0Н)3 является дуалистическим гидроксидом с неизменной константой распада, которая характеризует вещество в качестве основания и одновременно кислоты.
- Переход от Оа (0Н)3 к Т1 (0Н)3 происходит постепенно, также равномерно изменяется реакция в сторону кислотного взаимодействия в результате увеличения металлизации.
Другие вещества
Соединение гидроксида циркония является малорастворимым в воде и проявляет устойчивость к этой среде. Вещество относится к классу полимеров с положительно заряженными частицами, который содержит периодические цепи, расположенные в клеточном порядке. Материал не реагирует на основания, восстановительных и окислительных агентов.
В кислых растворах гидроксид циркония переводит анионы С1, НО3, СГО4, 8Ог на ионы ОН. Увеличение температурных показателей почти не сказывается на скорости обмена. В случае с цирконием не происходит образование определенных гидратов, термогравиметрические измерения показывают осадок полимерных частиц с образованием структурного слоя.
Германий находится ближе к группе металлов и образовывает связи, в которых его степень окисления расценивается по 2 категории. Соединения являются менее прочными, по сравнению с контактами германиевого аналога свинцовой группы, и отличаются восстановительными характеристиками. Амфотерный гидроксид с явно выраженными кислотными свойствами соответствует черному оксиду германия, молекулы которого не растворяются в жидкости. Последний носит название германистой кислоты, а его осадочные соли — германитов.
Если элемент в зависимости от условий образовывает несколько различающихся по составу оснований, то наиболее сильным признается то, которое отличается низкой окислительной степенью.
Качества основания в таких веществах выражаются ярко. Сильной является кислота, анионы которой содержат множество кислородных атомов в случае появления у элемента нескольких кислотосодержащих соединений.
