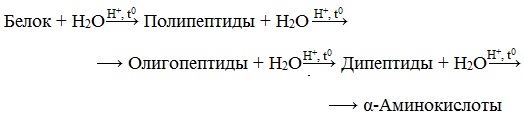Какие из свойств не соответствуют белкам

Белки
1. Какое из отмеченных свойств не характерно для белков:
-1. Коллоидные
+2. Термостабильность
-3. Закономерный порядок расположения аминокислот
2. Ковалентные связи белков:
+1. Стабилизируют третичную структуру белка
+2. Используются при соединении аминокислот в первичной структуре белка
3. Какие связи не участвуют в образовании третичной структуры белка?
+1. Пептидные
-2. Водородные
-3. Ионные
-4. Дисульфидные
4. Что обеспечивает четвертичная структура белков:
-1. Растворимость
-2. Видовую специфичность
+3. Кооперативный эффект
5. Нативная структура белка определяется:
-1. Первичной структурой
-2. Вторичной структурой
+3. Третичной структурой
6. Предопределена генетически:
+1. Первичная структура
-2. Вторичная структура
-3. Третичная структура
-4. Четвертичная структура белка
7. Какое из отмеченных свойств характерно для белков?
+1. Способность к специфическим взаимодействиям
-2. Термостабильность
-3. Устойчивость к изменению рН
8. Первичная структура белков обеспечивает:
-1. Растворимость
-2. Термоустойчивость
-3. Функциональную активность
+4. Формирование последующих уровней структурной организации молекулы
9. Какие связи характерны для первичной структуры белка?
+1. Ковалентные
-2. Нековалентные
10. Какова роль ионных и гидрофобных связей в белках?
+1. Формирование третичной структуры
-2. Соединение аминокислот в молекуле белков
11. К каким белкам относится миоглобин?
-1. Фибриллярным
+2. Глобулярным
12. Для денатурированных белков характерно:
-1. Наличие водородных связей
+2. Наличие пептидных связей
-3. Наличие вторичной и третичной структуры
13. Какая ковалентная связь стабилизирует третичную структуру белковой молекулы?
-1. Пептидная
+2. Дисульфидная
-3. Ионная
14. Как тип четвертичной структуры влияет на характер выполняемой белком функции?
-1. Определяет конформацию молекулы
-2. Формирует активный центр
+3. Обеспечивает кооперативный эффект
15. Какое свойство характерно для белков?
+1. Амфотерность
-2. Устойчивость к изменению рН
-3. Термостабильность
16. Усредненная ИЭТ всех белков цитоплазмы в пределах 5,5. Какой заряд имеют белки цитоплазмы при рН=7,36?
-1. +
+2. —
17. С точки зрения механики белковую глобулу можно представить как:
-1. Апериодический кристалл
+2. Армированную каплю
18. Главная функция шаперона hsp 70 состоит в:
+1. Удержании вновь синтезированных белков от неспецифической агрегации
-2. Обеспечении оптимальных условий для эффективного сворачивания
19. К свойствам пептидной связи в белках относится все, кроме:
-1. Имеет частично двойной характер
+2. Является нековалентной
-3. Невозможно свободное вращение
-4. Является компланарной
20. Какая из перечисленных аминокислот является положительно заряженной
-1. Лейцин
+2. Лизин
-3. Серин
-4. Глицин
21. Какие из перечисленных механизмов являются механизмами регуляции процесса сворачивания полипептидной цепи внутри клетки:
+1. Механизмы регуляции скорости превращения «расплавленной глобулы» в нативную структуру
+2. Механизмы, обеспечивающие защиту частично свернутого белка от неспецифической агрегации
-3. Химическая модификация
22. Какой первый этап выделения белков из ткани:
-1. Экстракция растворителями
-2. Выделение индивидуальных белков из смеси
-3. Определение молекулярной массы и проверка гомогенности
+4. Гомогенизация
23. В каком направлении будут перемещаться белки сыворотки крови при электрофорезе при рН=8,6?
-1. Катоду
+2. Аноду
-3. Остаются на старте
24. Какой белок будет выходить первым при гельфильтрации:
+1. М. М. 200 тыс.
-2. М. М. 85 тыс.
-3. М. М. 30 тыс.
25. Какой метод можно использовать для выделения индивидуального белка?
-1. Кристаллизацию
+2. Препаративное ультрацентрифугирование
-3. Высаливание
26. Какие вещества применяют для высаливания белков?
+1. Сульфат аммония
-2. Сахароза
-3. Кислоты
-4. Тяжелые металлы
27. Какой метод используется для очистки раствора белка от низкомолекулярных примесей?
-1. Высаливание
-2. Изоэлектрофокусирование
-3. Электрофорез
+4. Диализ
28. Метод гель-фильтрации основан на:
+1. Различиях молекулярной массы
-2. Различиях величин заряда
-3. Различиях растворимости
29. Скорость осаждения белков зависит:
-1. От числа растворенных молекул
+2. От молекулярной массы белков
-3. От величины заряда белковых молекул
30. В основе метода аффинной хроматографии лежит:
-1. Амфотерность
-2. Растворимость
+3. Специфическое взаимодействие
Ферменты
1. Какой фермент обладает относительной групповой специфичностью?
-1. D-оксидаза
-2. Липаза
+3. Пепсин
-4. Уреаза
2. Как называется дополнительная группа фермента прочно связанная с его белковой частью?
-1. Кофактор
-2. Апофермент
-3. Холофермент
-4. Кофермент
+5. Простетическая группа
3. Ферменты денатурируют при температуре:
-1. 0°С
+2. 80-100°С
-3. 20-30°С
-4. 30-40°С
4. Какое свойство присуще как неорганическим катализаторам, так и ферментам одновременно?
+1. Не сдвигают подвижного равновесия
-2. Высокая специфичность
-3. Физиологические условия протекания реакции
5. К какому классу относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием АТФ?
-1. Лиазы
+2. Лигазы
-3. Оксидоредуктазы
-4. Трансферазы
6. Какая температура является оптимальной для действия большинства ферментов?
-1. 50-60°С
-2. 15-20°С
+3. 35-40°С
7. Если константа Михаэлиса велика, то для достижения 1/2 Vmах потребуется:
-1. Мало субстрата
+2. Много субстрата
-3. Количество субстрата не играет роли
8. Уравнение Михаэлиса и Ментен описывает на графике зависимости скорости ферментативной реакции от концентрации субстрата:
-1. Реакцию нулевого порядка
-2. Реакцию смешанного порядка
+3. Реакцию первого порядка
-4. Всю кривую
9. Чем выше константа Михаэлиса, тем сродство фермента к субстрату:
-1. Выше
+2. Ниже
-3. Остается неизменным
10. Абсолютной специфичностью обладает:
-1. Химотрипсин
-2. Пепсин
+3. Уреаза
-4. Липаза
11. Относительной специфичностью обладает:
-1. Химотрипсин
-2. Пепсин
-3. Уреаза
+4. Липаза
12. Максимальная активность большинства ферментов при рН:
-1. Кислом, рН= 1,5-2,0
-2. Щелочном, рН=8,0-9,0
+3. Близком к нейтральному
13. Изоферменты:
+1. Отличаются локализацией
-2. Сходны по локализации
+3. Катализируют одну реакцию
-4. Катализируют разные реакции
14. Как ферменты влияют на энергию активации?
-1. Увеличивают
+2. Уменьшают
-3. Не изменяют
15. Какие ферментв катализируют внутримолекулярный перенос группы?
-1. Оксидоредуктазы
-2. Лиазы
+3. Изомеразы
-4. Трансферазы
16. Какое значение рН является оптимальным для пепсина?
+1. 1-2
-2. 3-5
-3. 5-7
-4. Близкое к нейтральному
17. Сродство фермента к субстрату характеризует:
-1. Константа равновесия
+2. Константа Михаэлиса
-3. Константа диссоциации
18. Уравнение Холдейна и Бриггса описывает на графике зависимости скорости химической реакции от концентрации субстрата:
-1. Реакцию первого порядка
+2. Всю кривую
-3. Реакцию нулевого порядка
-4. Реакцию смешанного порядка
19. График, построенный по уравнению Лайнуивера и Берка, позволяет точно определить:
-1. Концентрацию фермента
+2. Константу Михаэлиса
-3. Концентрацию субстрата
+3. Максимальную скорость реакции
20. Антиметаболиты могут выступать в качестве:
+1. Конкурентных ингибиторов
-2. Неконкурентных ингибиторов
-3. Необратимых ингибиторов
-4. Неспецифических ингибиторов
21. Для заместительной терапии используется фермент:
-1. Лактатдегидрогеназа
-2. Аргиназа
+3. Пепсин
-4. Фосфолипаза А2
22. Какие изоформы лактатдегидрогеназы локализованы преимущественно в сердце?
+1. ЛДГ1
+2. ЛДГ2
-3. ЛДГЗ
-4. ЛДГ4
-5. ЛДГ5
23. Какая изоформа креатинфосфокиназы (КФК) локализована преиму-щественно в миокарде.
-1. ВВ
+2. МВ
-3. ММ
24. При действии конкурентных ингибиторов:
-1. Vmax постоянна, Кm уменьшается
+2. Vmax постоянна, Кm увеличивается
-3. Vmax уменьшается, Кm увеличивается
-4. Vmax уменьшается, Кm уменьшается
25. При действии неконкурентных ингибиторов-
+1. Vmax уменьшается, Кm не меняется
-2. Vmax постоянна, Кm уменьшается
-3. Vmax уменьшается, Кm увеличивается
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
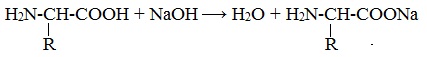
При действии же кислот он выступает в форме катиона:
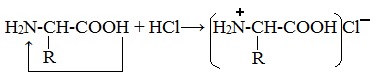
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
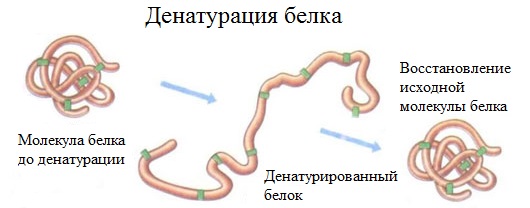
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.

![]()
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: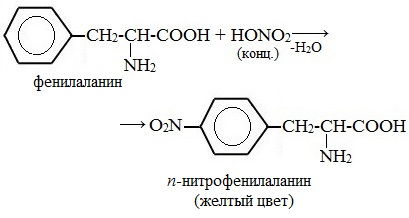
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.

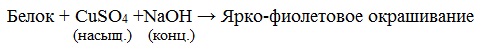
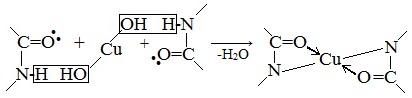
Причина появления окраски – образование комплексных соединений с координационным узлом: 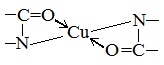
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)

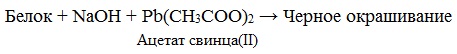
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
Áåëêè – ïðèðîäíûå ïîëèïåïòèäû ñ îãðîìíîé ìîëåêóëÿðíîé ìàññîé. Îíè âõîäÿò â ñîñòàâ âñåõ æèâûõ îðãàíèçìîâ è âûïîëíÿþò ðàçëè÷íûå áèîëîãè÷åñêèå ôóíêöèè.
Ñòðîåíèå áåëêà.
Ó áåëêîâ ñóùåñòâóåò 4 óðîâíÿ ñòðîåíèÿ:
- ïåðâè÷íàÿ ñòðóêòóðà áåëêà – ëèíåéíàÿ ïîñëåäîâàòåëüíîñòü àìèíîêèñëîò â ïîëèïåïòèäíîé öåïè, ñâåðíóòûõ â ïðîñòðàíñòâå:

- âòîðè÷íàÿ ñòðóêòóðà áåëêà – êîíôîðìàöèÿ ïîëèïåïòèäíîé öåïè, ò.ê. ñêðó÷èâàíèå â ïðîñòðàíñòâå çà ñ÷åò âîäîðîäíûõ ñâÿçåé ìåæäó NH è ÑÎ ãðóïïàìè. Åñòü 2 ñïîñîáà óêëàäêè: α-ñïèðàëü è β— ñòðóêòóðà.
α-ñïèðàëü Íà îäíîì âèòêå óêëàäûâàþòñÿ 4 àìèíîêèñëîòíûõ îñòàòêà, êîòîðûå íàõîäÿòñÿ ñíàðóæè ñïèðàëè. |
β-ñòðóêòóðà. Ïîëèïåïòèäíàÿ öåïü ðàñòÿíóòà, åå ó÷àñòêè ðàñïîëàãàþòñÿ ïàðàëëåëüíû äðóã äðóãó è óäåðæèâàþòñÿ âîäîðîäíûìè ñâÿçÿìè. |
- òðåòè÷íàÿ ñòðóêòóðà áåëêà – ýòî òðåõìåðíîå ïðåäñòàâëåíèå çàêðó÷åííîé α-ñïèðàëü èëè β-ñòðóêòóðû â ïðîñòðàíñòâå:

Ýòà ñòðóêòóðà îáðàçóåòñÿ çà ñ÷åò äèñóëüôèäíûõ ìîñòèêîâ –S-S- ìåæäó öèñòåèíîâûìè îñòàòêàìè.  îáðàçîâàíèè òàêîé ñòðóêòóðû ó÷àñòâóþò ïðîòèâîïîëîæíî çàðÿæåííûå èîíû.
- ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà îáðàçóåòñÿ çà ñ÷åò âçàèìîäåéñòâèÿ ìåæäó ðàçíûìè ïîëèïåïòèäíûìè öåïÿìè:

Ñèíòåç áåëêà.
 îñíîâå ñèíòåçà ëåæèò òâåðäîôàçíûé ìåòîä, â êîòîðîì ïåðâàÿ àìèíîêèñëîòà çàêðåïëÿåòñÿ íà ïîëèìåðíîì íîñèòåëå, à ê íåé ïîñëåäîâàòåëüíî ïîäøèâàþòñÿ íîâûå àìèíîêèñëîòû. Ïîñëå ïîëèìåð îòäåëÿþò îò ïîëèïåïòèäíîé öåïè.
Ôèçè÷åñêèå ñâîéñòâà áåëêà.
Ôèçè÷åñêèå ñâîéñòâà áåëêà îïðåäåëÿþòñÿ ñòðîåíèåì, ïîýòîìó áåëêè äåëÿò íà ãëîáóëÿðíûå (ðàñòâîðèìûå â âîäå) è ôèáðèëëÿðíûå (íåðàñòâîðèìûå â âîäå).
Õèìè÷åñêèå ñâîéñòâà áåëêîâ.
1. Äåíàòóðàöèÿ áåëêà (ðàçðóøåíèå âòîðè÷íîé è òðåòè÷íîé ñòðóêòóðû ñ ñîõðàíåíèåì ïåðâè÷íîé). Ïðèìåð äåíàòóðàöèè – ñâåðòûâàíèå ÿè÷íûõ áåëêîâ ïðè âàðêå ÿèö.
2. Ãèäðîëèç áåëêîâ – íåîáðàòèìîå ðàçðóøåíèå ïåðâè÷íîé ñòðóêòóðû â êèñëîì èëè ùåëî÷íîì ðàñòâîðå ñ îáðàçîâàíèåì àìèíîêèñëîò. Òàê ìîæíî óñòàíîâèòü êîëè÷åñòâåííûé ñîñòàâ áåëêîâ.
3. Êà÷åñòâåííûå ðåàêöèè:
Áèóðåòîâàÿ ðåàêöèÿ – âçàèìîäåéñòâèå ïåïòèäíîé ñâÿçè è ñîëåé ìåäè (II) â ùåëî÷íîì ðàñòâîðå. Ïî îêîí÷àíèþ ðåàêöèè ðàñòâîð îêðàøèâàåòñÿ â ôèîëåòîâûé öâåò.
Êñàíòîïðîòåèíîâàÿ ðåàêöèÿ — ïðè ðåàêöèè ñ àçîòíîé êèñëîòîé íàáëþäàåòñÿ æåëòîå îêðàøèâàíèå.
Áèîëîãè÷åñêîå çíà÷åíèå áåëêà.
1. Áåëêè – ñòðîèòåëüíûé ìàòåðèàë, èç íåãî ïîñòðîåíû ìûøöû, êîñòè, òêàíè.
2. Áåëêè — ðåöåïòîðû. Ïåðåäàþò è âîñïðèíèìàþò ñèãíàë, ïîñòóïàþùèõ îò ñîñåäíèõ êëåòîê èç îêðóæàþùåé ñðåäû.
3. Áåëêè èãðàþò âàæíóþ ðîëü â èììóííîé ñèñòåìå îðãàíèçìà.
4. Áåëêè âûïîëíÿþò òðàíñïîðòíûå ôóíêöèè è ïåðåíîñÿò ìîëåêóëû èëè èîíû â ìåñòî ñèíòåçà èëè íàêîïëåíèÿ. (Ãåìîãëîáèí ïåðåíîñèò êèñëîðîä ê òêàíÿì.)
5. Áåëêè – êàòàëèçàòîðû – ôåðìåíòû. Ýòî î÷åíü ìîùíûå ñåëåêòèâíûå êàòàëèçàòîðû, êîòîðûå óñêîðÿþò ðåàêöèè â ìèëëèîíû ðàç.
Åñòü ðÿä àìèíîêèñëîò, êîòîðûå íå ìîãóò ñèíòåçèðîâàòüñÿ â îðãàíèçìå — íåçàìåíèìûå, èõ ïîëó÷àþò òîëüêî ñ ïèùåé: òèçèí, ôåíèëàëàíèí, ìåòèíèí, âàëèí, ëåéöèí, òðèïòîôàí, èçîëåéöèí, òðåîíèí.
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |