Какие химические свойства характерны для карбоновых кислот

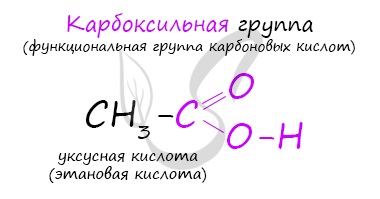
Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
.
- кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- замещение атома водорода в алкильном радикале
- образование сложных эфиров — этерификация
1. Кислотные свойства
Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO– + H+
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
Например, уксусная кислота растворяет осадок гидроксида меди (II)
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода.
![]()
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды.
![]()
Например, уксусная кислота реагирует с оксидом меди (II)
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
Например, уксусная кислота растворяет карбонат кальция
![]()
Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа
![]()
2. Реакции замещения группы ОН
Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов.
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты

2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:

При нагревании карбоновые соли аммония разлагаются на амид и воду:

2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.

Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):

2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты

3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу.
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
Например, уксусная кислота реагирует с бромом в присутствии красного фосфора

4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов.

4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.

При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):

4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.

4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:

Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:

4.2. Реакции замещения в бензольном кольце
Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.

6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:

6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:

7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
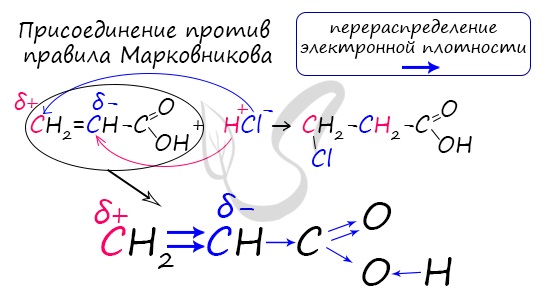
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:

К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:

6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:

Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .
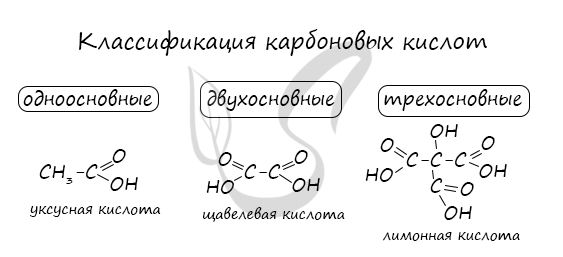
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
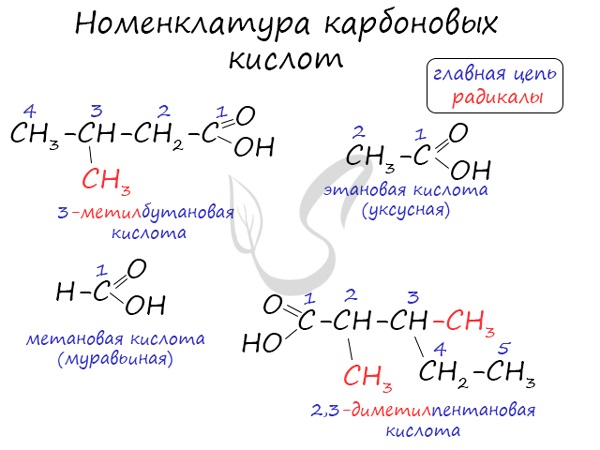
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
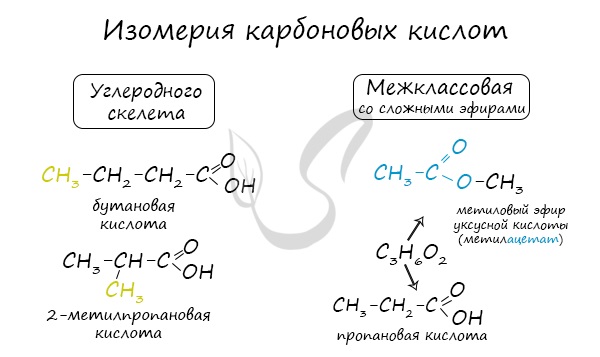
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.
Получение карбоновых кислот
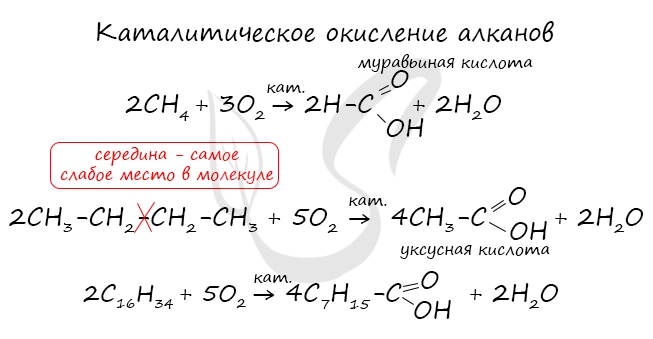
- Окисление алканов
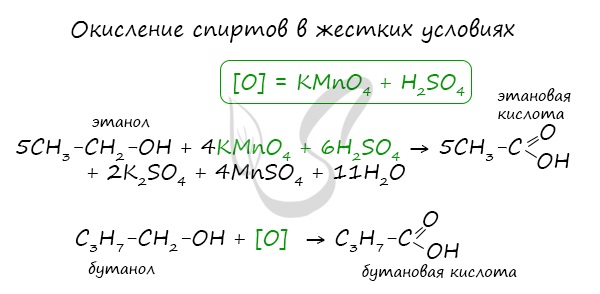
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды — реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции щелочи с угарным газом — образуется формиат (соль муравьиной кислоты). В результате добавления раствора серной кислоты к формиату получается
муравьиная кислота.
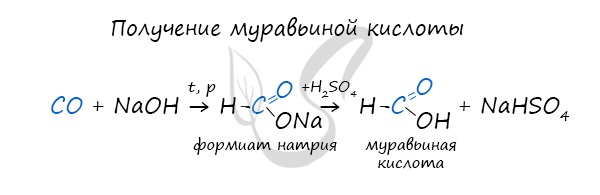
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная —
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислот + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
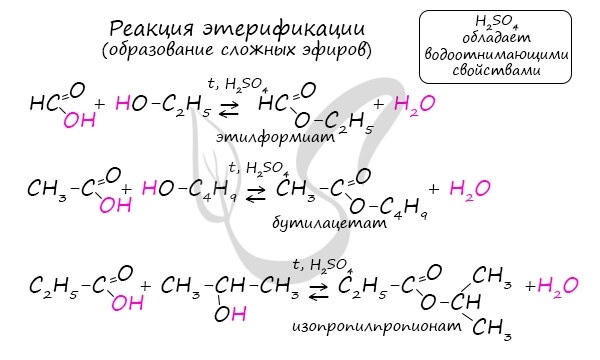
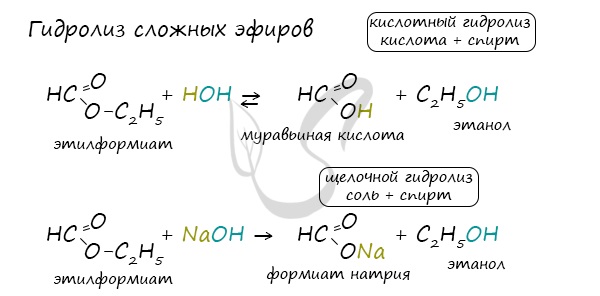
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
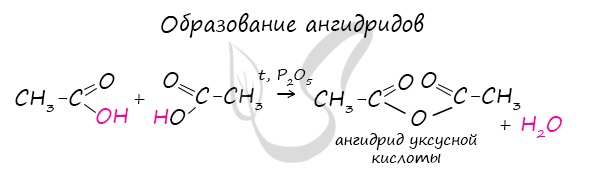
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
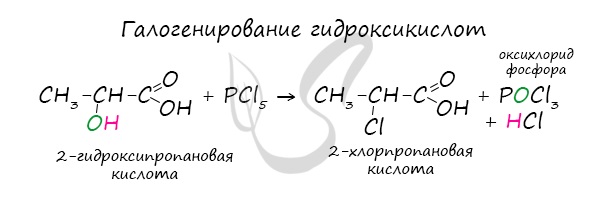
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Êàðáîíîâûìè êèñëîòàìè íàçûâàþò ñîåäèíåíèÿ, â êîòîðûõ ñîäåðæèòñÿ êàðáîêñèëüíàÿ ãðóïïà:
 .
.
Êàðáîíîâûå êèñëîòû ðàçëè÷àþò:
- îäíîîñíîâíûå êàðáîíîâûå êèñëîòû;
- äâóõîñíîâíûå (äèêàðáîíîâûå) êèñëîòû (2 ãðóïïû ÑÎÎÍ).
 çàâèñèìîñòè îò ñòðîåíèÿ êàðáîíîâûå êèñëîòû ðàçëè÷àþò:
- àëèôàòè÷åñêèå;
- àëèöèêëè÷åñêèå;
- àðîìàòè÷åñêèå.
Ïðèìåðû êàðáîíîâûõ êèñëîò.

Åñëè â ðàäèêàëå âîäîðîä ïîìåíÿòü íà ëþáóþ ôóíêöèîíàëüíóþ ãðóïïó, òî òàêèå êèñëîòû íàçûâàþòñÿ ãåòåðîôóíêöèîíàëüíûìè. Ñðåäè íèõ: àìèíîêèñëîòû (ïðîòîí çàìåùåí íà àìèíî-ãðóïïó), íèòðîêèñëîòû (àòîì âîäîðîäà çàìåùåí íà íèòðî-ãðóïïó) è ò.ä.
Åñëè ÷èñëî àòîìîâ óãëåðîäà â êèñëîòå áîëüøå 6, òî òàêàÿ êèñëîòà íàçûâàåòñÿ æèðíîé.
Ñòðîåíèå êàðáîíîâûõ êèñëîò.
Êàðáîêñèëüíàÿ ãðóïïà ñîñòîèò èç Ñ=Î è ÎÍ ãðóïïû. Íà ñâîéñòâà êèñëîòû âëèÿþò îáà ýòè ïîêàçàòåëÿ.  ãðóïïå Ñ=Î àòîì óãëåðîäà îáëàäàåò ÷àñòè÷íî ïîëîæèòåëüíûì çàðÿäîì è ïðèòÿãèâàåò íåïîäåëåííóþ ïàðó àòîìà êèñëîðîäà èç ãèäðîêñèëüíîé ãðóïïû. Ïðè ýòîì íà êèñëîðîäå ýëåêòðîííàÿ ïëîòíîñòü ïîíèæàåòñÿ è ñâÿçü Î-Í îñëàáëÿåòñÿ:

Ãðóïïà ÎÍ «íåéòðàëèçóåò» ïîëîæèòåëüíûé çàðÿä íà ãðóïïå Ñ=Î, êîòîðàÿ ïåðåñòàåò âñòóïàòü â ðåàêöèè ïðèñîåäèíåíèÿ, êîòîðûå òàê õàðàêòåðíû äëÿ êàðáîíèëüíûõ êèñëîò.
Êàê íàçûâàòü êàðáîíîâûõ êèñëîò?
Íàëè÷èå ÑÎÎÍ ãðóïïû îáîçíà÷àåòñÿ îêîí÷àíèåì –îâàÿ êèñëîòà.
Íóìåðîâàòü öåïü íà÷èíàþò ñ àòîìà óãëåðîäà êàðáîêñèëüíîé ãðóïïû, íàïðèìåð:

Êàðáîêñèëüíóþ ãðóïïó ðàññìàòðèâàþò â êà÷åñòâå çàìåñòèòåëÿ. Íàïðèìåð,

Èçîìåðèÿ êàðáîíîâûõ êèñëîò.
Äëÿ êàðáîíîâûõ êèñëîò õàðàêòåðíà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà, ïîëîæåíèå êðàòíîé ñâÿçè, ìåæêëàññîâàÿ èçîìåðèÿ, ïðîñòðàíñòâåííàÿ èçîìåðèÿ è èçîìåðèÿ ïîëîæåíèÿ ôóíêöèîíàëüíîé ãðóïïû:




Ôèçè÷åñêèå ñâîéñòâà êàðáîíîâûõ êèñëîò.
Îáùàÿ ôîðìóëà êèñëîò CnH2n+1COOH. Íèçøèå êèñëîòû â íîðìàëüíûõ óñëîâèÿõ ïðåäñòàâëÿþò ñîáîé æèäêîñòè, êîòîðûå îáëàäàþò õàðàêòåðíûì çàïàõîì. Íà÷èíàÿ ñ Ñ10 – òâåðäûå âåùåñòâà.
Òâåðäûå êèñëîòû íåðàñòâîðèìû â âîäå, à êèñëîòû ñ 1-3 êîëè÷åñòâîì àòîìîâ óãëåðîäà íåîãðàíè÷åííî ñìåøèâàþòñÿ ñ âîäîé.

Ïîëó÷åíèå êàðáîíîâûõ êèñëîò .
1. Îêèñëåíèå ïåðâè÷íûõ ñïèðòîâ ïåðìàíãàíàòîì êàëèÿ è äèõðîìàòîì êàëèÿ:

2. Ãèáðîëèç ãàëîãåíçàìåùåííûõ óãëåâîäîðîäîâ, ñîäåðæàùèõ 3 àòîìà ãàëîãåíà ó îäíîãî àòîìà óãëåðîäà:

3. Ïîëó÷åíèå êàðáîíîâûõ êèñëîò èç öèàíèäîâ:

Ïðè íàãðåâàíèè íèòðèë ãèäðîëèçóåòñÿ ñ îáðàçîâàíèåì àöåòàòà àììîíèÿ:

Ïðè ïîäêèñëåíèÿ êîòîðîãî âûïàäàåò êèñëîòà:

4. Èñïîëüçîâàíèå ðåàêòèâîâ Ãðèíüÿðà:

5. Ãèäðîëèç ñëîæíûõ ýôèðîâ:

6. Ãèäðîëèç àíãèäðèäîâ êèñëîò:

7. Ñïåöèôè÷åñêèå ñïîñîáû ïîëó÷åíèÿ êàðáîíîâûõ êèñëîò:
Ìóðàâüèíàÿ êèñëîòà ïîëó÷àåòñÿ ïðè íàãðåâàíèè îêñèäà óãëåðîäà (II) ñ ïîðîøêîîáðàçíûì ãèäðîêñèäîì íàòðèÿ ïîä äàâëåíèåì:

Óêñóñíóþ êèñëîòó ïîëó÷àþò êàòàëèòè÷åñêèì îêèñëåíèåì áóòàíà êèñëîðîäîì âîçäóõà:

Áåíçîéíóþ êèñëîòó ïîëó÷àþò îêèñëåíèåì ìîíîçàìåùåííûõ ãîìîëîãîâ ðàñòâîðîì ïåðìàíãàíàòà êàëèÿ:

Ðåàêöèÿ Êàííèöèàðî. Áåíçàëüäåãèä îáðàáàòûâàþò 40-60% ðàñòâîðîì ãèäðîêñèäà íàòðèÿ ïðè êîìíàòíîé òåìïåðàòóðå.

Õèìè÷åñêèå ñâîéñòâà êàðáîíîâûõ êèñëîò.
 âîäíîì ðàñòâîðå êàðáîíîâûå êèñëîòû äèññîöèèðóþò:

Ðàâíîâåñèå ñäâèíóòî ñèëüíî âëåâî, ò.ê. êàðáîíîâûå êèñëîòû ÿâëÿþòñÿ ñëàáûìè.
Çàìåñòèòåëè âëèÿþò íà êèñëîòíîñòü âñëåäñòâèå èíäóêòèâíîãî ýôôåêòà. Òàêèå çàìåñòèòåëè îòòÿãèâàþò ýëåêòðîííóþ ïëîòíîñòü íà ñåáÿ è íà íèõ âîçíèêàåò îòðèöàòåëüíûé èíäóêòèâíûé ýôôåêò (-I). Îòòÿãèâàíèå ýëåêòðîííîé ïëîòíîñòè ïðèâîäèò ê ïîâûøåíèþ êèñëîòíîñòè êèñëîòû. Ýëåêòðîíîäîíîðíûå çàìåñòèòåëè ñîçäàþò ïîëîæèòåëüíûé èíäóêòèâíûé çàðÿä.

1. Îáðàçîâàíèå ñîëåé. Ðåàãèðîâàíèå ñ îñíîâíûìè îêñèäàìè, ñîëÿìè ñëàáûõ êèñëîò è àêòèâíûìè ìåòàëëàìè:

Êàðáîíîâûå êèñëîòû – ñëàáûå, ò.ê. ìèíåðàëüíûå êèñëîòû âûòåñíÿþò èõ èç ñîîòâåòñòâóþùèõ ñîëåé:

2. Îáðàçîâàíèå ôóíêöèîíàëüíûõ ïðîèçâîäíûõ êàðáîíîâûõ êèñëîò:


3. Ñëîæíûå ýôèðû ïðè íàãðåâàíèè êèñëîòû ñî ñïèðòîì â ïðèñóòñòâèå ñåðíîé êèñëîòû – ðåàêöèÿ ýòåðèôèêàöèè:

4. Îáðàçîâàíèå àìèäîâ, íèòðèëîâ:



3. Ñâîéñòâà êèñëîò îáóñëàâëèâàþòñÿ íàëè÷èåì óãëåâîäîðîäíîãî ðàäèêàëà. Åñëè ïðîòåêàåò ðåàêöèÿ â ïðèñóòñòâèå êðàñíîãî ôîñôîðà, òî îáðàçóåò ñëåäóþùèé ïðîäóêò:

4. Ðåàêöèÿ ïðèñîåäèíåíèÿ.

5. Îêèñëèòåëüíî-âîññòàíîâèòåëüíûå ðåàêöèè. Ïðè âîññòàíîâëåíèè â ïðèñóòñòâèå êàòàëèçàòîðîâ:

Èñêëþ÷åíèå: ìóðàâüèíàÿ êèñëîòà:

6. Ðåàêöèÿ ñåðåáðÿíîãî çåðêàëà:


7. Îêèñëÿåòñÿ õëîðîì:

8. Äåêàðáîêñèëèðîâàíèå. Ðåàêöèþ ïðîâîäÿò ñïëàâëåíèåì ùåëî÷è ñ ñîëüþ ùåëî÷íîãî ìåòàëëà êàðáîíîâîé êèñëîòû:

9. Äâóõîñíîâíàÿ êèñëîòà ëåãêî îòùåïëÿåò ÑÎ2 ïðè íàãðåâàíèè:


