Какие химические свойства характерны для аминокислоты

Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) |  цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) |  фенилаланин
тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH лизин |
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
![]()
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с основаниями:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
![]()
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
![]()
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
![]()
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
![]()
Например, глицин разлагается при нагревании:
![]()
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
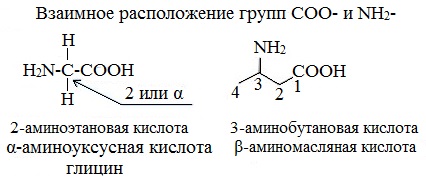
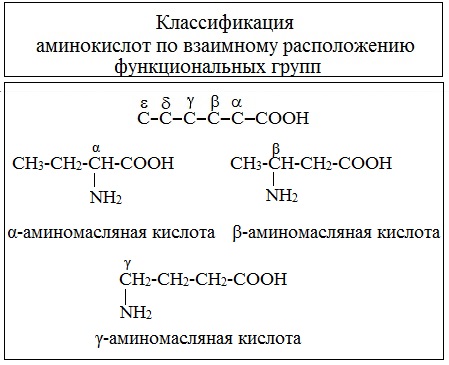
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
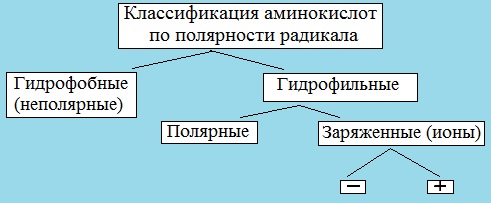
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
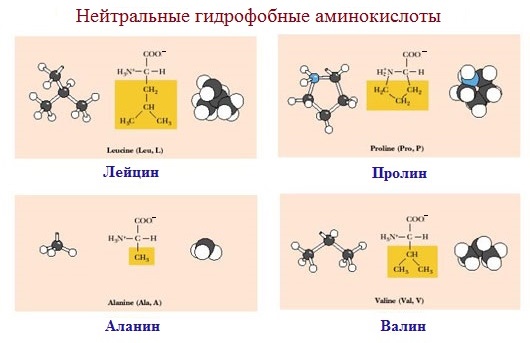
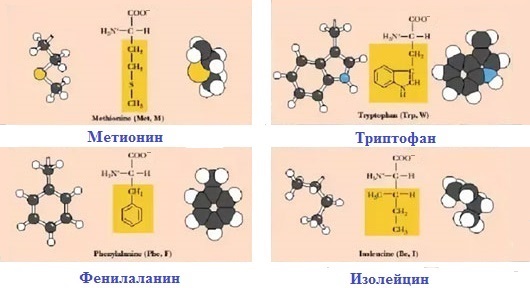
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
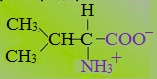
2. Полярные незаряженные
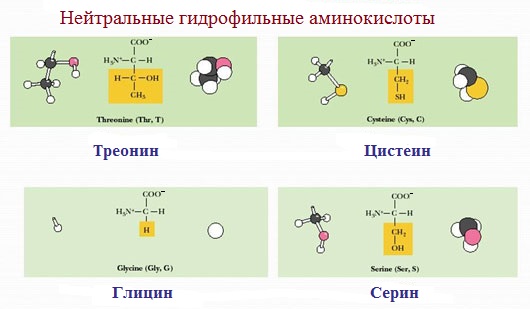
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
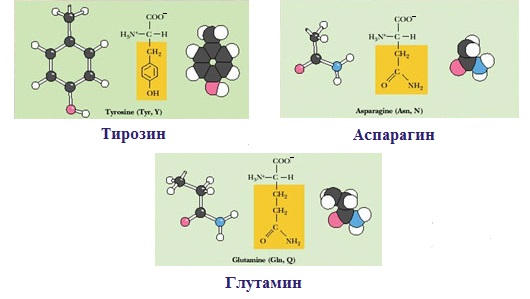
3. Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.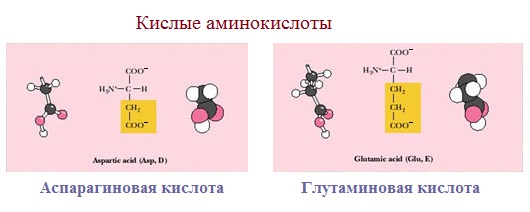
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.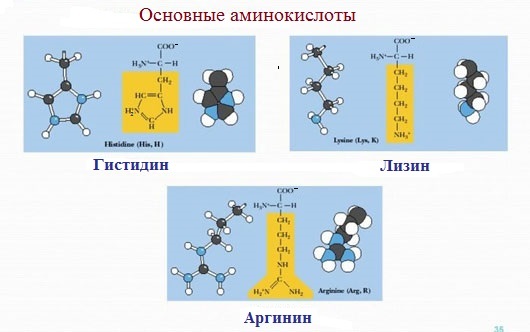
В ионизированном виде они имеют суммарный положительный заряд:
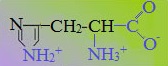
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
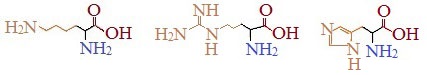
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
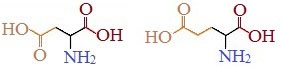
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.

Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Аминокислоты
- Содержание главы:
- Аминокислоты. Представители алифатических аминокислот. Ароматические аминокислоты. Использование аминокислот.
- Получение аминокислот: α-аминокислоты, β-аминокислоты, ω-аминокислоты, ароматические аминокислоты.
- Строение аминокислот. Стероизомерия. Цвиттер-ионная структура.
- Химические свойства аминокислот. Алифатические аминокислоты. Реакции по аминогруппе.
- Реакции по карбоксильной группе. Специфические свойства
аминокислот. Ароматические аминокислоты. - Белки. Синтез пептидов.
- Анализ белковых молекул. Качественные реакции. Определение С- и N-концевых аминокислот.
- Пространственное строение белков.
Аминокислотами называют гетерофункциональные соединения, содержащие одновременно аминогруппу и карбоксильную группы в составе одной молекулы. Классифицируют аминокислоты, основываясь на типе углеводородного радикала, на ароматические и алифатические, последние, в свою очередь, подразделяются на
α-, β-, γ-, δ- и ω-аминокислоты, химические свойства которых ощутимо различаются.
Представители алифатических аминокислот
Наибольшее значение в химии имеют
α-аминокислоты, в основном потому, что они являются мономерами белков – их можно назвать основой жизни. В состав важнейших
α-аминокислот входят не только алифатические, но и ароматические и гетероароматические радикалы. Номенклатура аминокислот подразумевает использование названия соответствующей карбоновой кислоты в качестве основы, положение заместителей обозначают цифрами, начиная от карбонильного углерода (IUPAC), либо буквами греческого алфавита, начиная от соседнего атома углерода (рациональная). Широко используются и тривиальные названия. Тривиальные названия обычно связаны с источниками выделения аминокислот. Например, серин выделен из шелка (serieus (лат.) – шелковистый), тирозин – из сыра (tyros (греч.) – сыр). Для удобства написания полипептидных молекул используют сокращенные обозначения аминокислотных остатков.
Общее число встречающихся в природе α-аминокислот достигает 180, из них 20 постоянно присутствуют во всех белковых молекулах. Растения и некоторые микроорганизмы синтезируют все необходимые им аминокислоты. В животном организме некоторые аминокислоты синтезируются, некоторые – нет и должны поступать извне. Такие аминокислоты называют незаменимыми. К незаменимым относятся – валин, лизин, фенилалалнин, лейцин, треонин, триптофан, изолейцин, метионин.
Важнейшие α-аминокислоты
R | Тривиальное название | Сокращенное обозначение аминокислотного остатка |
Алифатические | ||
Н- | Глицин | Gly |
СН3- | Аланин | Ala |
(СН3)2СН- | Валин* | Val |
(СН3)2СНСН2- | Лейцин* | Leu |
Изолейцин* | Ile | |
Содержащие ОН группу | ||
НОСН2- | Серин | Ser |
Треонин* | Thr | |
Содержащие СООН группу | ||
НООССН2- | Аспарагиновая кислота | Asp |
НООССН2СН2- | Глутаминовая кислота | Glu |
Содержащие СОNH2 группу | ||
Аспарагин | Asn | |
Глутамин | Gln | |
Содержащие NH2 группу | ||
H2N(CH2)3CH2- | Лизин* | Lys |
Аргинин | Arg | |
Содержащие S | ||
HSCH2- | Цистеин | Cys |
СH3SСН2CH2- | Метионин* | Met |
Содержащие арил | ||
С6Н5СН2- | Фенилаланин* | Phe |
Тирозин | Tyr | |
Содержащие гетарил | ||
Триптофан* | Trp | |
Гистидин | His | |
(полная формула) | Пролин | Pro |
* – незаменимые аминокислоты
Аминокислотные остатки H2N-CHR-CO- называют, добавляя к корню слова окончание –ил. Например, H2N-CH2-CO- глицил; H2N-CH(С6Н5)-CO- фенилаланил; H2N-CH(ОН)-CO- серил.
Аминокислоты с более удаленным расположением функциональных групп называют, добавляя к названию соответствующей кислоты приставку амино-, положение аминогруппы указывают цифрой или буквой греческого алфавита.
Ароматические аминокислоты
Ароматические аминокислоты различаются взаимным расположением функциональных групп в бензольном кольце.
Использование аминокислот
Аминокислоты находят широкое применение, как в синтетической, так и в аналитической химии. В качестве примера использования аминокислот в аналитической химии приведем этилендиаминтетрауксусную кислоту (трилон Б), которая, являясь сильным комплексообразователем, применяется для анализа неорганических солей. Другое применение трилона Б – снижение жесткости воды.
Различные аминокислоты и их производные используются в качестве лекарственных препаратов. Сюда относятся собственно глицин, γ-аминомасляная кислота (аминалон) – препараты, нормализующие нервные процессы, эфиры п-аминобензойной кислоты (анестезин, новокаин) – применяют для местного наркоза, п-аминосалициловая кислота (ПАСК) – противотуберкулезный препарат и многие другие.
На основе ароматических аминокислот синтезируют диазокрасители, из антраниловой кислоты получают кубовый краситель индиго, из капролактама (циклического внутримолекулярного амида
ε-аминокапроновой кислоты) – синтетическое волокно капрон, сложные эфиры антраниловой кислоты имеют приятный запах и используются в парфюмерии.
Упражнения к теме «Аминокислоты»
Тесты для
самопроверки
Благодаря способности аминокислот к поликонденсации образуются полиамиды – белки, пептиды, а также энант, капрон и нейлон. При поликонденсации ɛ-аминокапроновой кислоты получается полимер капрон. Из капроновой смолы получают не только волокна, но и пластмассовые изделия.
Энант, капрон и нейлон применяются в промышленности при производстве корда, прочных тканей, сетей, канатов, веревок, трикотажных и чулочных изделий.
Аминокислоты широко применяются в медицинской практике в качестве лекарственных средств.
Аминокислоты прописываются при сильном истощении, после тяжелых операций, их используют для питания больных.
Из полиаминокислот получают хороший материал для хирургии.
Аргинин в сочетании с аспартатом или глутаматом помогает при заболевании печени.
Аспарагиновая кислота способствует повышению потребления кислорода сердечной мышцей. В кардиологии применяют панангин – препарат, содержащий аспартат калия и аспартат магния. Панангин применяют для лечения различного рода аритмий, а также ишемической болезни сердца.
В медицинских учреждениях аминокислоты применяются в качестве парентерального питания пациентов с заболеваниями желудочно-кишечного тракта (язва желудка), при лечении болезней печени, ожогов, малокровия, при нервно-психических заболеваниях.
Глутаминовая кислота используется в детской психиатрии для лечения слабоумия и последствий родовых травм, при нарушениях мозгового кровообращения после инсульта, при атеросклерозе мозговых сосудов, потере памяти.
Гистидин иногда применяют для лечения больных гепатитами, язвенной болезнью желудка и двенадцатиперстной кишки.
Глицин является медиатором торможения в ЦНС. В медицинской практике применяется для лечения алкоголизма. Производное глицина – бетаин улучшает процессы пищеварения.
Метионин и его активные производные используются в лечении и профилактике болезней печени. Метионин защищает организм при отравлении бактериальными эндотоксинами и некоторыми другими ядами, в связи с этим используется для защиты организма от токсикантов окружающей среды.
Некоторые аминокислоты используются в качестве самостоятельных лекарственных средств (аргинин, цистеин, ароматические аминокислоты).
Аминокислоты в сельском хозяйстве применяются преимущественно в качестве кормовых добавок. Многие растительные белки содержат недостаточное количество белков. Лизин, лейцин, метионин, треонин, триптофан добавляют в корма сельскохозяйственных животных.
Аминокислоты метионин, глутаминовая кислота и валин применяются для защиты растений от болезней, а аланин и глицин, обладающий гербицидным действием, используется для борьбы с сорняками.
Аминокислоты используются в микробиологической промышленности для приготовления культуральных сред и как реактивы.
В пищевой промышленности аминокислоты применяются в качестве вкусовых добавок.
Наиболее важны добавки лизина, триптофана и метионина к пищевым продуктам, неполноценным по содержанию этих аминокислот.
Добавка глутаминовой кислоты и ее солей к ряду продуктов придает им приятный мясной вкус, что часто используют в пищевой промышленности.
Натриевая соль глутаминовой кислоты (глутамат натрия) известна как «пищевая добавка E621» или «усилитель вкуса».
Глутаминовая кислота является важным компонентом при замораживании и консервировании.
Благодаря присутствию глицина, метионина и валина, во время термической обработки продуктов питания удается получить специфические ароматы хлебобулочных и мясных изделий.
Аминокислоты цистеин, лизин и глицин используются в качестве антиоксидантов, стабилизирующих ряд витаминов, например аскорбиновую кислоту; замедляющих пероксидное окисление липидов.
Глицин применяется при производстве безалкогольных напитков и приправ.
Аминокислоты также являются компонентами спортивного питания (в изготовлении которого применяется, как правило, валин, лейцин, изолейцин, аланин, лизин, аргинин и глутамин), использующегося спортсменами, а также людьми, занимающимися бодибилдингом, фитнесом.
В химической промышленности введение в такие аминокислоты, как глутаминовая или аспарагиновая кислоты, гидрофобных группировок дает возможность получать поверхностно-активные вещества (ПАВ), широко используемые в синтезе полимеров, а также при производстве моющих средств, эмульгаторов, добавок к моторному топливу.

Аминокислоты

