Какие химические свойства характерны для алкинов
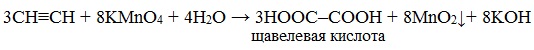
Àëêèíû – ýòî íåïðåäåëüíûå óãëåâîäîðîäû, ìîëåêóëû êîòîðûõ ñîäåðæàò òðîéíóþ ñâÿçü. Ïðåäñòàâèòåëü – àöåòèëåí, ãîìîëîãè åãî:



Îáùàÿ ôîðìóëà – CnH2n-2.
Ñòðîåíèå àëêèíîâ.
Àòîìû óãëåðîäà, êîòîðûå îáðàçóþò òðîéíóþ ñâÿçü, íàõîäÿòñÿ â sp—ãèáðèäèçàöèè. σ-ñâÿçè ëåæàò â ïëîñêîñòè, ïîä óãëîì 180 °Ñ, à π-ñâÿçè îáðàçîâàíû ïóòåì ïåðåêðûâàíèÿ 2õ ïàð íåãèáðèäíûõ îðáèòàëåé ñîñåäíèõ àòîìîâ óãëåðîäà.
Èçîìåðèÿ àëêèíîâ.
Äëÿ àëêèíîâ õàðàêòåðíà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà, èçîìåðèÿ ïîëîæåíèÿ êðàòíîé ñâÿçè.
Ïðîñòðàíñòâåííàÿ èçîìåðèÿ íå õàðàêòåðíà.
Ôèçè÷åñêèå ñâîéñòâà àëêèíîâ.
 íîðìàëüíûõ óñëîâèÿõ:
Ñ2-Ñ4 – ãàçû;
Ñ5 –Ñ16 – æèäêîñòè;
Ñ17è áîëåå – òâåðäûå âåùåñòâà.
Òåìïåðàòóðû êèïåíèÿ àëêèíîâ âûøå, ÷åì ó ñîîòâåòñòâóþùèõ àëêàíîâ.
Ðàñòâîðèìîñòü â âîäå íåçíà÷èòåëüíà, íåìíîãî âûøå, ÷åì ó àëêàíîâ è àëêåíîâ, íî âñå ðàâíî î÷åíü ìàëà. Ðàñòâîðèìîñòü â íåïîëÿðíûõ îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ âûñîêàÿ.
Ïîëó÷åíèå àëêèíîâ.
1. Îòùåïëåíèå 2õ ìîëåêóë ãàëîãåíâîäîðîäà îò äèãàëîãåíàâêîíîâ, êîòîðûå íàõîäÿòñÿ ëèáî ó ñîñåäíèõ àòîìîâ óãëåðîäà èëè ó îäíîãî. Îòùåïëåíèå ïðîèñõîäèò ïîä âîçäåéñòâèåì ñïèðòîâîãî ðàñòâîðà ùåëî÷è:

2. Äåéñòâèå ãàëîãåíàëêàíîâ íà ñîëè àöåòèëåíîâûõ óãëåâîðîäîðîäîâ:

Ðåàêöèÿ ïðîòåêàåò ÷åðåç îáðàçîâàíèå íóêëåîôèëüíîãî êàðáàíèîíà:

3. Êðåêèíã ìåòàíà è åãî ãîìîëîãîâ:



 ëàáîðàòîðèè àöåòèëåí ïîëó÷àþò:

Õèìè÷åñêèå ñâîéñòâà àëêèíîâ.
Õèìè÷åñêèå ñâîéñòâà àëêèíîâ îáúÿñíÿåò íàëè÷èå òðîéíîé ñâÿçè â ìîëåêóëå àëêèíà. Òèïè÷íàÿ ðåàêöèÿ äëÿ àëêèíîâ – ðåàêöèÿ ïðèñîåäèíåíèÿ, êîòîðàÿ ïðîòåêàåò â 2 ñòàäèè. Íà ïåðâîé ïðîèñõîäèò ïðèñîåäèíåíèå è îáðàçîâàíèå äâîéíîé ñâÿçè, à íà âòîðîé – ïðèñîåäèíåíèå ê äâîéíîé ñâÿçè. Ðåàêöèÿ ó àëêèíîâ ïðîòåêàåò ìåäëåííåå, ÷åì è àëêåíîâ, ò.ê. ýëåêòðîííàÿ ïëîòíîñòü òðîéíîé ñâÿçè «ðàçìàçàíà» áîëåå êîìïàêòíî, ÷åì ó àëêåíîâ, è ïîýòîìó ìåíåå äîñòóïíà äëÿ ðåàãåíòîâ.
1. Ãàëîãåíèðîâàíèå. Ãàëîãåíû ïðèñîåäèíÿþòñÿ ê àëêèíàì â 2 ñòàäèè. Íàïðèìåð,

À ñóììàðíî:

Àëêèíû òàêæå êàê àëêåíû îáåñöâå÷èâàþò áðîìíóþ âîäó, ïîýòîìó ýòà ðåàêöèÿ ÿâëÿåòñÿ êà÷åñòâåííîé è äëÿ àëêèíîâ.
2. Ãèäðîãàëîãåíèðîâàíèå. Ãàëîãåíâîäîðîäû ïðèñîåäèíÿþòñÿ ê òðîéíîé ñâÿçè íåñêîëüêî òðóæäíåå, ÷åì ê äâîéíîé. Äëÿ óñêîðåíèÿ (àêòèâàöèè) ïðîöåññà èñïîëüçóþò ñèëüíóþ êèñëîòó Ëüþèñà – AlCl3. Èç àöåòèëåíà ïðè òàêèõ óñëîâèÿõ ìîäíî ïîëó÷èòü âèíèëõëîðèä, êîòîðûé èäåò íà ïðîèçâîäñòâà ïîëèìåðà – ïîëèâèíèëõëîðèäà, èìåþùåãî âàæíåéøåå çíà÷åíèå â ïðîìûøëåíîñòè:
 .
.
Åñëè æå ãàëîãåíâîäîðîä â èçáûòêå, òî ðåàêöèÿ (îñîáåííî ó íåñèììåòðè÷íûõ àëêèíîâ) èäåò ïî ïðàâèëó Ìàðêîâíèêîâà:

3. Ãèäðàòàöèÿ (ïðèñîåäèíåíèå âîäû). Ðåàêöèÿ ïðîòåêàåò òîëüêî â ïðèñóòñòâèè ñîëåé ðòóòè (II) â êà÷åñòâå êàòàëèçàòîðà:
Íà 1îé ñòàäèè îáðàçóåòñÿ íåïðåäåëüíûé ñïèðò, â êîòîðîì ãèäðîêñèãðóïïà íàõîäèòñÿ ó àòîìà óãëåðîäà, îáðàçóþùåãî äâîéíóþ ñâÿçü. Òàêèå ñïèðòû íàçûâàþòñÿ âèíèëîâûìè èëè ôåíîëàìè.
Îòëè÷èòåëüíàÿ ÷åðòà òàêèõ ñïèðòîâ – íåóñòîé÷èâîñòü. Îíè èçîìåðèçóþòñÿ â áîëåå ñòàáèëüíûå êàðáîíèëüíûå ñîåäèíåíèÿ (àëüäåãèäû è êåòîíû) âñëåäñòâèå ïåðåíîñà ïðîòîíà îò ÎÍ-ãðóïïû ê óãëåðîäó ïðè äâîéíîé ñâÿçè. Ïðè ýòîì π-ñâÿçü ðâåòñÿ (ìåæäó àòîìàìè óãëåðîäà), è îáðàçóåòñÿ íîâàÿ π-ñâÿçü ìåæäó àòîìîìàìè óãëåðîäà è àòîìîì êèñëîðîäà. Òàêàÿ èçîìåðèçàöèÿ ïðîèñõîäèò èç-çà áîëüøåé ïëîòíîñòè äâîéíîé ñâÿçè Ñ=Î ïî ñðàâíåíèþ ñ Ñ=Ñ.
Òîëüêî àöåòèëåí ïðåâðàùàåòñÿ â àëüäåãèä, åãî ãîìîëîãè — â êåòîíû. Ðåàêöèÿ ïðîòåêàåò ïî ïðàâèëà Ìàðêîâíèêîâà:

Ýòà ðåàêöèÿ íîñèò íàçâàíèÿ – ðåàêöèè Êó÷åðîâà.
4. Òå àëêèíû, êîòîðûå èìåþò êîíöåâóþ òðîéíóþ ñâÿçü, ìîãóò îòùåïëÿòü ïðîòîí ïîä äåéñòâèåì ñèëüíûõ êèñëîòíûõ ðåàãåíòîâ. Òàêîé ïðîöåññ îáóñëîâëåí ñèëüíîé ïîëÿðèçàöèåé ñâÿçè  .
.
Ïðè÷èíîé ïîëÿðèçàöèè ñëóæèò ñèëüíàÿ ýëåêòðîîòðèöàòåëüíîñòü àòîìà óãëåðîäà â sp-ãèáðèäèçàöèè, ïîýòîìó àëêèíû ìîãóò îáðàçîâûâàòü ñîëè – àöåòèëåíèäû:

Àöåòèëåíèäû ìåäè è ñåðåáðà ëåãêî îáðàçóþòñÿ è âûïàäàþò â îñàäîê (ïðè ïðîïóñêàíèè àöåòèëåíà ÷åðåç àììèà÷íûé ðàñòâîð îêñèäà ñåðåáðà èëè õëîðèäà ìåäè). Ýòè ðåàêöèè ÿâëÿþòñÿ êà÷åñòâåííûìè íà êîíöåâóþ òðîéíóþ ñâÿçü:

Ïîëó÷åííûå ñîëè ëåãêî ðàçëàãàþòñÿ ïîä äåéñòâèåì HCl, â ðåçóëüòàòå âûäåëÿåòñÿ èñõîäíûé àëêèí:

Ïîýòîìó àëêèíû ëåãêî âûäåëèòü èç ñìåñè äðóãèõ óãëåâîäîðîäîðîâ.
5. Ïîëèìåðèçàöèÿ. Ïðè ó÷àñòèè êàòàëèçàòîðîâ àëêèíû ìîãóò ðåàãèðîâàòü äðóã ñ äðóãîì, ïðè÷åì â çàâèñèìîñòè îò óñëîâèé, ìîãóò îáðàçîâûâàòüñÿ ðàçëè÷íûå ïðîäóêòû. Íàïðèìåð, ïîä âîçäåéñòâèåì õëîðèäà ìåäè (I) è õëîðèäà àììîíèÿ:

Âèíèëàöåòèëåí (ïîëó÷åííîå ñîåäèíåíèå) ïðèñîåäèíÿåò õëîðîâîäîðîä, îáðàçóÿ õëîðïðåí, êîòîðûé ñëóæèò ñûðüåì äëÿ ïîëó÷åíèÿ ñèíòåòè÷åñêîãî êàó÷óêà:

6. Åñëè àöåòèëåí ïðîïóñêàòü ÷åðåç óãîëü ïðè 600 ºÑ, ïîëó÷àþò àðîìàòè÷åñêîå ñîåäèíåíèå – áåíçîë. Èç ãîìîëîãîâ àöåòèëåíà, ïîëó÷àþò ãîìîëîãè áåíçîëà:


7. Ðåàêöèÿ îêèñëåíèÿ è âîññòàíîâëåíèÿ. Àëêèíû ëåãêî îêèñëÿþòñÿ ïåðìàíãàíàòîì êàëèÿ. Ðàñòâîð îáåñöâå÷èâàåòñÿ, ò.ê. â èñõîäíîì ñîåäèíåíèè åñòü òðîéíàÿ ñâÿçü. Ïðè îêèñëåíèè ïðîèñõîäèò ðàñùåïëåíèå òðîéíîé ñâÿçè ñ îáðàçîâàíèåì êàðáîíîâîé êèñëîòû:

 ïðèñóòñòâèå ìåòàëëè÷åñêèõ êàòàëèçàòîðîâ ïðîèñõîäèò âîññòàíîâëåíèå âîäîðîäîì:

Ïðèìåíåíèå àëêèíîâ.
Íà îñíîâå àëêèíîâ ïðîèçâîäÿò ìíîãî ðàçëè÷íûõ ñîåäèíåíèé, èìåþùèõ øèðîêîå ïðèìåíåíèå â ïðîìûøëåííîñòè. Íàïðèìåð, ïîëó÷àþò èçîïðåí – èñõîäíîå ñîåäèíåíèÿ äëÿ ïðîèçâîäñòâà èçîïðåíîâîãî êàó÷óêà.
Àöåòèëåí èñïîëüçóþò äëÿ ñâàðêè ìåòàëëîâ, ò.ê. ïðîöåññ åãî ãîðåíèÿ âåñüìà ýêçîòåðìè÷íûé.
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Строение, изомерия и гомологический ряд алкинов
Химические свойства алкинов
Получение алкинов
Алкины – непредельные углеводороды, в молекулах которых есть одна тройная связь. Строение и свойства тройной связи определяют характерные химические свойства алкинов. Химические свойства алкинов схожи с химическими свойствами алкенов из-за наличия кратной связи в молекуле.
Для алкинов характерны реакции окисления. Окисление алкенов протекает преимущественно по тройной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан.

При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1.
![]()
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь.
Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан.


Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан.
![]()
![]()
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен.


1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид.

Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
Например, при гидратации пропина образуется пропанон (ацентон).

1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:

Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):

Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации ацетилена образуется полимер линейного или циклического строения.
… –CH=CH–CH=CH–CH=CH–…
2. Окисление алкинов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
2.1. Горение алкинов
Алкины, как и прочие углеводороды, горят с образованием углекислого газа и воды.
Уравнение сгорания алкинов в общем виде:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q
Например, уравнение сгорания пропина:
C3H4 + 4O2 → 3CO2 + 2H2O
2.2. Окисление алкинов сильными окислителями
Алкины реагируют с сильными окислителями (перманганаты или соединения хрома (VI)). При этом происходит окисление тройной связи С≡С и связей С-Н у атомов углерода при тройной связи. При этом образуются связи с кислородом.
При окислении трех связей у атома углерода в кислой среде образуется карбоксильная группа СООН, четырех — углекислый газ СО2. В нейтральной среде — соль карбоновой кислоты и карбонат (гидрокарбонат) соответственно.
Таблица соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| R-C≡ | R-COOH | -COOMe |
| CH≡ | CO2 | Me2CO3 (MeHCO3) |
При окислении бутина-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента СН3–C≡, поэтому образуется уксусная кислота:

При окислении 3-метилпентина-1 перманганатом калия в серной кислоте окислению подвергаются фрагменты R–C и H–C , поэтому образуются карбоновая кислота и углекислый газ:

При окислении алкинов сильными окислителями в нейтральной среде углеродсодержащие продукты реакции жесткого окисления (кислота, углекислый газ) могут реагировать с образующейся в растворе щелочью в соотношении, которое определяется электронным балансом с образованием соответствующих солей.
Например, при окислении бутина-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента R–C≡, поэтому образуется соль уксусной кислоты – ацетат калия

Аналогичные органические продукты образуются при взаимодействии алкинов с хроматами или дихроматами.
Окисление ацетилена протекает немного иначе, σ-связь С–С не разрывается, поэтому в кислой среде образуется щавелевая кислота:
В нейтральной среде образуется соль щавелевой кислоты – оксалат калия:

Обесцвечивание раствора перманганата калия — качественная реакция на тройную связь.
3. Кислотные свойства алкинов
Связь атома углерода при тройной связи (атома углерода в sp-гибридизованном состоянии) с водородом значительно более полярная. чем связь С–Н атома углерода при двойной или одинарной связи (в sp2 и sp3-гибридном состоянии соответственно). Это обусловлено большим вкладом s-орбитали в гибридизованное состояние.
| Гибридизация: | sp | sp2 | sp3 |
| Число s-орбиталей | 1 | 1 | 1 |
| Число p-орбиталей | 1 | 2 | 3 |
| Доля s-орбитали | 50% | 33% | 25% |
Повышенная полярность связи С–Н у атомов углерода при тройной связи в алкинах приводит к возможности отщепления протона Н+, т.е. приводит к появлению у алкинов с тройной связью на конце молекулы (алкинов-1) кислотных свойств.
Ацетилен и его гомологи с тройной связью на конце молекулы R–C≡C–H проявляют слабые кислотные свойства, атомы водорода на конце молекулы могут легко замещаться на атомы металлов.
Алкины с тройной связью на конце молекулы взаимодействуют с активными металлами, гидридами, амидами металлов и т.д.
Например, ацетилен взаимодействует с натрием с образованием ацетиленида натрия.
![]()
Например, пропин взаимодействует с амидом натрия с образованием пропинида натрия.
![]()
Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра (I) или аммиачным раствором хлорида меди (I).
При этом образуются нерастворимые в воде ацетилениды серебра или меди (I):

Алкины с тройной связью на конце молекулы взаимодействуют с аммиачным раствором оксида серебра или аммиачным раствором хлорида меди (I) с образованием белого или красно-коричневого осадка соответственно. Это качественная реакция на алкины с тройной связью на конце молекулы.
Соответственно, алкины, в которых тройная связь расположена не на конце молекулы, не реагируют с аммиачными растворами оксида серебра или хлорида меди (I).
Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, реакции присоединения к алкинам могут происходить в две стадии.
Вначале идет присоединение по месту двойной π-связи с образование производных олефинов, а затем по месту второй π-связи с образованием производных алканов.
Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
Реакции присоединения
1. Гидрирование
Присоединение водорода происходит при нагревании в присутствии металлических катализаторов. Реакция протекает в две стадии: алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем образованием алканов (разрывается вторая π-связь):
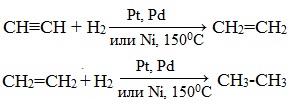
2. Галогенирование
Присоединение галогенов протекает также в две стадии. На первой стадии образуются дигалогеналкены, на второй – тетрагалогеналканы:
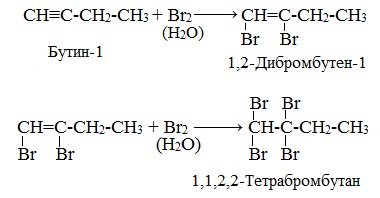
Реакция алкинов с бромной водой является качественной реакцией на алкины. Бромная вода обесцвечивается.
Видеоопыт «Взаимодействие ацетилена с бромной водой»
Видеоопыт «Взаимодействие ацетилена с хлором»
3. Гидрогалогенирование
Галогеноводороды присоединяются к алкинам в две стадии. Вторая стадия идет по правилу Марковникова. Присоединение НCl в отсутствии катализатора идет очень медленно. Катализатором этой реакции служат кислоты Льюиса – соли меди (I) и ртути (II):
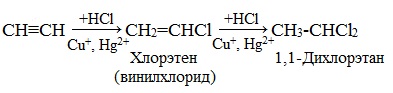
Получаемый продукт – хлористый винил (винилхлорид) – подобно этилену легко полимеризуется, образуя полимер – поливинилхлорид, который широко применяется в производстве поливинилхлоридных смол:
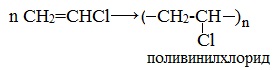
4. Гидратация (реакция Кучерова)
Присоединение воды протекает в присутствии солей ртути (II) при нагревании – HgSO4, Hg (NO3)2 – с образованием уксусного альдегида (при обычных условиях ацетилен с водой не взаимодействует):
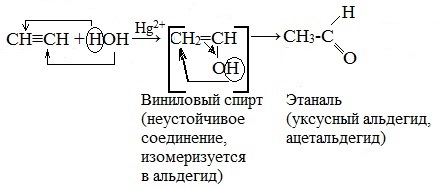
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято назвать виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) — водород гидроксильной группы переходит к соседнему атому углероду. При этом π-связь между атомами углерода разрывается и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С=О по сравнению с двойной связью С=С.
Гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны:
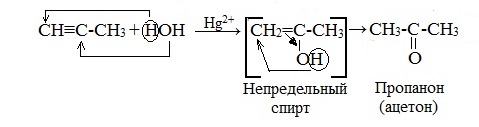
5. Реакции полимеризации
В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты.
1.Димеризация под действием водно-аммиачного раствора CuCl:
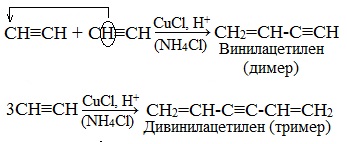
Винилацетилен обладает большой реакционной способностью – присоединяя хлороводород, он образует хлоропрен (2-хлорбутадиен-1,3), используемый для получения искусственного хлорпренового каучука:
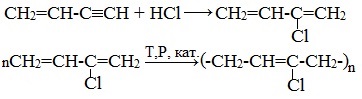
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
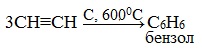
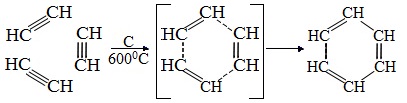
В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например пропин: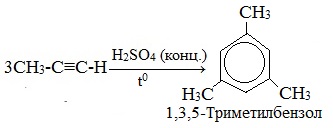
Реакции окисления
1. Горение
При сгорании алкинов происходит их полное окисление до СО2 и Н2О. Горение ацетилена сопровождается выделением большого количества тепла:
![]()
Видеоопыт «Горение ацетилена»
Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси.
Видеоопыт «Взрыв смеси ацетилена с кислородом»
В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест.
2. Неполное окисление
Ацетилен и его гомологи легко окисляются окислителями — КMnO4, K2Cr2O7. Алкины окисляются с разрывом молекулы по тройной связи. Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
Алкины обесцвечивают разбавленный раствор перманганата калия, что доказывает их ненасыщенность.
а) мягкое окисление
Мягкое окисление алкинов происходит без разрыва σ-связи С─С (разрушаются только π-связи).
Например, при взаимодействии ацетилена с разбавленным раствором КMnO4 при комнатной температуре образуется двухосновная щавелевая кислота:
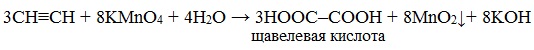
В нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот. При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):

б) Жесткое окисление
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты.
Окисление алкинов перманганатом калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образования карбоновых кислот:
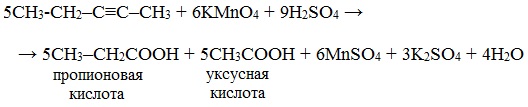
Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих же условиях образованием карбоновой кислоты и выделением углекислого газа: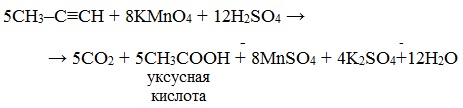
В кислой среде окисление ацетилена идет до щавелевой кислоты или углекислого газа:
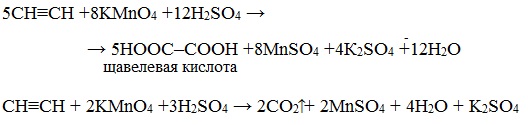
Видеоопыт «Взаимодействие ацетилена с раствором перманганата калия»
Реакция КMnO4 является качественной реакцией на алкины. Раствор перманганата калия обесцвечивается.
Образование солей
Особенностью алкинов, имеющих концевую тройную связь (алкины-1), является их способность проявлять слабые кислотные свойства.
Атомы водорода, связанные с sp-гибридизированными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется поляризацией σ-связи ≡С─Н. В связи с этим атомы водорода могут замещаться атомами металлов, в результате чего образуются соли — ацетилениды.
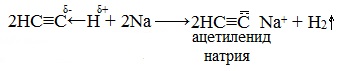
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I).
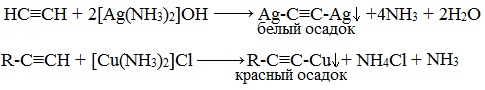
Образование серовато- белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди) служит качественной реакцией на концевую тройную связь.
Видеоопыт «Получение ацетиленида серебра»
Видеоопыт «Получение ацетиленида меди»
Ацетилениды серебра и меди как соли слабых очень кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина.
![]()
Ацетилиниды серебра и меди в сухом виде взрываются от удара. Однако карбид кальция, который также является ацетиленидом, очень устойчив к удару. Он широко используется для получения ацетилена.
Видеоопыт «Неустойчивость ацетиленидов»
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются.
![]()
