Какие гидроксиды обладают амфотерными свойствами
Анонимный вопрос · 5 марта 2019
4,8 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
Амфотерные гидроксиды — это гидроксиды, которые повторяют свойства кислот и оснований ⚗️
????К амфотерным относятся следующие гидроксиды:
????большинство гидроксидов d-элементов (хрома(III), железа, цинка, и др.);
????ряд гидроксидов p-элементов (алюминия, галлия, олова, свинца и др.);
????из гидроксидов s-элементов амфотерным является гидроксид бериллия;
????ХИМИЧЕСКИЕ СВОЙСТВА, СОВПАДАЮЩИЕ С ОСНОВАНИЯМИ
????Реагируют с кислотами
▫️Al(OH)3 + 3HCl = AlCl3 + 3H2O
????Реагируют с кислотными оксидами
▫️2Al(OH)3 + 3SiO2 = Al2(SiO3)3 + 3H2O
????ХИМИЧЕСКИЕ СВОЙСТВА, СОВПАДАЮЩИЕ С КИСЛОТАМИ
????Реагируют со щелочами
1) В растворе:
▫️Al(OH)3 + NaOH = Na[Al(OH)4]
2) При сплавлении:
▫️Al(OH)3 + NaOH = NaAlO2 + 2H2O
????Реагируют с основными оксидами
▫️2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
????Реагируют с солями
▫️2Al(OH)3 + Na2CO3 = 2NaAlO2 + CO2 + 3H2O
????Одно из общих свойств — разложение при нагревании:
▫️2Fe(OH)3 = Fe2O3 + 3H2O
Осуществимы ли реакции:
соль +неметалл,галоген + кислота(без галогена)?
Реакция замещения металла в основаниях по такому же принципу как и в солях? Если металл правее в ряду, значит реакция не идет?
Химик, программист, трансженщина, феминистка
Да легко:
1. Na2S + S -> Na2S2 (Na2S4, Na2S5 и т.д.)
2. H2SO3 + Cl2 + H2O -> H2SO4 + 2HCl
3. С основаниями сложнее, поскольку растовримых в воде оснований мало и все они весьма активных металлов, но если нас устраивает расплав основания, то конечно всё пойдет как по маслу (главное не забыть делать это в инертной атмосфере)
NaOH + K -> Na + KOH
ну и классический термит — это по сути тоже подобный пример реакции (только основной оксид, а не гидроксид)
Fe3O4 + Al -> Al2O3 + Fe
Какими способами доказывается амфотерный характер соединений?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
☘️Амфотерные соединения — это вещества, которые ведут себя, как кислоты и как основания????
Возьмем Al(OH)3. Как доказать, что он амфотерный? ????
????Добавим в него кислоту HCl
Al(OH)3+3HCl=3H2O+AlCl3
Гидроксид алюминия реагирует с кислотой подобно основаниям)
????Теперь возьмём щёлочь NaOH
Al(OH)3+NaOH=Na[Al(OH)4]
Мы видим, что он реагирует основаниями, как кислоты)
Делаем вывод, что он амфотерный
Как найти высшей оксид и гидроксид Астата(At)?
Ну, если есть таблица Менделеева, то просто нужно посмотреть в самый низ группы Астата. Там будет формула высшего оксида
Высший гидроксид можно найти, исходя из высшей степени окисления вещества (как, собственно, и оксид). У Астата — 7 (номер группы). Итак, получается, что высший гидроксид — HAtO4
Что такое MgOHCl? Как можно получить это вещество?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме… · vk.com/mendo_him
????MgOHCl????
✅гидроксохлорид магния
✅это основная соль,так как имеет в своём составе ОН — группу
✅получение :
Mg(OH)2+HCl➡️MgOHCl+H2O
✅Основные соли являются продуктом неполного замещения гидроксидных групп на кислотный остаток
Как определить растворимость кислых солей?
Есть такая таблица растворимости. Это справочный материал его выдают на ЕГЭ экзаменах и тд.
Допустим нужно определить растворимости следующих кислых солей, это соли в которых есть катион, анион и катион водорода: гидрокарбонат натрия ( сода пищевая), дигидрофосфат стронция и гидросульфат свинца. Для этого запишем их формулы и посмотрим какие у них анионы и катионы:
NaHCO3 => Na+ и HCO3-
Sr(H2PO4)2=> Sr2+ и 2H2PO4-
Pb(HSO4)2 => Pb2+ и 2HSO4-
Теперь смотрим в волшебную таблицу
Ищем катион ( это тот что с плюсиком) Na+ и потом смотрим анион( с минусом) HCO3- там стоит буква Р значит растворимо. А вот дигидрофосфат стронция, не растворим, там стоит буква Н. Со свинцом аналогично. Вообще по этой таблице можно посмотреть растворимость как и кислот ( там катион H+), так и оснований (OH-), да и вообще любых солей.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
<.p>
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Например:
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
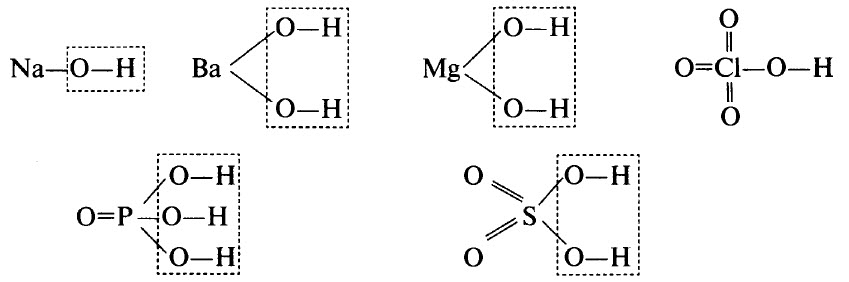
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
Амфоте́рность (от др.-греч. ἀμφότεροι «двоякий, двойственный; обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер[2].
Амфотерность как химическое свойство[править | править код]
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+ ), так и по механизму оснований (отщепление гидроксид-ионов, OH– ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами[3]. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы[2].
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может быть описано как реакции ионного обмена ионов среды с лигандами H2O и OH–. Например, для Al(OH)3 ионные равновесия могут быть записаны следующим образом:
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Ссылки[править | править код]
- Амфотерный // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература[править | править код]
- Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с
Примечания[править | править код]
- ↑ Танганов Б.Б. Химические методы анализа. — Улан-Удэ, 2005.- 550 с.
- ↑ 1 2 3 Амфотерные гидроксиды и их поведение в водных растворах / Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- ↑ 1 2 Угай Я. А. Общая и неорганическая химия. — М.: Высшая школа, 1997. — 527 с.
- ↑ Автопротолиз воды / Жуков С. Т. Химия. 8-9 класс
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. – М.: Химия, 2000. – 480 с.: ил.
- ↑ Кислотные и основные свойства / Общая химия. Под ред. Е. М. Соколовской и Л. С. Гузея. — М.: Изд-во Моск. ун-та, 1989. — 640 с. ун-та, 1989. — 640 с .
