Какие физическими свойствами характеризуются вещества с ионными

Кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионная решетка
Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. Примеры: КОН, СаСО$_3$, СН$_3$СООК, NH$_4$NO$_3$, [CH$_3$NH$_3$]Cl, С$_2$Н$_5$ОК. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.

Свойства ионных кристаллов:
твердые, но хрупкие;
отличаются высокими температурами плавления;
нелетучи, не имеют запаха;
расплавы ионных кристаллов обладают электропроводностью;
многие растворимы в воде. При растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомная решетка
В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит — рисунок), бора, кремния, германия, оксида кремния SiO$_2$ (кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN. Свойства: высокая твердость, высокие температуры плавления, нерастворимость, нелетучесть, отсутствие запаха.
Свойства веществ с атомной кристаллической решеткой:
высокая твердость;
высокие температуры плавления;
нерастворимость;
нелетучесть;
отсутствие запаха.
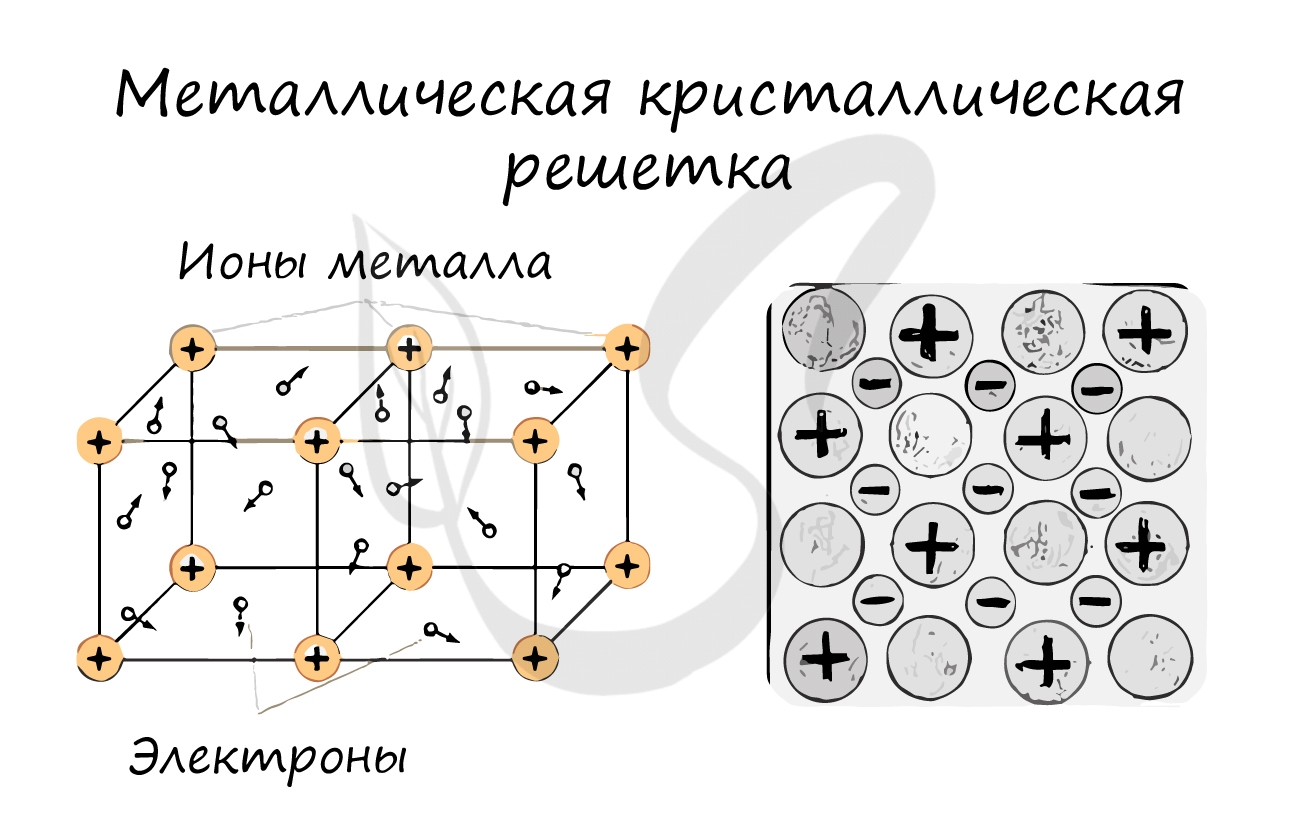
Металлическая решетка
Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость.

Молекулярные решетки
В узлах — молекулы веществ, которые удерживаются в узлах решетки с помощью слабых межмолекулярных сил.
Молекулярное строение имеют:
все органические вещества (кроме солей);
вещества — газы и жидкости;
легкоплавкие и летучие твердые вещества, в молекулах которых ковалентные связи (полярные и неполярные).
Подобные вещества часто имеют запах.
Обобщающая таблица
Кристаллические решетки, вид связи и свойства веществ
| Тип решетки | Виды частиц в узлах решетки | Вид связи между частицами | Примеры веществ | Физические свойства веществ |
| Ионная | Ионы | Ионная — связь прочная | Соли, галогениды (IA, IIA), оксиды и гидроксиды щелочных и щел.-зем. металлов | Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток |
| Атомная | Атомы | 1. Ковалентная неполярная — очень прочная 2. Ковалентная полярная связь — очень прочная. Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si) | Сложные вещества:оксид алюминия (Al$_2$O$_3$), оксид кремния (IV) SiO$_2$ | Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде |
| Молекулярная | Молекулы | Между молекулами слабые силы межмолекулярного притяжения, внутри молекул прочная ковалентная связь | При обычных условиях – газы, жидкости или летучие твердые вещества (О$_2$, Н$_2$, Cl$_2$, N$_2$, Br$_2$, H$_2$O, CO$_2$, HCl); сера, белый фосфор, иод; органические вещества | Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость |
| Металлическая | Атом-ионы | Металлическая разной прочности | Металлы и сплавы | Ковкие, обладают блеском, пластичностью, тепло- и электропроводны |
Взаимосвязь
типа химической связи с видом кристаллической решеткиВещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще
всего имеют кристаллическое строение).Кристаллическое строение характеризуется
правильным расположением частиц в определенных точках пространства. При
соединении этих точек воображаемыми прямыми линиями образуется так называемая
кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.В узлах кристаллической решетки могут
находиться ионы, атомы или молекулы.В зависимости от вида частиц,
расположенных в узлах кристаллической решетки, и характера связи между ними
различают четыре типа кристаллических решеток:
·
ионные,·
атомные,·
молекулярные и·
металлические.Ионная решетка
Эту решетку образуют все вещества с
ионным типом связи — соли, щелочи, бинарные соединения активных металлов с
активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты,
соли аммония и аминов. В узлах решетки — ионы, между которыми существует
электростатическое притяжение. Ионная связь очень прочная.Примеры:
КОН, СаСО3, СН3СООК, NH4NO3, [CH3NH3]Cl,
С2Н5ОК.Свойства ионных кристаллов:
· твердые, но хрупкие;
· отличаются высокими температурами
плавления;· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают
электропроводностью;· многие растворимы в воде; при растворении
в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят
электрический ток.Металлическая решетка
Характерна для веществ с металлической
связью. Реализуется в простых веществах — металлах и их сплавах. В узлах
решетки — атомы и катионы металла, при этом электроны металла обобществляются и
образуют так называемый электронный газ, который движется между узлами решетки,
обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и
обусловлены свойства веществ с
металлической решеткой:·
тепло- и электропроводность;·
обладают металлическим блеском;·
высокие температуры плавления.Атомная решетка
В узлах решетки — атомы, связанные
ковалентными связями. Химическая связь — ковалентная полярная или неполярная.
Атомная кристаллическая решетка характерна для углерода (алмаз, графит),
бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц,
речной песок), карбида кремния SiC (карборунд), нитрида бора BN.Свойства веществ с атомной решеткой:
·
высокая твердость;·
высокие температуры плавления;·
нерастворимость;·
нелетучесть;·
отсутствие запаха.Молекулярная решетка
В узлах — молекулы веществ, которые
удерживаются в решетке с помощью слабых межмолекулярных сил.Молекулярное
строение имеют:o все органические вещества (кроме солей);
o вещества — газы и жидкости;
o легкоплавкие и летучие твердые вещества, в молекулах
которых ковалентные связи (полярные и неполярные).Подобные вещества часто имеют запах.
Обобщающая таблица
Кристаллические решетки, вид связи и
свойства веществ
Тип решетки
Виды частиц в узлах решетки
Вид связи между частицами
Примеры веществ
Физические свойства веществ
Ионная
Ионы
Ионная связь — прочная
Соли, галогениды (IA,IIA), оксиды и гидроксиды щелочных и щел.-зем.
металловТвердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в
воде, расплавы проводят электрический токАтомная
Атомы
1. Ковалентная неполярная -очень прочная
2. Ковалентная полярная связь — очень прочная
Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si)
Сложные вещества: оксид алюминия (Al2O3), оксид кремния
(IV) SiO2Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде
Молекулярная
Молекулы
Между молекулами — слабые силы межмолекулярного притяжения, внутри
молекул — прочная ковалентная связьПри обычных условиях — газы, жидкости или летучие твердые вещества:
(О2,Н2,Cl2,N2,Br2,
H2O, CO2, HCl); сера, белый фосфор, йод; органические
веществаНепрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую
твердостьМеталлическая
Атом-ионы
Металлическая связь — разной прочности
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
источник информации: https://foxford.ru/wiki/himiya/vzaimosvyaz-tipa-himicheskoy-svyazi-s-vidom-kristallicheskoy-reshetki
Ken Ba · 12 декабря 2018
3,0 K
- Такие соединения очень прочные, с энергией 300-700 кДж
- Связи в таких соединениях ненаправленные и ненасыщенные
- В процессе образования молекул с ионной связью не происходит полной передачи электронов, поэтому стопроцентной ионной связи в природе не существует.
- Такие соединения твердые кристаллические вещества с высокой температурой плавления и кипения
- Большая часть таких соединений растворяется в воде, а их растворы проводят электрический ток
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Что такое ионная связь?????
Это связь,которая образуется между катионами и анионами за счёт их притяжения
????Свойства соединений с ионной связью????
✅Прочная связь( энергия ионной связи равна примерно 300-700кДж/моль)
✅Ионные соединения растворяются в воде
✅На самом деле ,чистой ионной связи не существует(соединения имеют несколько видов связей)
✅Расплавы и растворы с… Читать далее
Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью
Студент Massachusetts Institute of Technology, получил приглашения от Harvard, Columbia… · ischemist.ru/blog
Немного уточню.
Водородная связь образуется между атомами водорода, которые связаны с электроотрицательными атомами, а значит несут на себе частично положительный зарят (δ+) и атомами с неподеленной электронной парой. Последними, как правило, являются электроотрицательные атомы.
При этом, стоит заметить, что у атомов водорода электроны находятся на 1s орбитали. Для образования прочного взаимодействия с неподеленными электронными парами на других атомах, эти самые пары должны находиться на орбиталях со схожей геометрией. Иными словами, если мы возьмем элементы третьего и ниже периодов, у которых пары сидят на 3p орбиталях, например, разница в размере между 3p и 1s настолько велика, что водородная связь образовываться не будет.
Таким образом, водородная связь может образовываться между а) атомами водорода с δ+ и б) атомами N, O, F.
Прочитать ещё 1 ответ
Какие бывают ионы?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Ионы-это атомы, у которых отобрали электроны, ну или подарили их????
Ионы различают
☘️По количеству элементов
????Простые. Они состоят из одного элемента )
Na+, K+, Cl-
????Сложные. У них несколько химических элементов
SO3 2-, OH-
☘️По заряду
????Катионы-это положительные ионы???? в них превратились атомы, у которых забрали электроны:(
K+, Na+, Ba2+
????Анионы-это отрицательные ионы???? это бывшие атомы, которым однажды подарили электрон
Cl-, SO42-, SO32-
Прочитать ещё 3 ответа
Какие связи формируются в комплексном соединении?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Что такое комплексное соединение?
Это сложная химическая частица)
Давайте разберёмся с её строением????
????У комплексного соединения есть внешняя и внутренняя сфера
????Во внутренней сфере лежит комплексообразователь (катион металла) и лиганд (это всё остальное кроме металла ????)
⚠️Между линандом и комплексообразователем связи по донорно-акцепторному механизму
У катиона металла есть свободные атомные орбитали, а у лиганда лишние электроны, которыми он с удовольствием делится????так и получается связь
Какие факторы определяют электропроводимость вещества?
Инженер, немного пилот. Физик, химик, электронщик-любитель. Независимый звукореж…
Электропроводность вещества определяется наличием свободных (то есть, способных перемещаться) носителей зарядов. В металлах это электроны, свободно перемещающиеся между атомами кристаллической решётки, в полупроводниках — электроны и «дырки» (гипотетический носитель положительного заряда, отсутствие электрона на атомной орбитали, может «перепрыгивать» с одного атома на другой), в растворах и расплавах электролитов — ионы. Кроме того, в вакууме, который, как известно, не вещество, тоже возможен электрический ток, если есть свободные электроны (в электронной лампе, например).
Для каких элементов характерны летучие водородные соединения?
Автор проекта ChemistryToday, человек, заинтересованный химией и продвигающий её на… · vk.com/chemtoday
Летучие водородные соединения (ЛВС) образуют, в основном, неметаллы: практически у каждого из них есть такие соединения — гидриды элемента или элемент’иды водорода.
Посмотрим на 2 период Таблицы Менделеева: ЛВС характерны для бора (различные бораны BnHm), углерода (вся органика! CxHy), азота (аммиак, например NH3), кислорода (вода!) и фтора (плавиковая кислота HF). Это как раз все неметаллы 2 периода (за исключением неона, благородного газа).
В 3 периоде всё то же самое: алюминий образует AlH3, алан, кремний — силан SiH4, фосфор — фосфин PH3, сера — сероводород H2S, хлор — хлороводород HCl.
Но так как при движении вниз по группе «металличность» элементов повышается, то для галлия (который под алюминием) уже гораздо менее характерно образование водородных соединений, тем более летучих, поэтому галлий уже выбывает из ЛВС неметаллов 4 периода. Следующий за ним — германий — образует герман GeH4, мышьяк — арсин AsH3, селен — селеноводород H2Se, бром — бромоводород HBr.
Все остальные также существуют: PbH4, SnH4, H2Te, SbH3, BiH3 (очень нестабилен), HI, HAt, H2Po.
Ê ôèçè÷åñêèì ñâîéñòâàì âåùåñòâà ïðèíÿòî îòíîñèòü òå, êîòîðûå ôèêñèðóþòñÿ íàáëþäåíèåì ëèáî èçìåðåíèåì, áåç ïåðåõîäà â èíîå âåùåñòâî.
Íàèáîëåå ñóùåñòâåííûå ôèçè÷åñêèå ñâîéñòâà âåùåñòâà:
— àãðåãàòíîå ñîñòîÿíèå ïðè îïðåäåëåííûõ òåìïåðàòóðå è äàâëåíèè;
— çàïàõ (èëè åãî îòñóòñòâèå);
— öâåò, áëåñê (èëè èõ îòñóòñòâèå);
— ïëîòíîñòü;
— òåïëîïðîâîäíîñòü;
— ýëåêòðîïðîâîäíîñòü (èëè íå ýëåêòðîïðîâîäíîñòü).
— ðàñòâîðèìîñòü (èëè íåðàñòâîðèìîñòü) â âîäå;
— òåìïåðàòóðà ïëàâëåíèÿ;
— òåìïåðàòóðà êèïåíèÿ;
Ñïèñîê ôèçè÷åñêèõ ñâîéñòâ òâåðäûõ âåùåñòâ ìîæíî óâåëè÷èòü äîáàâèâ òâåðäîñòü, ïëàñòè÷íîñòü (èëè õðóïêîñòü), à äëÿ êðèñòàëëè÷åñêèõ — äîïîëíèòåëüíî è ôîðìó êðèñòàëëîâ. Îïèñûâàÿ ñâîéñòâà æèäêîñòè, óêàçàòü ïîäâèæíàÿ îíà ëèáî ìàñëÿíèñòàÿ.
Âèçóàëüíî ïîëó÷èòñÿ îöåíèòü ñëåäóþùèå ôèçè÷åñêèå õàðàêòåðèñòèêè: öâåò, çàïàõ, âêóñ, ôîðìó êðèñòàëëîâ. Ïëîòíîñòü, ýëåêòðîïðîâîäíîñòü, òåìïåðàòóðó ïëàâëåíèÿ è êèïåíèÿ ôèêñèðóþò, âûïîëíèâ çàìåðû. Äàííûå î ôèçè÷åñêèõ ñâîéñòâàõ áîëüøèíñòâà âåùåñòâ ñèñòåìàòèçèðîâàíû â ïðîôèëüíûõ ñïðàâî÷íèêàõ.
Ôèçè÷åñêèå ñâîéñòâà âåùåñòâà îáóñëîâëåíû àãðåãàòíûì ñîñòîÿíèåì. Ê ïðèìåðó, ïëîòíîñòü ëüäà, âîäû è âîäÿíîãî ïàðà ðàçíûå âåëè÷èíû. Ó ãàçîîáðàçíîãî êèñëîðîäà öâåò îòñóòñòâóåò, à ó æèäêîãî îí ãîëóáîé.
Çíàíèå ôèçè÷åñêèõ ñâîéñòâ ñïîñîáñòâóåò îïðåäåëåíèþ íåìàëîãî ÷èñëà âåùåñòâ. Ê ïðèìåðó, óíèêàëüíîñòü ìåäè â òîì, ÷òî îíà åäèíñòâåííûé ìåòàëë êðàñíîãî öâåòà. Èñêëþ÷èòåëüíîñòü ïîâàðåííîé ñîëè – åå ñîëåíûé âêóñ. Öâåò òâåðäîãî éîäà áëèçîê ê ÷åðíîìó, ïðè íàãðåâå îí ñòàíîâèòüñÿ òåìíî-ôèîëåòîâûì ïàðîì.  ïðåîáëàäàþùåì ÷èñëå ñèòóàöèé äëÿ òîãî ÷òîáû «óãàäàòü» âåùåñòâà òðåáóåòñÿ àíàëèçèðîâàòü ñîâîêóïíîñòü õàðàêòåðíûõ îñîáåííîñòåé.
Êàëüêóëÿòîðû ïî ôèçèêå | |
| Ðåøåíèå çàäà÷ ïî ôèçèêå, ïîäãîòîâêà ê ÝÃÅ è ÃÈÀ, ìåõàíèêà òåðìîäèíàìèêà è äð. | |
| Êàëüêóëÿòîðû ïî ôèçèêå | |
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå âåùåñòâà | |
| Ìîëåêóëÿðíîå ñòðîåíèå âåùåñòâ, ôèçè÷åñêèå è õèìè÷åñêèå ñâîéñòâà âåùåñòâ, ñòðîåíèå âåùåñòâà. | |
| Õèìè÷åñêèå âåùåñòâà | |
Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó ôèçèêè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Âåùåñòâî. Õèìè÷åñêèå ñâîéñòâà. | |
| Õèìè÷åñêèå ñâîéñòâà — óìåíèå âåùåñòâ ( õèìè÷åñêèõ ýëåìåíòîâ , ïðîñòûõ âåùåñòâ è õèìè÷åñêèõ ñîåäèíåíèé ) âçàèìîäåéñòâîâàòü ñ èíûìè âåùåñòâàìè ëèáî âèäîèçìåíÿòüñÿ ïîä âîçäåéñòâèåì íåêîòîðûõ ôàêòîðîâ. | |
| Âåùåñòâî. Õèìè÷åñêèå ñâîéñòâà. | |
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
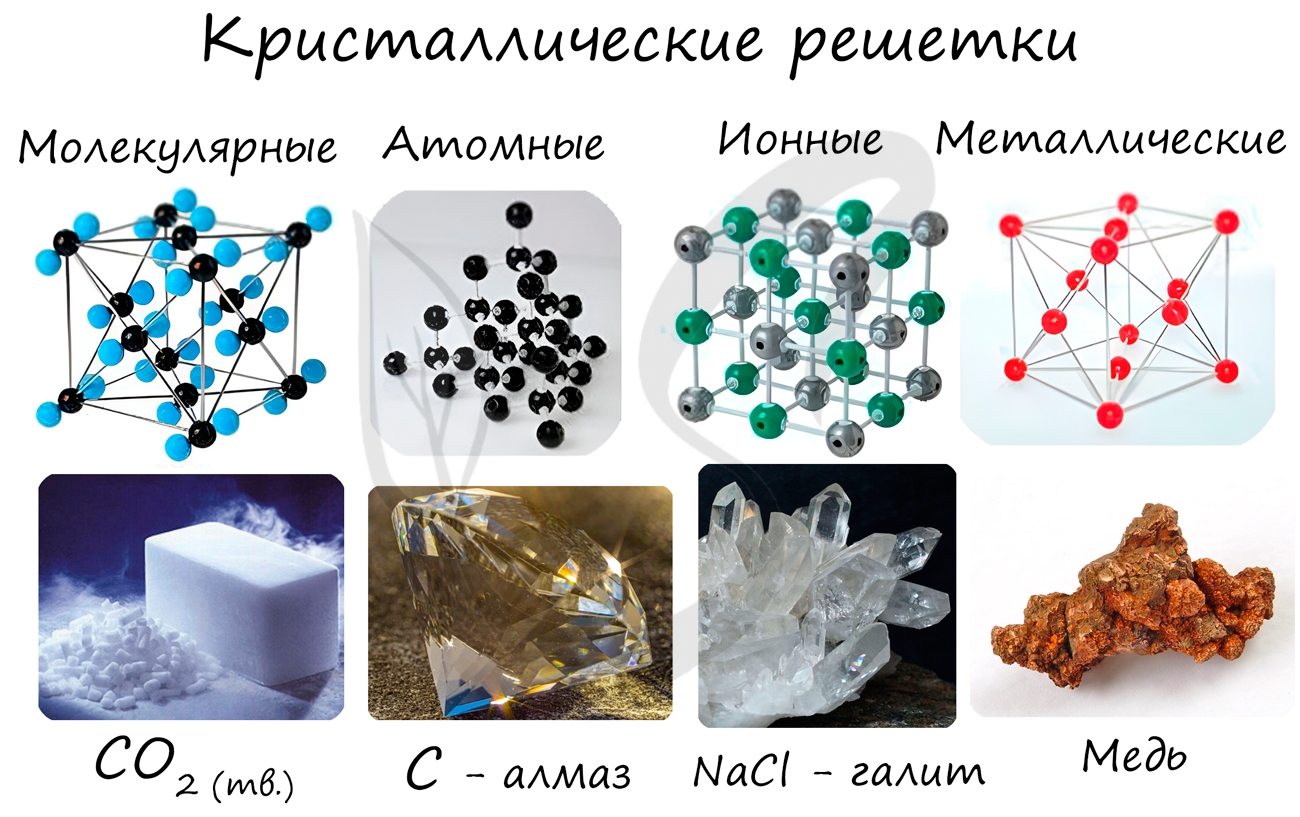
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
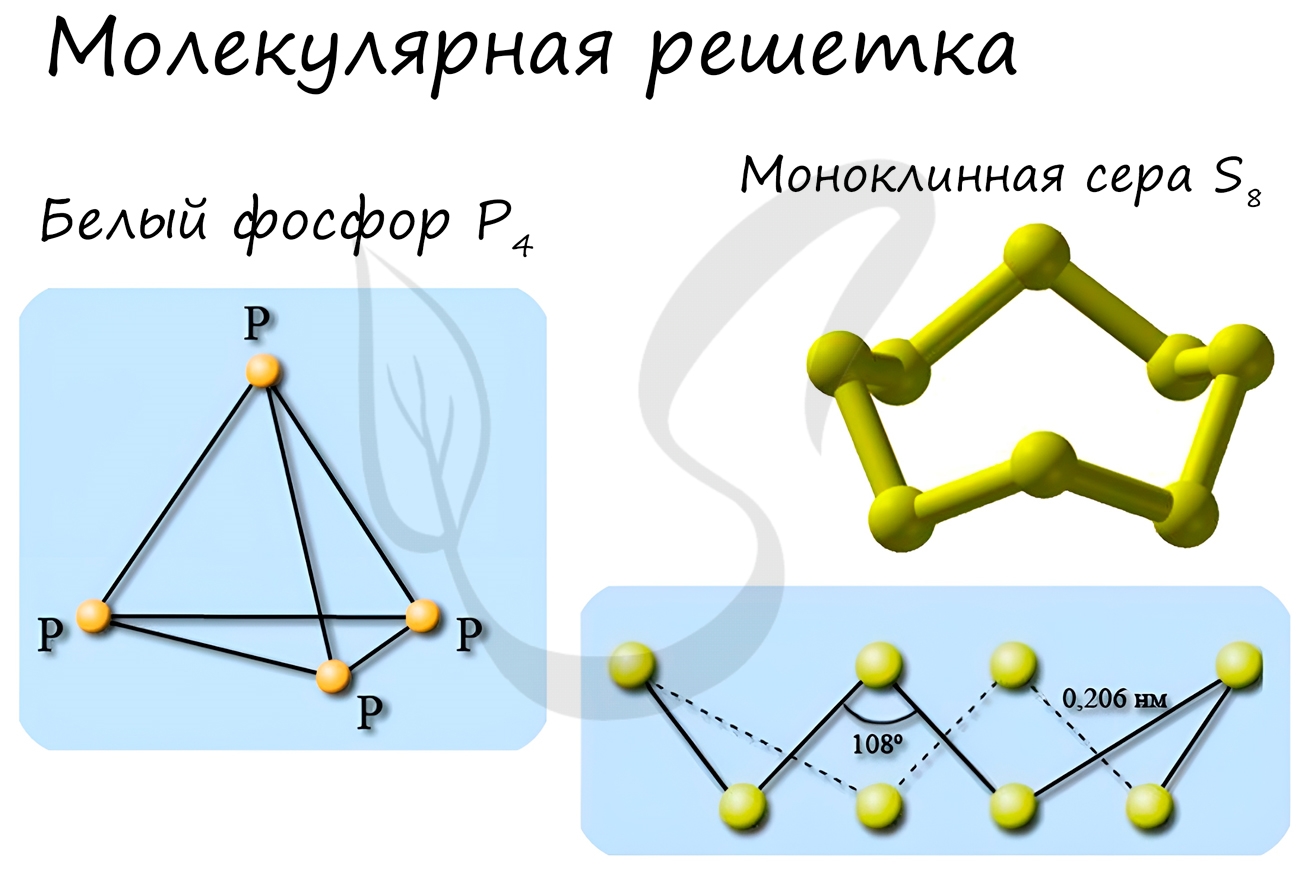
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.

