Какие физические свойства имеют кислоты

1. Сила кислот уменьшается в ряду:
HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т.е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
Аналогичным образом можно получить и слабую плавиковую кислоту:
KF(тв.) + H2SO4(к) → KHSO4 + HF
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
H2SiO3 → SiO2 + H2O
Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет
H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
H2SO4(р) + Zn → ZnSO4 + H2
6HCl + 2Fe → 2FeCl3 + 3H2
Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9.2) Азотная кислота
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки
. Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
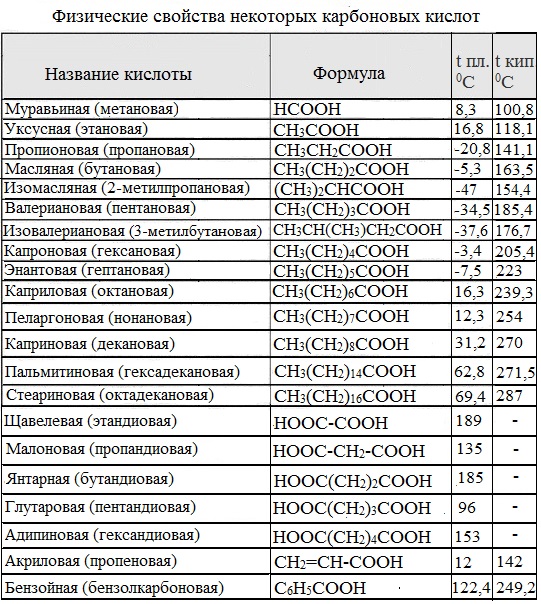
Низшие насыщенные карбоновые кислоты (С1-С3) при обычных условиях представляют собой легкоподвижные жидкости, обладающие характерным острым запахом. 
 Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Кислоты состава С4-С9 – вязкие маслянистые жидкости с неприятным запахом, напоминающим запах пота, плохо растворимые в воде (разветвленные кислоты до С13 — жидкости). Высшие карбоновые кислоты (с С10) — твердые вещества, без запаха, нерастворимые в воде.
Алифатические карбоновые кислоты с количеством атомов углерода более 10 относят к высшим жирным кислотам (ВЖК), так как подавляющее большинство из них могут быть выделены из жиров животного или растительного происхождения.
Ненасыщенные кислоты при комнатной температуре – жидкости. Все дикарбоновые и ароматические кислоты при комнатной температуре – кристаллические вещества.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях. С увеличением молекулярной массы кислот растворимость в воде уменьшается. Высшие карбоновые кислоты, например, пальмитиновая С15Н31СООН и стеариновая С17Н35СООН – бесцветные твердые вещества, не растворимые в воде.
Монокарбоновые кислоты хорошо растворяются также во многих органических растворителях.

С увеличением числа атомов углерода в молекулах кислот и соответственно, с ростом относительной молекулярной массы температура кипения увеличивается, запах ослабевает и исчезает.
Температуры плавления кислот с четным числом углеродных атомов имеют более высокие температуры плавления, чем с нечетным числом. С увеличением числа углеродных атомов в молекуле кислоты температура плавления уменьшается и где-то после С25 практически сходит на нет.
При одной и той же длине углеводородного радикала температуры плавления и кипения ненасыщенных кислот зависят от наличия кратных связей – с ростом их числа соответствующие температуры уменьшаются.
Температуры кипения и плавления кислот значительно выше температур кипения и плавления спиртов и альдегидов с тем же количеством атомов углерода.
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей. Водородная связь, образуемая водородом гидроксильной группы одной молекулы с карбонильным кислородом другой, более прочная, чем в спиртах.
В твердом и жидком состоянии молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей в устойчивые циклические димеры:
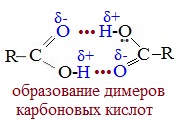
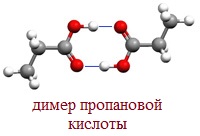
Между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
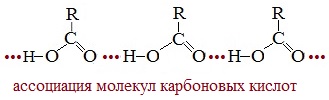
Молекулы муравьиной и уксусной кислот за счёт водородных связей могут образовывать димеры, которые не разрушаются даже в паровой фазе. 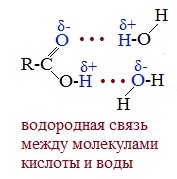 Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Растворимость карбоновых кислот в воде несколько выше, чем у спиртов, так как и с водой кислоты образуют более прочные водородные связи.
В водных растворах кислоты образуют линейные димеры:

Отсутствие среди карбоновых кислот газообразных веществ связано с межмолекулярной ассоциацией (соединением) молекул посредством водородных связей.
 Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
 Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
3-9% водный раствор кислоты известен под названием столового уксуса, который применяется как приправа к пище. 70-80% уксусная кислота называется уксусной эссенцией.
Уксусная кислота смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.
Видеоопыт «Замораживание уксусной кислоты (демонстрация ледяной уксусной кислоты)»

Пальмитиновая и стеариновая кислоты — твердые вещества, белого цвета, жирные на ощупь, нерастворимы в воде, умеренно растворимы в спирте, эфире, хлороформе и других органических растворителях.
 Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,4С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,4С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
Видеоопыт «Возгонка бензойной кислоты»
Карбоновые кислоты
Êàðáîíîâûìè êèñëîòàìè íàçûâàþò ñîåäèíåíèÿ, â êîòîðûõ ñîäåðæèòñÿ êàðáîêñèëüíàÿ ãðóïïà:
 .
.
Êàðáîíîâûå êèñëîòû ðàçëè÷àþò:
- îäíîîñíîâíûå êàðáîíîâûå êèñëîòû;
- äâóõîñíîâíûå (äèêàðáîíîâûå) êèñëîòû (2 ãðóïïû ÑÎÎÍ).
 çàâèñèìîñòè îò ñòðîåíèÿ êàðáîíîâûå êèñëîòû ðàçëè÷àþò:
- àëèôàòè÷åñêèå;
- àëèöèêëè÷åñêèå;
- àðîìàòè÷åñêèå.
Ïðèìåðû êàðáîíîâûõ êèñëîò.

Åñëè â ðàäèêàëå âîäîðîä ïîìåíÿòü íà ëþáóþ ôóíêöèîíàëüíóþ ãðóïïó, òî òàêèå êèñëîòû íàçûâàþòñÿ ãåòåðîôóíêöèîíàëüíûìè. Ñðåäè íèõ: àìèíîêèñëîòû (ïðîòîí çàìåùåí íà àìèíî-ãðóïïó), íèòðîêèñëîòû (àòîì âîäîðîäà çàìåùåí íà íèòðî-ãðóïïó) è ò.ä.
Åñëè ÷èñëî àòîìîâ óãëåðîäà â êèñëîòå áîëüøå 6, òî òàêàÿ êèñëîòà íàçûâàåòñÿ æèðíîé.
Ñòðîåíèå êàðáîíîâûõ êèñëîò.
Êàðáîêñèëüíàÿ ãðóïïà ñîñòîèò èç Ñ=Î è ÎÍ ãðóïïû. Íà ñâîéñòâà êèñëîòû âëèÿþò îáà ýòè ïîêàçàòåëÿ.  ãðóïïå Ñ=Î àòîì óãëåðîäà îáëàäàåò ÷àñòè÷íî ïîëîæèòåëüíûì çàðÿäîì è ïðèòÿãèâàåò íåïîäåëåííóþ ïàðó àòîìà êèñëîðîäà èç ãèäðîêñèëüíîé ãðóïïû. Ïðè ýòîì íà êèñëîðîäå ýëåêòðîííàÿ ïëîòíîñòü ïîíèæàåòñÿ è ñâÿçü Î-Í îñëàáëÿåòñÿ:

Ãðóïïà ÎÍ «íåéòðàëèçóåò» ïîëîæèòåëüíûé çàðÿä íà ãðóïïå Ñ=Î, êîòîðàÿ ïåðåñòàåò âñòóïàòü â ðåàêöèè ïðèñîåäèíåíèÿ, êîòîðûå òàê õàðàêòåðíû äëÿ êàðáîíèëüíûõ êèñëîò.
Êàê íàçûâàòü êàðáîíîâûõ êèñëîò?
Íàëè÷èå ÑÎÎÍ ãðóïïû îáîçíà÷àåòñÿ îêîí÷àíèåì –îâàÿ êèñëîòà.
Íóìåðîâàòü öåïü íà÷èíàþò ñ àòîìà óãëåðîäà êàðáîêñèëüíîé ãðóïïû, íàïðèìåð:

Êàðáîêñèëüíóþ ãðóïïó ðàññìàòðèâàþò â êà÷åñòâå çàìåñòèòåëÿ. Íàïðèìåð,

Èçîìåðèÿ êàðáîíîâûõ êèñëîò.
Äëÿ êàðáîíîâûõ êèñëîò õàðàêòåðíà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà, ïîëîæåíèå êðàòíîé ñâÿçè, ìåæêëàññîâàÿ èçîìåðèÿ, ïðîñòðàíñòâåííàÿ èçîìåðèÿ è èçîìåðèÿ ïîëîæåíèÿ ôóíêöèîíàëüíîé ãðóïïû:




Ôèçè÷åñêèå ñâîéñòâà êàðáîíîâûõ êèñëîò.
Îáùàÿ ôîðìóëà êèñëîò CnH2n+1COOH. Íèçøèå êèñëîòû â íîðìàëüíûõ óñëîâèÿõ ïðåäñòàâëÿþò ñîáîé æèäêîñòè, êîòîðûå îáëàäàþò õàðàêòåðíûì çàïàõîì. Íà÷èíàÿ ñ Ñ10 – òâåðäûå âåùåñòâà.
Òâåðäûå êèñëîòû íåðàñòâîðèìû â âîäå, à êèñëîòû ñ 1-3 êîëè÷åñòâîì àòîìîâ óãëåðîäà íåîãðàíè÷åííî ñìåøèâàþòñÿ ñ âîäîé.

Ïîëó÷åíèå êàðáîíîâûõ êèñëîò .
1. Îêèñëåíèå ïåðâè÷íûõ ñïèðòîâ ïåðìàíãàíàòîì êàëèÿ è äèõðîìàòîì êàëèÿ:

2. Ãèáðîëèç ãàëîãåíçàìåùåííûõ óãëåâîäîðîäîâ, ñîäåðæàùèõ 3 àòîìà ãàëîãåíà ó îäíîãî àòîìà óãëåðîäà:

3. Ïîëó÷åíèå êàðáîíîâûõ êèñëîò èç öèàíèäîâ:

Ïðè íàãðåâàíèè íèòðèë ãèäðîëèçóåòñÿ ñ îáðàçîâàíèåì àöåòàòà àììîíèÿ:

Ïðè ïîäêèñëåíèÿ êîòîðîãî âûïàäàåò êèñëîòà:

4. Èñïîëüçîâàíèå ðåàêòèâîâ Ãðèíüÿðà:

5. Ãèäðîëèç ñëîæíûõ ýôèðîâ:

6. Ãèäðîëèç àíãèäðèäîâ êèñëîò:

7. Ñïåöèôè÷åñêèå ñïîñîáû ïîëó÷åíèÿ êàðáîíîâûõ êèñëîò:
Ìóðàâüèíàÿ êèñëîòà ïîëó÷àåòñÿ ïðè íàãðåâàíèè îêñèäà óãëåðîäà (II) ñ ïîðîøêîîáðàçíûì ãèäðîêñèäîì íàòðèÿ ïîä äàâëåíèåì:

Óêñóñíóþ êèñëîòó ïîëó÷àþò êàòàëèòè÷åñêèì îêèñëåíèåì áóòàíà êèñëîðîäîì âîçäóõà:

Áåíçîéíóþ êèñëîòó ïîëó÷àþò îêèñëåíèåì ìîíîçàìåùåííûõ ãîìîëîãîâ ðàñòâîðîì ïåðìàíãàíàòà êàëèÿ:

Ðåàêöèÿ Êàííèöèàðî. Áåíçàëüäåãèä îáðàáàòûâàþò 40-60% ðàñòâîðîì ãèäðîêñèäà íàòðèÿ ïðè êîìíàòíîé òåìïåðàòóðå.

Õèìè÷åñêèå ñâîéñòâà êàðáîíîâûõ êèñëîò.
 âîäíîì ðàñòâîðå êàðáîíîâûå êèñëîòû äèññîöèèðóþò:

Ðàâíîâåñèå ñäâèíóòî ñèëüíî âëåâî, ò.ê. êàðáîíîâûå êèñëîòû ÿâëÿþòñÿ ñëàáûìè.
Çàìåñòèòåëè âëèÿþò íà êèñëîòíîñòü âñëåäñòâèå èíäóêòèâíîãî ýôôåêòà. Òàêèå çàìåñòèòåëè îòòÿãèâàþò ýëåêòðîííóþ ïëîòíîñòü íà ñåáÿ è íà íèõ âîçíèêàåò îòðèöàòåëüíûé èíäóêòèâíûé ýôôåêò (-I). Îòòÿãèâàíèå ýëåêòðîííîé ïëîòíîñòè ïðèâîäèò ê ïîâûøåíèþ êèñëîòíîñòè êèñëîòû. Ýëåêòðîíîäîíîðíûå çàìåñòèòåëè ñîçäàþò ïîëîæèòåëüíûé èíäóêòèâíûé çàðÿä.

1. Îáðàçîâàíèå ñîëåé. Ðåàãèðîâàíèå ñ îñíîâíûìè îêñèäàìè, ñîëÿìè ñëàáûõ êèñëîò è àêòèâíûìè ìåòàëëàìè:

Êàðáîíîâûå êèñëîòû – ñëàáûå, ò.ê. ìèíåðàëüíûå êèñëîòû âûòåñíÿþò èõ èç ñîîòâåòñòâóþùèõ ñîëåé:

2. Îáðàçîâàíèå ôóíêöèîíàëüíûõ ïðîèçâîäíûõ êàðáîíîâûõ êèñëîò:


3. Ñëîæíûå ýôèðû ïðè íàãðåâàíèè êèñëîòû ñî ñïèðòîì â ïðèñóòñòâèå ñåðíîé êèñëîòû – ðåàêöèÿ ýòåðèôèêàöèè:

4. Îáðàçîâàíèå àìèäîâ, íèòðèëîâ:



3. Ñâîéñòâà êèñëîò îáóñëàâëèâàþòñÿ íàëè÷èåì óãëåâîäîðîäíîãî ðàäèêàëà. Åñëè ïðîòåêàåò ðåàêöèÿ â ïðèñóòñòâèå êðàñíîãî ôîñôîðà, òî îáðàçóåò ñëåäóþùèé ïðîäóêò:

4. Ðåàêöèÿ ïðèñîåäèíåíèÿ.

5. Îêèñëèòåëüíî-âîññòàíîâèòåëüíûå ðåàêöèè. Ïðè âîññòàíîâëåíèè â ïðèñóòñòâèå êàòàëèçàòîðîâ:

Èñêëþ÷åíèå: ìóðàâüèíàÿ êèñëîòà:

6. Ðåàêöèÿ ñåðåáðÿíîãî çåðêàëà:


7. Îêèñëÿåòñÿ õëîðîì:

8. Äåêàðáîêñèëèðîâàíèå. Ðåàêöèþ ïðîâîäÿò ñïëàâëåíèåì ùåëî÷è ñ ñîëüþ ùåëî÷íîãî ìåòàëëà êàðáîíîâîé êèñëîòû:

9. Äâóõîñíîâíàÿ êèñëîòà ëåãêî îòùåïëÿåò ÑÎ2 ïðè íàãðåâàíèè:

